休眠期石蒜鳞茎NSC分布格局
2021-01-08蔡军火魏绪英陈慧婷马美霞
蔡军火 ,魏绪英,陈慧婷,冯 浪,张 瑶,马美霞,张 露*
(1.江西农业大学园林与艺术学院,江西南昌 330045;2.江西财经大学艺术学院,江西南昌 330032)
【研究意义】石蒜在民间又被称为蟑螂花、龙爪花,为石蒜科(Amaryllidaceae)石蒜属(Lycoris)植物[1],具有自发的“夏眠”特性[2],秋季花后萌叶,花叶不相见,被称为“魔术花”。其夏眠习性与亚热带地区的夏季湿润气候不相协调[3],科学研究价值特殊。因其“花期难以有效调控”,在世界切花产业中至今“默默无闻”[4]。目前,国内外学者对石蒜属植物做了大量研究,涉及育种、系统分类与进化、生长发育、繁殖栽培技术和资源开发等方面[5]。但从鳞茎“源−库”功能转化的视角探析石蒜的生长发育与休眠机制方面,却鲜见报道。【前人研究进展】非结构性碳水化合物(NSC)是碳水化合物生产过剩时积累的暂时储存和植物生长代谢过程中重要的能量供应物质,主要包括淀粉和可溶性糖(如蔗糖、葡萄糖、果糖等)[6−9]。淀粉作为光作合用的最终产物,在石蒜属植物鳞茎中的含量约40%[10−11]。淀粉作为重要的长期存贮物质,主要供应植物将来生长发育的需求[12],其合成也始终伴随着生长过程[13]。可溶性糖是植物主要的光合产物和糖代谢及运转形式[14−15],在渗透调节中起关键作用[16−17]。蔗糖不仅是光合作用的第一产物,还是淀粉合成的底物,直接关系到鳞茎的营养状况[18−19]。植物的生理休眠和解除与碳水化合物的积累、转化、代谢关系甚密[20]。“低温糖化”现象在许多球根类植物中存在[21−22],在低温破眠过程中淀粉水解成糖类,NSC含量升高[23]。【本研究切入点】石蒜具有养分回收率高、耐瘠薄和干旱以及花叶不相见、根叶生长不同步等与众不同的生态学和生物学特性[24],其生理、生态机制缺乏深入研究。为探究红花石蒜生理休眠与碳水化合物的积累、转化、代谢关系,本文在前期的物候观察与生长节律研究的基础上,重点关注休眠期不同径级鳞茎不同部位的NSC主要组份的含量及其分布格局。【拟解决的关键问题】旨在从红花石蒜鳞茎内的NSC时空分布视角(NSC含量与鳞茎的大小、部位、植物的发育阶段的关系),初步解析了其休眠生理。
1 试验材料和方法
1.1 供试材料
供试种球为引种的野生红花石蒜(Lycoris radiata),以3种不同径级(大球:3.5~4.0 cm、中球:2.5~3.0 cm、小球:1.5~2.0 cm)生长健壮的石蒜于2016年11月定植于江西业大学试验基地。于2019年8月4日(休眠期),随机挖掘3种不同径级(大球:3.5~4.0 cm、中球2.5~3.0 cm、小球:1.5~2.0 cm)的地下鳞茎,各45粒,分3次重复(每次重复15粒),去除叶片、根系,洗净后置于冰盒中,一并作为样品待测。在低温条件下取其鳞茎内层(1~4片)、中层(5~8片)、外层(9~12片)鳞片,切碎混匀,准确称取0.5 g,装袋密封(或用锡箔纸包好)、编号,液氮速冻后置于−80 ℃超低温冰箱保存备用,用于测定各生理指标。
1.2 测定方法
鳞茎中的淀粉和可溶性糖含量采用蒽酮比色法测定,果糖、蔗糖、葡萄糖的含量使用北京索莱宝科技有限公司检测试剂盒(Beijing Solarbio Science & Technology Co.,Ltd,型号分别为BC2460、BC2450、BC2500)和采用分光光度法检测。蔗糖、果糖、葡萄糖与基质液作用,其产物分别在480,480,505 nm处有最大吸收峰。
先称取0.1~0.2 g样品,常温研碎,加入1 mL提取液,适当研磨后快速转移至离心管中,置于80 ℃(蔗糖和果糖)或沸水(葡萄糖)的水浴锅中10 min(盖紧管口,防止水分散失),振动3~5次,冷却后,25 ℃下(蔗糖和葡萄糖)或常温(果糖)下离心(4 000 r/s)10 min,取上清液;再加入1 mL提取液,25 ℃下(葡萄糖和果糖)或常温下(蔗糖)离心(4 000 r/s)10 min,取上清液备用;混匀,置80 ℃(蔗糖和果糖)或25 ℃(葡萄糖)水浴中反应,保温10 min,冷却后于480 nm和505 nm波长下读取吸光度。将可见分光光度计预热30 min,波长调至相应波长,蒸馏水调零。
2 结果与分析
2.1 相同NSC组分在不同径级鳞茎内的含量差异
从图1可以得知,在鳞茎的相同部位,不同径级(大、中、小)鳞茎内的淀粉含量差异显著(P<0.05),以中球的淀粉含量最高。其中,中球中的中层和内层鳞片内的淀粉含量显著高于小球,而小球又显著高于大球;在外层鳞片内,尽管中球和大球中的淀粉含量显著高于小球,但中球与大球间淀粉含量差异不显著;在鳞茎盘内,中球的淀粉含量显著高于大球和小球,但大球和小球内的鳞茎盘内淀粉含量差异不显著。这表明,在石蒜的生长过程中,鳞茎的中层起到主要的贮藏功能——即“库”的作用。
图2表明,在鳞茎的相同部位,不同径级(大、中、小)鳞茎内的可溶糖含量差异显著(P<0.05),由大到小依次为中球、大球和小球。其中,外层、内层、鳞茎盘内的可溶性糖含量由大到小也均表现为中球、大球和小球,但大球、小球中的外层鳞片内可溶性糖含量无显著差异;另外,小球中层鳞片内的可溶性糖含量显著高于大球。
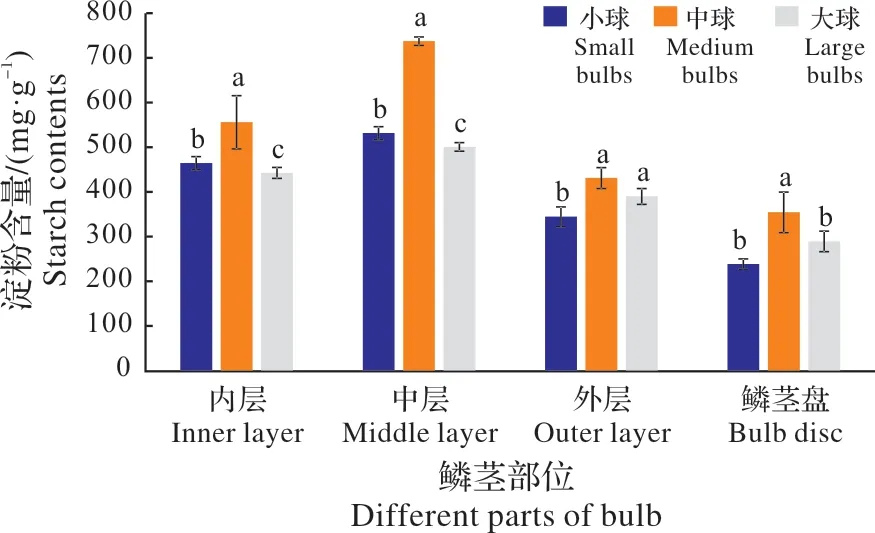
图1 不同径级鳞茎淀粉含量比较Fig.1 The comparison of starch content in bulbs of different diameters
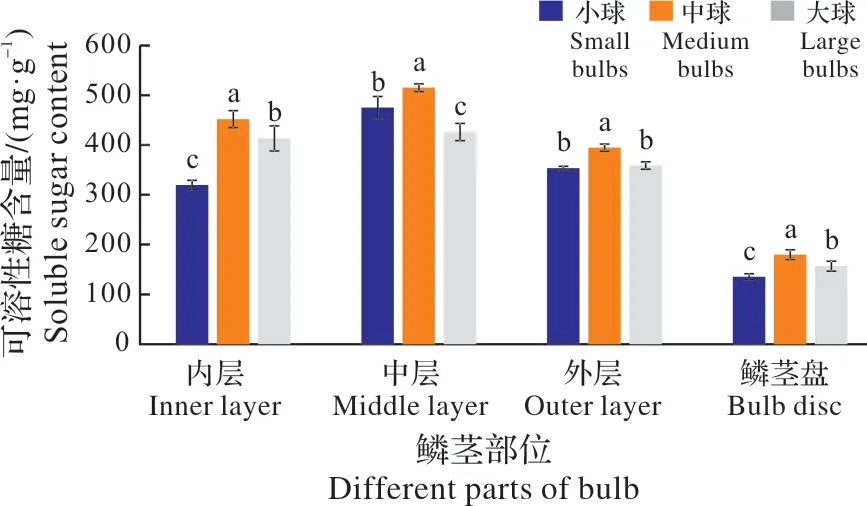
图2 不同径级鳞茎可溶性糖含量比较Fig.2 The comparision of soluble sugar content in bulbs of differnet sizes

图3 不同径级鳞茎葡萄糖含量比较Fig.3 The comparision of glucose content in bulbs of differnet sizes
从图3得知,与淀粉、可溶性糖含量表现不一致,在鳞茎的相同部位,不同径级鳞茎内的葡萄糖含量差异显著(P<0.05),由大到小依次为小球、大球和中球。小球的4个部位(内层、中层、外层鳞片及鳞茎盘)内的葡萄糖含量均分别显著高于中球。除中层鳞片外,大球的内层、外层及鳞茎盘内的葡萄糖含量又分别均显著高于中球。其中,中层鳞片葡萄糖含量以小球最高,显著高于大、中球。这说明,在石蒜鳞茎成长(膨大)过程中,葡萄糖的含量变化表现为是由高至低的变化趋势。
图4显示,大球的内层、中层及鳞茎盘内的蔗糖含量均分别显著高于中球和小球。而中球的内层、中层、外层鳞片内的蔗糖含量又均显著高于小球。但鳞茎盘内的蔗糖却以大球最高,其次为小球,最低为中球。推测可能与蔗糖作为植物光合作用的第一产物,经鳞茎盘这个转运平台,由内向外运输到外层鳞片(转化为淀粉临时贮藏)有关。因为在临近开花的休眠期,中球鳞茎盘中的蔗糖首先向内层转运(促使内层蔗糖含量升高),因而蔗糖含量快速下降。
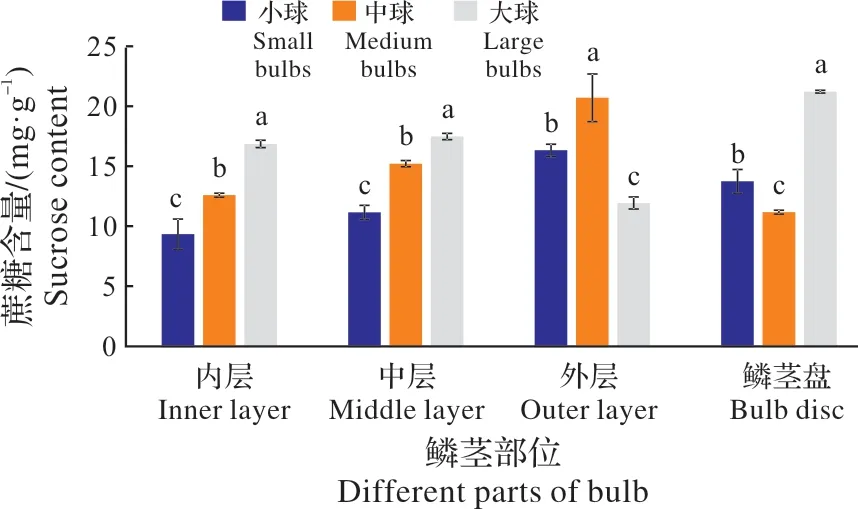
图4 不同径级鳞茎蔗糖含量比较Fig.4 The comparision of sucrose content in bulbs of differnet sizes
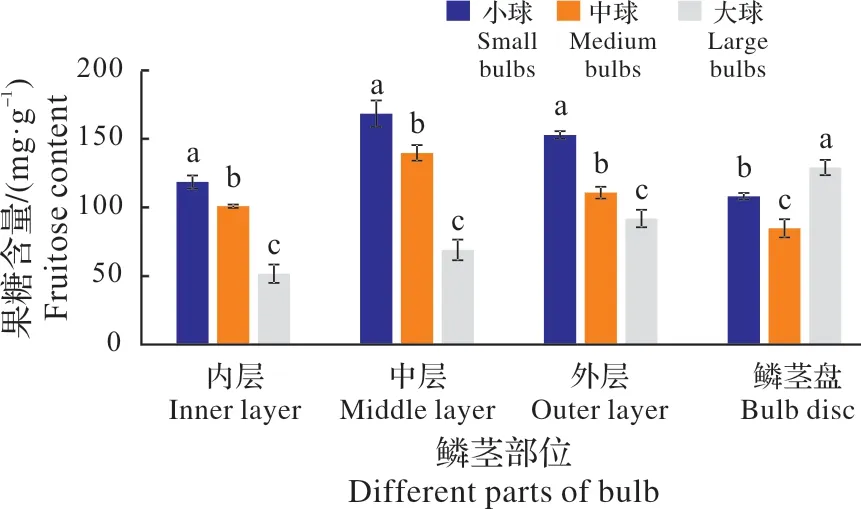
图5 不同径级鳞茎果糖含量比较Fig.5 The comparision of fruitose content in bulbs of differnet sizes
果糖为单糖,是葡萄糖的同分异构体,以游离状态大量存在于石蒜鳞茎的浆液中。从图5可知,不同径级的石蒜鳞茎内的果糖差异显著。其中,小球中的内、中、外层鳞片中的果糖含量均显著高于中球,中球又显著大于大球。但鳞茎盘内的果糖含量却以大球最高,其次为小球,中球最低,与蔗糖的含量表现一致。说明,果糖也是作为NSC转运物质之一,其转运路径与蔗糖相似。
综合图1~5可知,在不同径级的红花石蒜鳞茎中,相同的NSC组分(淀粉、可溶性糖、葡萄糖、蔗糖、果糖)差异显著。但不同径级鳞茎内NSC含量的差异(即中球>大球>小球)在0.05水平不显著(图6)。而在同一径级鳞茎中的不同部位,NSC的总含量差异显著(P<0.05)。这说明,鳞茎的大小较鳞茎的部位对NSC含量的影响更小。

图6 不同径级鳞茎内NSC总含量比较Fig.6 Comparision of NSC content in bulbs of differnet sizes
2.2 相同NSC组分含量在鳞茎内不同部位间的差异
图7表明,在小径级(1.5~2.0 cm)的石蒜鳞茎中,相同NSC组份在4种不同部位中的含量差异显著,由大到小依次为中层、内层、外层鳞片和鳞茎盘。而相同部位中的不同NSC组份差异也显著,由大到小依次为淀粉、可溶性糖、果糖、蔗糖和葡萄糖。其中,淀粉、可溶性糖、葡萄糖及果糖的含量均以中层鳞片最高,而蔗糖含量以外层鳞片最高。此外,果糖在小鳞茎的内层鳞片和鳞茎盘中的含量无显著差异。
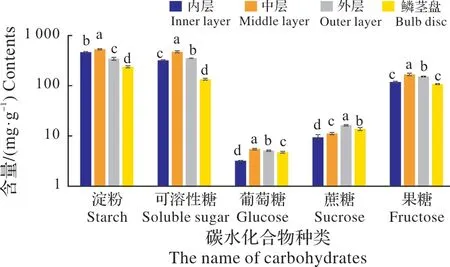
图7 小球不同部位NSC含量比较Fig.7 The comparision of NSC content in different parts of small bulb
图8表明,在中等径级(2.5~3.0 cm)的石蒜鳞茎中,相同NSC组份在4种不同部位中的含量差异也在0.05水平显著,由大到小依次为中层、内层、外层鳞片和鳞茎盘。相同部位中的不同NSC组份差异也显著,由大到小依次为淀粉、可溶性糖、果糖、蔗糖和葡萄糖。其中,蔗糖含量以外层鳞片最高,而其余4种NSC组份(淀粉、可溶性糖、葡萄糖、果糖)的含量均以中层鳞片最高,与小球的表现基本一致。不同的是,葡萄糖分别在中球的3个部位(内层鳞片、外层鳞片和鳞茎盘)中的含量无显著差异,但果糖在中球的内层和鳞茎盘内的含量差异显著。
图9表明,大径级的石蒜鳞茎(3.5~4.0 cm)中,4种不同部位中的相同NSC组份含量差异显著而相同部位中的不同NSC组份差异也显著,由大到小依次为淀粉、可溶性糖、果糖、蔗糖和葡萄糖。其中,淀粉、可溶性糖的含量均以中层鳞片最高,而葡萄糖以外层鳞片含量最高,蔗糖和果糖的含量却均以鳞茎盘最高。推测可能是在休眠期后期,大径级鳞茎(即开花种球)的内层鳞片需要为石蒜后续抽葶准备大量活跃态的能源物质,从而导致中层鳞片更多的活跃态NSC输出和外层鳞片内淀粉水解的增强,从而导致鳞茎盘内转运糖分(果糖)的增加。

图8 中球不同部位NSC含量比较Fig.8 The comparision of NSC content in different parts of medium bulb

图9 大球不同部位NSC含量比较Fig.9 The comparision of NSC content in different parts of large bulb
2.3 相关性分析
表1显示,NSC总含量、淀粉、可溶性糖均与鳞茎的大小无显著相关性,却均与鳞茎的器官部位显著负相关(R=0.74、0.67、0.75);而鳞茎的大小与石蒜鳞茎内的蔗糖含量呈极显著的正相关(R=0.47),与果糖的含量呈极显著负相关(R=−0.64)。这表明,鳞茎越大,蔗糖含量越高,果糖含量越低。

表1 鳞茎内不同NSC组分间的相关性分析Tab.1 The correlation analysis among different NSC components in bulbs
此外,NSC总含量与淀粉、可溶性糖的含量呈极显著的正相关(R=0.96),淀粉与可溶性糖的含量间也呈极显著的正相关(R=0.85),且二者均与鳞茎的部位呈极显著的负相关(内层高于外层)。
3 结论与讨论
3.1 不同径级的石蒜鳞茎内NSC的分配特征
NSC是石蒜鳞茎内重要的贮藏、代谢和调控物质,对其生长发育至关重要。植物组织中NSC含量在一定程度上反映其可供利用的物质水平[25−26]。有研究表明,薯块越大,所含淀粉的粒径越小,粘度越低[27]。本试验却表明,对于红花石蒜的3种不同径级的鳞茎,NSC总含量及淀粉、可溶性糖的含量由大到小均表现为中球、大球和小球,但不同径级的NSC总含量差异不显著(P<0.05)。这与在3种不同规格的中国石蒜鳞茎中,大(积累型淀粉)、小淀粉粒(动态型淀粉)的比例没有显著差异的结果相近[28]。
为什么中径级鳞茎内的NSC(淀粉和可溶性糖)的质量浓度会相对高于大球和小球?推测在鳞茎的动态发育过程中,小球在生长发育过程中分别主要以发挥“源”的功能为主,而大球主要以“库”的功能为主,而中球处于“库−源”相对平衡阶段(鳞茎内养分的消耗和积累均较活跃),NSC含量相对较最高。但不同径级的NSC含量差异不显著。因为不同质量的鳞茎球内部物质代谢规律相同,球径大小不影响鳞片内的生长发育模式[11]。但不排除与淀粉的粒径变化有关。
3.2 在同一鳞茎内不同部位间的NSC分布特征
淀粉粒在鳞茎的纵向分布上是均匀的,而在横向分布上是不均匀的[28]。石蒜鳞茎不同部位的淀粉和糖的含量均有明显差别,前者由大到小依次为内层鳞片、中层鳞片、外层鳞片和鳞茎盘,可溶性糖由大到小依次为外层鳞片、中层鳞片、内层鳞片和鳞茎盘[28]。在本研究中,处于休眠期的石蒜鳞茎内NSC、淀粉、可溶性糖的含量均以中层鳞片最高,总体由大到小依次为中层、内层、外层鳞片和鳞茎盘;大球的外层鳞片中的葡萄糖含量显著高于其他部位,而蔗糖(水解后为葡萄糖和果糖)和果糖含量以鳞茎盘中最高;而在中、小球中,外层鳞片中的蔗糖含量明显高于其他3个部位,果糖含量仍以中层鳞片最高。这从侧面证实了鳞茎盘内的代谢活动较弱,以能量和物质转运(同化物代谢的中转站)和临时储藏淀粉为主要功能[28]。这与王晓静[11]和邵京[28]的结果部分相似,但不完全相同。这可能与试验材料(物种)、取样时间(如籽鳞茎分生时)的不同有关。因为在不同发育期,鳞茎各部位鳞片的物质变化幅度不同,鳞茎盘与鳞片的物质变化趋势也不完全相同[28]。
其中,大球的外层鳞片因年龄较老,在红花石蒜的休眠后期(即将抽葶),主要作为“营养源”,为内层鳞叶生长提供营养;而中层鳞叶主要作为备用“营养源”,与外层鳞叶共同向内层鳞叶(生长发育的主要活动中心)的生长发育提供营养物质[28]。因此,外层鳞片的可溶性糖和淀粉均显著低于内层。这与鳞茎更新时,母鳞茎淀粉含量总体下降,新鳞茎内鳞片内的淀粉含量上升[29],蔗糖与可溶性糖总量明显增加(尤其是外层鳞片)的原理相似[30]。
3.3 NSC各组分与鳞茎大小、部位相关性分析
红花石蒜鳞茎中的淀粉含量以休眠期最高(约30%),其次为抽葶期和枯叶期,以展叶期最低[28]。鱗片中淀粉含量的急剧下降(生育前期)或增加(功能叶完全展开后),分别是其作为“源”或“库”的标志[31]。这说明,鳞茎内的NSC含量与石蒜的生长发育密切相关。在本实验中,休眠期石蒜鳞茎中的蔗糖与鳞茎的大小呈极显著正相关,果糖则正好相反;而NSC总含量、淀粉、可溶性糖、葡萄糖含量均与鳞茎的大小无显著相关性。这说明鳞茎的大小仅会在一定程度上显著影响其NSC组分的构成,但作用有限。另外,NSC、淀粉、可溶性糖含量均与鳞茎的器官部位显著负相关(内层高于外层)。这在很大程度上与石蒜鳞茎的特殊结构及其能量物质运转方式有关。
可溶性糖是淀粉合成的底物,其含量的高低与淀粉积累密切相关[15,18−19]。本实验也表明,NSC总含量、淀粉、可溶性糖含量之间呈极显著的正相关。可溶性糖是植物直接可利用的碳水化合物形式,其含量高低体现了可直接利用态的物质和能量供给状况[32]。但作为还原糖的葡萄糖含量却与鳞茎大小、部位及NSC的其他组分(淀粉、可溶性糖、蔗糖、果糖)均无显著相关性。这可能与该阶段石蒜地下部分处于休眠状态有关(呼吸作用弱、没有光合作用和剧烈的糖代谢活动、体内碳水化合物的运转强度低)。
蔗糖作为光合作用的第一产物,是可溶性糖中最重要和比例最高的糖分[33],也是碳水化合物运输的主要途径[34]。然而,在本实验中,蔗糖的含量却明显偏低(甚至低于果糖)。推测在休眠期,石蒜鳞茎内的蔗糖部分水解为果糖。
4 展 望
石蒜鳞茎不仅生物碱含量较高,还富含淀粉和胶质,可用于制作浆糊、钢件铸造粘合剂[35]和纯天然淀粉[36],开发前景广阔。鳞茎是石蒜养分、非结构性碳和水分的存贮库[24]。糖和淀粉是石蒜属植物鳞茎主要的养分转运形式和养分贮藏形式[28]。本文在前期的物候与生长节律观察的基础上,重点关注了休眠期鳞茎内NSC含量与鳞茎的大小、部位、植物的发育阶段的相关性,从NSC分布格局的视角初步解析了其休眠生理,提出将NSC含量及其时空分布格局作为判别其发育阶段的标识之一。然而,对石蒜的全生育期、全株不同器官(叶片、鳞茎、根系)间的比较研究还有待深入,以进一步揭示红花石蒜的生理休眠和解除与碳水化合物的积累、转化、代谢关系或鳞茎“库−源”转化的生理机制。
