复方苦参注射液总糖纯化方法及含量测定研究
2021-01-04王洪玲段秀梅海丽娜秦文杰王鹏飞毕小凤张亚锰
王洪玲 段秀梅 海丽娜 秦文杰 王鹏飞 毕小凤 张亚锰




【摘 要】 目的:建立复方苦参注射液总糖纯化及含量测定方法。方法:以单因素考察对复方苦参注射液总糖纯化条件进行优选,以苯酚-硫酸法测定复方苦参注射液中总糖含量。结果:复方苦参注射液总糖纯化条件:复方苦参注射液1mL,稀释5倍,在床容积(BV)为15mL的AB-8大孔吸附树脂柱进行上样,用3BV水洗脱,洗脱流速为0.566mL/cm2·min,得滤出液;苯酚硫酸法测定复方苦参注射液总糖专属性良好,浓度在28.06~92.18μg/mL范围内线性关系良好,r=0.9997,样品精密度、重复性、稳定性、耐用性RSD分别为0.02%、1.51%、0.72%、0.31%,加样回收率为96.84%~104.46%。结论:采用大孔吸附树脂纯化复方苦参注射液中的总糖准确可靠,用苯酚-硫酸方法测定复方苦参注射液中的总糖快速准确,可作为复方苦参注射液总糖纯化、测定方法。
【关键词】 复方苦参注射液;总糖;大孔吸附树脂;苯酚-硫酸法
【中图分类号】 【文献标志码】 A 【文章编号】1007-8517(2021)21-0057-05
Research on Purification Method and Determination of Total Sugar in Compound Kushen Injection
WANG Hongling DUAN Xiumei HAI Lina QIN Wenjie* WANG Pengfei BI Xiaofeng ZHANG Yameng
Beijing Zhendong Pharmaceutical Research Institute Co., Ltd, Beijing 100120,China
Abstract:Objective This study was to optimize the purification method of total sugar and establish a method for determining the total sugar in Compound Kushen Injection.Methods The conditions for purification of total sugar in Compound Kushen Injection were optimized by single factor investigation. The total sugar content in Compound Kushen Injection was determined by phenol-sulfuric acid method.Results The purification conditions of total sugar in compound Kushen injection: 1 mL of compound Kushen injectionwasdiluted 5 times and loaded on an AB-8 macroporous adsorption resin column with a bed volume (BV) of 15 mL, which was eluted with triple times BV of water. The elution flow rate is 0.566 mL/cm2·min, and the filtrate was obtained. The phenol-sulfuric acid method has a good specificity for determining the total sugar content in the compound injection, and the linear relationship is good within the range of 28.06 to 92.18 μg/mL. The RSD of precision, repeatability, stability, and durability was 0.02%,1.51%,0.72%, and 0.31%, respectively, and the sample recovery rate was 96.84% to 104.46%.Conclusion The methods of macroporous adsorption resin purification and phenol-sulfuric acid determination in this study were accurate, reliable and rapid, which can be applied in the purification and determination of total sugar in compound Kushen injection.
Key words:Compound Kushen Injection; Total Sugar; Macroporous Adsorption Resin; Phenol-sulfuric Acid Method
復方苦参注射液是由苦参和白土苓经现代科学方法精制而成的中药注射液,具有清热利湿、凉血解毒、散结止痛的功效,用于癌肿疼痛、出血[1]。迄今为止,复方苦参注射液的研究主要集中在生物碱及黄酮类成分[2],对于糖类物质的研究相对较少。近年来,中药糖类作为一类生物活性成分,具有免疫调节[3]、抗肿瘤[4]、抗氧化[5]、降血糖[6]、抗肺癌[7]等多种功能,已成为研究的热点。本研究对复方苦参注射液总糖纯化方法进行优选,测定方法进行验证,为复方苦参注射液再评价提供参考。
1 仪器与材料
1.1 仪器 Agilent Cary60紫外可见分光光度计;T9北京普析紫外可见分光光度计;XSE 205 DU分析天平(METTLER TOLEDO);TLE 204/02分析天平(METTLER TOLEDO);HH-6D1恒温水浴锅(常州市美特仪器有限公司);Mill-Q 超纯水制备系统(Millipore公司)。
1.2 材料 大孔吸附树脂(HPD100、AB-8、D 101,天津市光复精细化工研究所),浓硫酸(批号:20180428,北京化工厂);乙醇(批号:20161128,北京化工厂);苯酚(批號:C1927002,北京益利精细化学品有限公司);碳酸氢钠(批号:20171104,阿拉丁化学试剂有限公司);D-无水葡萄糖(批号:110833-201707,中国食品药品检定研究院);复方苦参注射液(批号:20171102、20171128、20180301、20161032、20181203、20181204、20181209、20181212、20181213、20181214、20181215、20181138、20181139、20181034,山西振东制药股份有限公司)。所用试剂均为分析纯,实验用水均为Millipore 超纯水制备系统下制备的纯化水。
2 方法与结果
2.1 溶液制备
2.1.1 葡萄糖对照品溶液制备 精密称取D-无水葡萄糖适量,加水溶解,配成1 mg/mL的对照品标准品溶液,备用。
2.1.2 5%苯酚溶液的制备 称取苯酚100 g,加碳酸氢钠0.05 g,置于250 mL圆底烧瓶中,常压蒸馏,接收180 ℃馏分,用包覆铝箔的三角瓶收集,放置阴凉干燥处,备用;称取此馏分苯酚5 g,加水溶解,转移至100 mL棕色量瓶中,用水稀释至刻度,摇匀,即得5%苯酚溶液,备用[8]。
2.1.3 供试品溶液制备 精密量取复方苦参注射液10 mL至50 mL量瓶中,用水稀释刻度,摇匀,精密量取稀释液5 mL进行上样,用水洗脱,洗脱流速为0.566 mL/cm2·min,用量为3BV,收集滤出液至100 mL量瓶中,用水稀释至刻度,精密量取1 mL至10 mL量瓶中,用水稀释至刻度,摇匀,备用。
2.2 检测波长选择 取样品溶液及对照品稀释溶液(浓度约为60 μg/mL)各1.0 mL,分别置于15 mL具塞试管中,依次加入5%苯酚溶液 1.0 mL,充分振摇后迅速加入浓硫酸5 mL,振摇,迅速移至80℃水浴中保温10 min,冰浴中冷却3 min,于紫外分光光度计在190~800 nm下进行全波长扫描。
2.3 样品检测方法 精密量取样品溶液1.0 mL,空白取1.0 mL蒸馏水,分别置15 mL具塞试管中,依次加入5%苯酚溶液 1.0 mL,充分振摇后迅速加入浓硫酸5 mL,振摇,迅速移至 80 ℃水浴中保温 10 min,冰浴中冷却3 min,于487 nm处测定其吸光度,并根据标准曲线计算样品含量。
2.4 样品纯化方法确定
2.4.1 直接稀释法样品制备 分别精密量取复方苦参注射液(20171128、20180301、20161032)各1 mL,至1000 mL量瓶中,用水稀释至刻度,摇匀,即得。
2.4.2 大孔吸附树脂纯化样品 分别精密量取复方苦参注射液(20171128、20180301、20161032)各1 mL,按2.1.3项下方法进行样品制备,按2.3项下方法进行检测。结果见下表1。
大孔吸附树脂纯化总糖之后,经苯酚-硫酸法显色在紫外分光光度计下测得的总糖水洗部分约占92%左右,醇洗部分约占8%,考虑到糖类物质不溶于乙醇的特性,推测醇洗部分应为苷类物质,所测得的糖为苷类物质在硫酸作用下酸水解的糖或糖链,所以用直接稀释法测得的总糖含量存在一定的偏差,而采用大孔吸附树脂纯化总糖的方法测定复方苦参注射液中的总糖准确可靠。
2.5 样品纯化方法优化
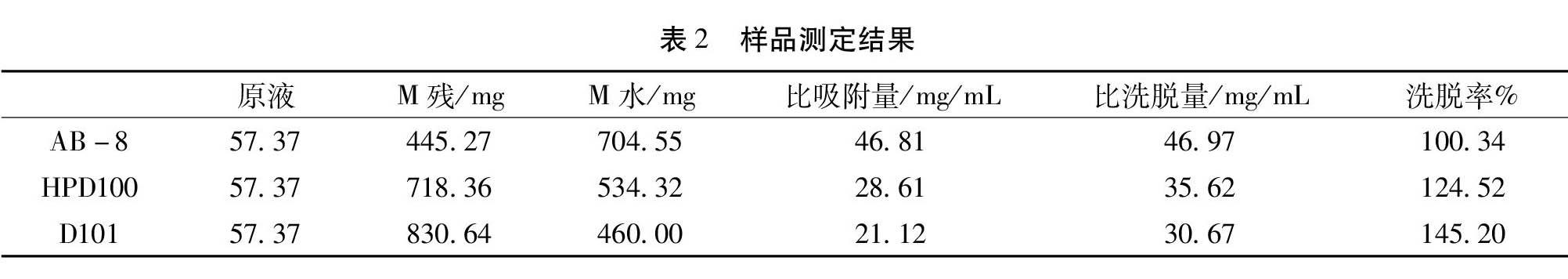
2.5.1 不同型号大孔树脂考察实验 分别取预处理后的3种型号大孔树脂(AB-8、HPD100、D101 )进行湿法装柱,柱容积为15 mL,精密量取复方苦参注射液(20171102)5 mL,依次进行上样,每根柱子上样4次,接其残留液至molish反应呈阳性后上样液距大孔树脂顶端0.5 cm,用水洗脱,接其洗脱液,洗至molish反应呈阴性,然后测各残留液、水洗液中总糖的含量。由表2可知,AB-8大孔吸附树脂相比较其他型号树脂,比吸附量最高,比洗脱量最高,并且洗脱率为100.34%,表明树脂中未有其他物质被洗脱出,故确定所用大孔吸附树脂型号AB-8。
2.5.2 大孔吸附树脂AB-8泄漏曲线考察 取预处理后的大孔吸附树脂AB-8进行湿法装柱,柱高为15 cm,精密量取复方苦参注射液(20171102)5 mL,进行上样,上样四次,接其流出液每0.5 mL进行分装,精密量取分装流出液0.2 mL至20 mL量瓶中,用水稀释至刻度,摇匀,按2.3项下检测方法进行吸光度测定,并计算含量。结果表明AB-8大孔吸附树脂最大上样量为注射液原液3.5 mL,故暂定为注射液上样量为1mL。如图1所示。
2.5.3 上样浓度对吸附效果的影响 精密量取复方苦参注射液(20171102)1 mL,平行量取3份,分别加水稀释5、3、1倍的样品浓度进行上样,吸附2h,用水进行洗脱,洗脱流速为0.566 mL/cm2·min,用量为6BV,收集滤出液至1000 mL量瓶中,用水稀释至刻度,摇匀,按2.3项下进行检测,结果表明注射液稀释5倍时,最接近样品中含量,故上样浓度定为稀释5倍之后上样。见表3。
2.5.4 吸附时间对吸附效果的影响 精密量取复方苦参注射液(20171102)1 mL,平行量取3份,加水稀释5倍上样,分别吸附0、2、4 h,用水洗脱,洗脱流速为0.566 mL/cm2·min,用量为6 BV,收集滤出液至1000 mL量瓶中,用水稀释至刻度,摇匀,按2.3项下进行检测。结果表明各样品吸附时间RSD为1.34%,无显著性差异,表明吸附时间对复方苦参注射液总糖分离无影响,故选择不进行吸附,直接洗脱。见表4。
2.5.5 洗脱速度对解吸效果的影响 精密量取复方苦参注射液(20171102)1mL,平行量取3份,加水稀释5倍上样,用6BV水洗脱,洗脱流速分别为0.283,0.566,1.132 mL/cm2·min,收集滤出液至1000 mL量瓶中,用水稀释至刻度,摇匀,按2.3项下进行检测。结果表明样品洗脱浓度为0.566 mL/cm2·min时,洗脱样品含量最高,故洗脱速度定为0.566 mL/cm2·min。见表5。
2.5.6 洗脱浓度对解吸效果的影响 精密量取复方苦参注射液(20171102)1 mL,加水稀释5倍上样,分别用水、10%乙醇、20%乙醇、30%乙醇、40%乙醇、50%乙醇、60%乙醇、70%乙醇、80%乙醇、95%乙醇进行洗脱,用量为6BV,洗脱流速为0.566 mL/cm2·min,分别收集流出液至1000 mL量瓶中,用水稀释至刻度,摇匀,按2.3项下进行检测,结果表明只有水洗脱流出液中含有糖,故用纯水进行洗脱即可。如图2所示。
2.5.7 水洗脱体积对解吸效果的影响 精密量取复方苦参注射液(20171102)1 mL,加水稀释5倍上样,用水洗脱,洗脱流速为0.566 mL/cm2·min,分别收集洗脱体积为1、2、3、4、5、6、7、8的滤出液至1000 mL量瓶中,用水稀释至刻度,摇匀,按2.3项下进行检测。结果表明3BV之后各洗脱体积中总糖含量之间RSD为0.77%,无明显差异,故洗脱体积定为3BV。如图3所示。
3 复方苦参注射液总糖含量测定方法学评价
按照确定的条件分别依次进行专属性、精密度、线性与范围、重复性、稳定性、耐用性及加标回收率实验。
3.1 专属性 分别取空白溶液、样品溶液及对照品溶液在300~700 nm进行全波长扫描,结果显示葡萄糖对照溶液与复方苦参注射液样品溶液最大吸收波长一致,均为487 nm,且空白溶液在最大吸收波长487 nm处无干扰。如图4所示。
3.2 精密度 精密量取葡萄糖对照品溶液1.0 mL,按2.3项下方法操作,连续测定6次,RSD为0.06%,仪器精密度良好。
3.3 线性与范围 精密量取2.1.1项下葡萄糖对照品溶液0.7、1.1、1.5、1.9、2.3 mL,于 25 mL量瓶中,用水稀释至刻度,得浓度依次为28.06、44.09、60.12、76.15、92.18 μg/mL的对照品标准系列溶液,按2.3项下进行检测,以吸光度值为纵坐标,浓度为横坐标作标准曲线,回归方程为y=0.0102x+0.0473(r=0.9997),表明无水葡萄糖质量浓度在28.06~92.18 μg/mL范围内线性关系良好。
3.4 重复性 取同一批号样品(20181034)6份,分别按2.1.3项下方法制备样品溶液,再分别取供试品溶液1 mL,按2.3项下方法操作,RSD=1.51%,表明该含量测定方法重复性良好。
3.5 稳定性 样品溶液显色后在室温分别放置0、30、60、90、120、150、180 min后按2.3项下方法操作,在0~180 min内样品含量结果RSD为0.72%,说明样品在3 h内稳定。
3.6 耐用性 考察改变测定波长(±2nm)、仪器(型号)条件,计算复方苦参注射液总糖含量RSD,耐用性RSD为0.31%,表明方法耐用性良好。
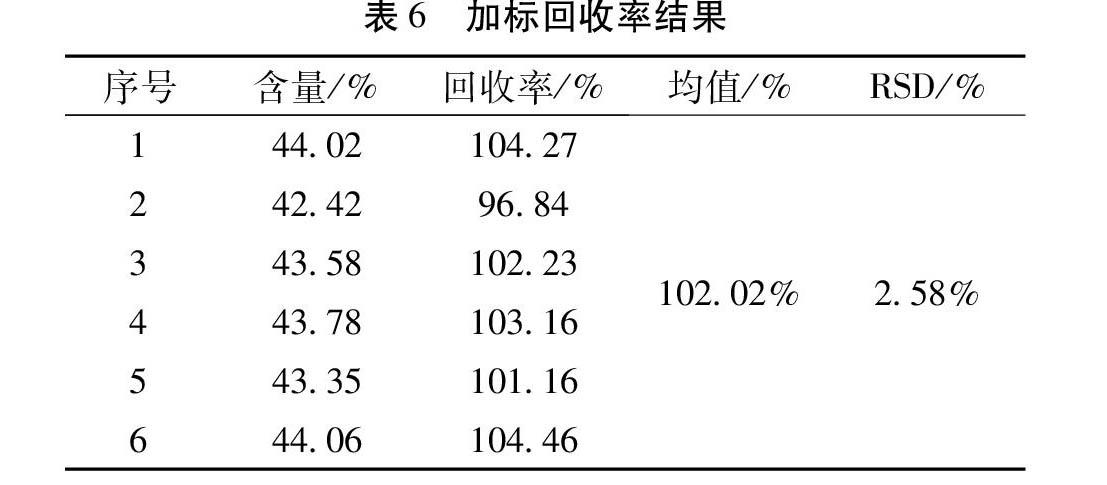
3.7 回收率 精密量取复方苦参注射液(20181034)4 mL至20 mL量瓶中,精密称定D-无水葡萄糖(约为1倍样品中总糖质量)172.37 mg加入上述量瓶中,加水稀释至刻度,精密量取2.5 mL上样,用水洗脱,洗脱流速为0.566 mL/cm2·h,用量为3BV,收集滤出液至1000 mL量瓶中,用水稀释至刻度,摇匀,平行制备6份,按2.3项下方法检测,结果表明样品回收率96.84%~104.46%,RSD为2.58%,方法准确性良好。见表6。
加样回收率(%)=(检测总量-样品含量)/加标量×100%。
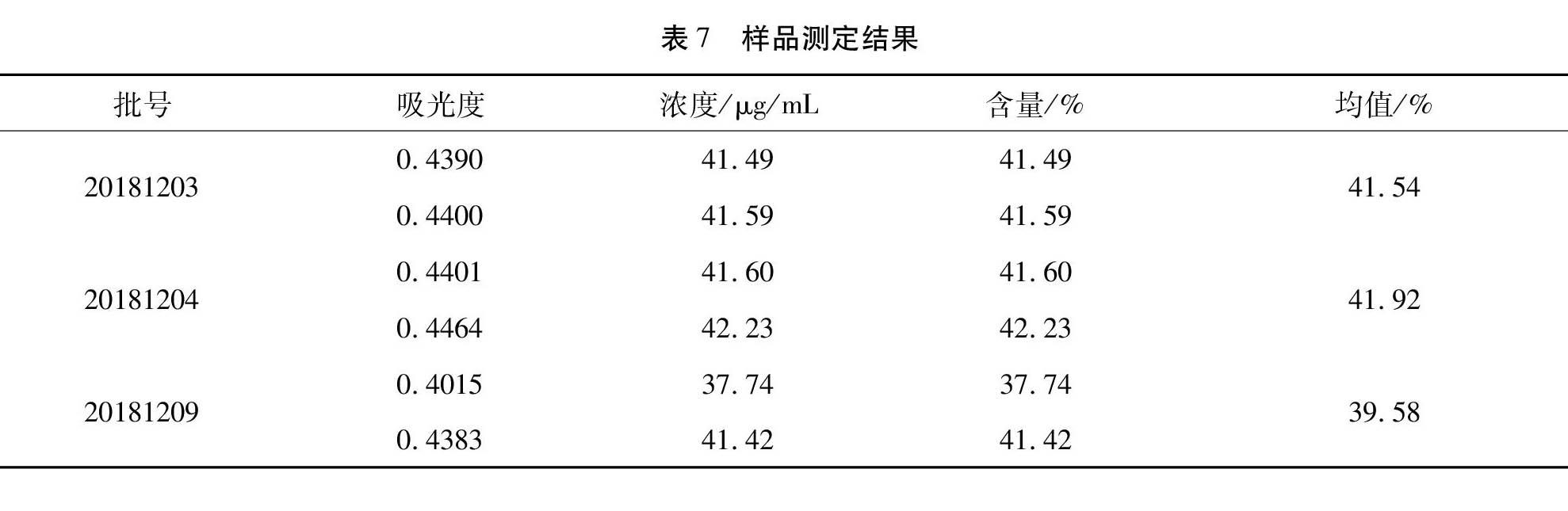
3.8 样品测定 取复方苦参注射液样品(20181203、20181204、20181209、20181212、20181213、20181214、20181215、20181138、20181139、20181034)按2.1.3项下样品制备方法制备,按按2.3项下方法进行检测,计算复方苦参注射液总糖含量。见表7。
4 结论
中药一般含有大量的糖和苷类成分,本产品采用大孔对脂进行纯化,将除去苷类等干扰成分,结果可靠。实验通过比较大孔树脂AB-8、HPD100、D101三种不同的大孔吸附树脂的比吸附率与比洗脱率,发现AB-8大孔吸附树脂对复方苦参注射液的总糖的纯化效果最佳,通过对泄露曲线、上样浓度、吸附时间、洗脱速度、洗脱浓度、洗脱体积综合考察确定复方苦参注射液总糖的最佳工艺为复方苦参注射液1 mL,稀释5倍,在床容积(BV)为15 mL的AB-8大孔吸附树脂柱进行上样,用3BV水洗脱。
采用经典的苯酚硫酸法测定复方苦参注射液中糖的大类成分,实验表明糖含量约占总固量的50%左右,主要是单糖和寡糖。《中药注射液安全性再评价质量控制评价技术原则(试行)》中明确指出,注射剂中所含成分应基本清楚,对注射液总固体中所含成分要进行系统的化学研究,明确总固体中所含大类成分的种类及占总固體的量[9]。实验对复方苦参注射液中的糖类成分进行了分析测定,有利于复方苦参注射液的质量标准提高和保证临床用药安全。
参考文献
[1]WS3-B-2752-97.中药成方制剂(第14册)[S].中华人民共和国卫生部药品标准,1995.
[2]马悦.复方苦参注射液化学成分和质量控制研究[D].北京:中国中医科学院,2012.
[3]吕小成,张乐帅,王富军.中药多糖的免疫调节作用及研究进展[J].上海中医药大学学报,2016,30(3):97-101.
[4]李皓月,李金霞,申力.中药多糖对肿瘤微环境的作用[J].浙江中医药大学学报,2019,43(9):1010-1014.
[5]孟祥云,汪永锋,杨丽霞,等.中药多糖抗氧化作用及其机制研究进展[J].中华中医药杂志,2018,33(8):3504-3509.
[6]代荣,刘如明,肖建辉.菌类中药多糖降血糖效应机制研究进展[J].中国中药杂志,2015,40(2):174-179.
[7]王婷婷,周海燕,王亚贤,等.中药多糖抗肺癌作用研究进展[J].中医药学报,2016,44(2):92-95.
[8]夏文,杜洪志,董立莎,等.蒽酮-硫酸法与苯酚-硫酸法测定切面红色与切面白色土茯苓药材中多糖含量的比较[J].时珍国医国药,2015,26(11):2572-2574.
[9]国家食品药监督管理局.国食药监办[2010]20号《关于征求中药注射剂安全性再评价相关技术评价指导原则意见的函》及其附件《中药注射剂安全性再评价质量可控性评价技术原则》[S].2009-01-13.
(收稿日期:2021-03-18 编辑:陶希睿)
