土壤辐照灭菌对土壤中铵态氮和硝态氮行为的影响
2021-01-04张昊青赵学强沈仁芳
张昊青,赵学强,喻 敏,沈仁芳
[1.佛山科学技术学院国际膜生物学与环境研究中心,广东 佛山 528000;2.土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),江苏 南京 210008;3.中国科学院大学,北京 100049]
氮是植物需要量最多的矿质营养元素,其在土壤中的各种行为与作物氮肥利用率、损失密切相关。例如,土壤中有机态氮的矿化分解过程决定了土壤中可被植物直接吸收利用的有效氮数量,因而影响了氮素利用效率[1-2]。土壤硝化作用消耗了土壤中的铵态氮,可以减少氨挥发损失,但其产生的硝态氮极易淋失,造成水体污染,也容易通过反硝化过程进入大气,造成大气污染[1,3-5]。另外,不同作物或同一作物的不同品种对铵态氮和硝态氮的偏好不一样[6],土壤中的铵硝转化会影响作物的氮肥利用率[7]。因此,通过了解氮在土壤中的行为可以为提高作物的氮肥利用率和减少氮的环境损失提供理论基础。
作为土壤氮素地球化学循环的驱动者,土壤微生物在土壤氮素转化中起着十分重要的作用[8]。铵态氮和硝态氮是植物可以直接吸收利用的两种主要无机氮素形态。在微生物的作用下,铵态氮和硝态氮可以相互转化,也会通过各种途径损失,以及被土壤微生物和土壤晶格固持。此外,土壤微生物也会通过自身代谢过程或矿化来分解土壤中有机态氮,释放无机态氮。由此可见,土壤微生物一方面通过自身的生命活动参与氮循环,同时其本身也是土壤活性氮库的重要组成部分。提高土壤中氮素的作物可利用性,亟需明确土壤微生物在氮素形态转化、氮素释放、固持及损失等过程中的作用。
目前的研究多集中于土壤氮素循环过程及其微生物机理,而土壤微生物对氮素转化过程的贡献缺乏定量评价。因此,本文采用土壤γ 辐照灭菌和15N 同位素示踪相结合的手段,研究了土壤灭菌对外源施入的铵态氮和硝态氮在土壤中的相互转化、固持、损失及其对土壤自身有机氮矿化的影响,以定量评价土壤微生物对铵态氮和硝态氮在土壤中各种行为的影响,为提高土壤氮的作物利用效率和减少土壤氮素损失提供理论基础。
1 材料与方法
1.1 土壤样品的采集
供试土壤采集自江西省鹰潭市中国科学院红壤生态试验站旱地农田。该地区属于典型的亚热带湿润季风气候区,水热资源丰富,年降水量1 882 mm,年均温18.4℃。采集0 ~20 cm 表层土壤样品,剔除杂物后,风干,磨细,过1 mm 筛备用。该土壤样品发育自第四纪红粘土,土壤基本理化性质见表1。

表1 供试土壤基本理化性质
1.2 试验设计
本试验为室内土壤培养试验,包含两个因素,A 因素为不同氮形态,分别为:铵态氮和硝态氮处理;B 因素为灭菌处理,即灭菌和不灭菌处理。共4 个处理,每个处理重复3 次,随机排列。试验具体操作步骤如下:首先,称取50 g 过1 mm 筛的风干土样于12 个培养瓶中,将培养瓶等分为两份,一份经过γ 辐照(辐照强度:30 nSv·h-1)灭菌,作为灭菌处理;另一份作为未灭菌的对照处理。再将灭菌和未灭菌的土壤分别等分两份,一份均匀地加入15N 标记的硫酸铵[(15NH4)2SO4]溶液,一份均匀地加入15N 标记的硝酸钠(Na15NO3)溶液,另补充一定量的去离子水以保证充足水分条件。用无菌透气封口膜将培养瓶封口,置于25℃人工气候室内恒温黑暗培养。培养期间每3 d 采用称重法补水,培养第30 d 后取样,置于4℃冰箱保存,用于土壤硝态氮、铵态氮含量及其15N 丰度测定。
在本试验中,氮肥的施用量均为N 200 mg ·kg-1,15N 标 记 的 肥 料 中(15NH4)2SO4的15N 丰 度 为20.18%,Na15NO3的15N 丰度为30.15%。所有处理均加入磷肥(过磷酸钙)和钾肥(氯化钾)作为肥底,用量分别为P 100 mg·kg-1和K 200 mg·kg-1。
1.3 土壤理化性质分析
土壤硝态氮、铵态氮采用2 mol·L-1KCl 溶液浸提,流动分析仪(San++ System,SAKLAR,荷兰)测定;土壤pH 值采用pH 计(PB-21,Sartorius,德国)测定,土水比为1∶2.5;土壤有效磷 采 用pH 值8.5 的0.5 mol·L-1NaHCO3溶 液 浸提,钼锑抗比色法测定;速效钾采用pH 值7.0 的1 mol·L-1乙酸铵溶液浸提,火焰光度法测定;有机质采用低温外加热重铬酸钾氧化-比色法测定;全氮含量采用以Se 粉、CuSO4、K2SO4为催化剂,浓H2SO4消煮,凯氏法测定。
1.4 土壤硝态氮、铵态氮及全氮的15N 丰度测定
土壤硝态氮和铵态氮15N 丰度依据曹亚澄等[9]的方法进行测定。该方法的原理是将KCl 提取液中的铵态氮和硝态氮转化为N2O 气体,然后用带有预浓缩装置的同位素比值质谱仪(MAT 253 plus,Thermo Fisher Scientific,德国)测定N2O 中的15N丰度。具体操作步骤如下:首先采用2 mol·L-1KCl 溶液浸提土壤中的硝态氮、铵态氮。测定铵态氮15N 丰度时,第一步将浸提液中的NH4+经过MgO 蒸馏或扩散成NH3,再用含有0.5 mmol·L-1CuSO4溶液的稀硫酸溶液吸收馏出液中的NH3,后加入碱性次溴酸钠溶液将其转化为N2O 气体,抽取气体样品,测定其15N 丰度。测定硝态氮15N 丰度时,第一步加入氨基磺酸去除土壤提取液中所含的亚硝酸盐,再将样品注入含有50 mg 镀铜镉粒还原剂的醋酸缓冲液中,使提取液中的NO3-转化为N2O,抽取气体样品进行测定。土壤全氮15N 丰度采用同位素质谱仪(IsoPrime 100,Elementar,德国)直接测定。
1.5 统计分析
采用SPSS 19.0 进行统计分析。使用独立样本t检验比较灭菌和不灭菌条件下施用铵态氮和硝态氮处理间差异显著性,以及施铵或施硝条件下灭菌和不灭菌处理间差异显著性,P< 0.05 为显著。采用Sigma Plot 12.5 作图。
1.6 计算公式
土壤中来自15N 标记肥料的硝态氮含量(mg·kg-1)=(土壤中硝态氮15N 丰度-15N 自然丰度)×总硝态氮含量/(肥料中15N 丰度-15N 自然丰度)
土壤中来自15N 标记肥料的铵态氮含量(mg·kg-1)=(土壤中铵态氮15N 丰度-15N 自然丰度)×总铵态氮含量/(肥料中15N 丰度-15N 自然丰度)
来自土壤自身的硝态氮含量(mg·kg-1)=培养结束时土壤总硝态氮含量-来自15N 标记肥料的硝态氮含量
来自土壤自身的铵态氮含量(mg·kg-1)=培养结束时土壤总铵态氮含量-来自15N 标记肥料的铵态氮含量
土壤中来自15N 标记肥料的总氮含量(mg·kg-1)=(土壤中全氮15N 丰度-15N 自然丰度)×土壤全氮含量/(肥料中15N 丰度-15N 自然丰度)
土壤固持的肥料氮(mg·kg-1)=土壤中来自15N 标记肥料的总氮含量-土壤中来自15N 标记肥料的硝态氮含量-土壤中来自15N 标记肥料的铵态氮含量
损失的肥料氮(mg·kg-1)=肥料施用量-土壤中来自15N 标记肥料的总氮含量
2 结果与分析
2.1 灭菌对土壤硝态氮、铵态氮含量的影响
图1 结果表明,在施用铵态氮的条件下,灭菌土壤中硝态氮含量显著低于未灭菌土壤,相反,灭菌土壤中铵态氮含量显著高于未灭菌土壤,说明灭菌抑制了土壤硝化作用的发生。在施用硝态氮的条件下,未灭菌土壤和灭菌土壤中硝态氮含量没有显著差异,未灭菌土壤中铵态氮含量很低,几乎趋近于零,而在灭菌土壤中,土壤铵态氮含量达到20.52 mg·kg-1,意味着灭菌显著增加土壤铵态氮含量。不管是否灭菌,施用硝态氮处理的土壤硝态氮含量都高于施用铵态氮处理,施用铵态氮处理的土壤铵态氮含量都高于施用硝态氮处理(图1)。

图1 灭菌和氮肥处理对土壤硝态氮、铵态氮含量的影响
15N 示踪的手段有助于定量区分土壤中来自于肥料的硝态氮、铵态氮与土壤自身的硝态氮、铵态氮。图2 结果表明,在未灭菌土壤中,施用的200 mg·kg-1铵态氮在培养30 d 后已有50 mg·kg-1被硝化成为硝态氮,而在灭菌土壤中,施用的铵态氮肥则不会转化成为硝态氮,因此灭菌土壤中来自肥料的铵态氮含量较未灭菌土壤显著增加。在施用硝态氮的条件下,灭菌对来自肥料的硝态氮含量没有显著影响,无论是否灭菌,来自肥料的铵态氮含量均趋近于0,说明在本试验条件下硝态氮肥并不会转化为铵态氮。
不管施用铵态氮还是施用硝态氮,培养30 d后,与未灭菌处理相比,灭菌处理显著降低了来自土壤自身的硝态氮含量,但是却促进了土壤自身铵态氮的释放(图3)。在未灭菌条件下,施用铵态氮处理的来自土壤的硝态氮含量显著高于施用硝态氮处理,但是在灭菌条件下,来自土壤的硝态氮含量在两种氮肥处理之间差异不显著。不管是否灭菌,施用铵态氮处理的来自土壤的铵态氮含量均显著高于施用硝态氮处理,表明铵态氮肥可能刺激了土壤自身铵态氮的释放。
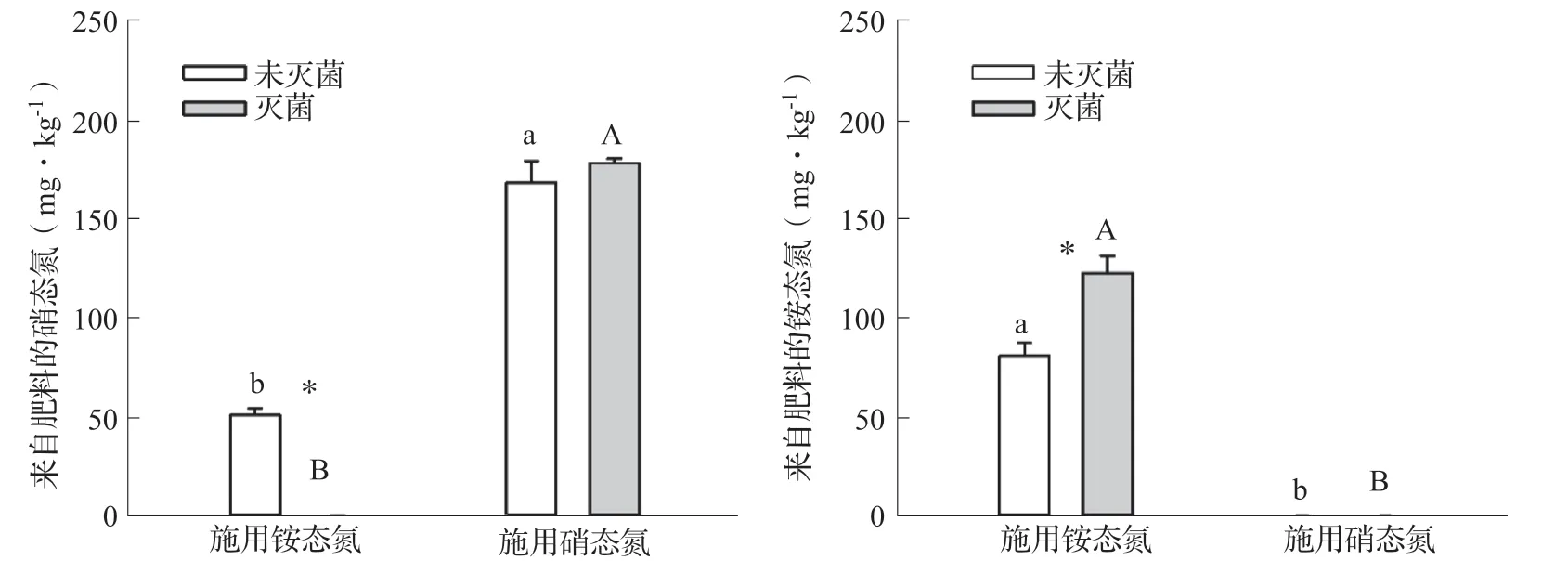
图2 灭菌和氮肥处理对土壤中来自肥料的硝态氮、铵态氮含量的影响
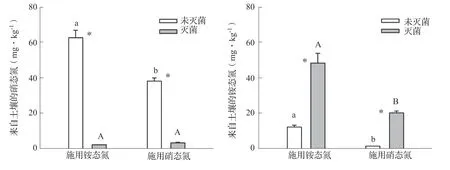
图3 灭菌和氮肥处理对来自于土壤的铵态氮、硝态氮含量的影响
2.2 灭菌对肥料氮在土壤中的固持及损失的影响
施入土壤的铵态氮和硝态氮会在土壤中发生物理的、化学的和生物的反应,大部分会留在土壤中,小部分会损失到环境中。图4 表明,培养30 d后,在未灭菌土壤中,与铵态氮相比,硝态氮在土壤中残留较多,但在灭菌土壤中,硝态氮和铵态氮在土壤中的残留量差异不显著。土壤灭菌显著降低了硝态氮在土壤中的残留,但对铵态氮在土壤中的残留无显著影响。残留在土壤中的铵态氮和硝态氮又分为两部分,一部分可以通过2 mol·L-1KCl 溶液的方法(见材料与方法)浸提出来,另外一部分被土壤强烈吸附固定而不能被2 mol·L-1KCl 溶液浸提出来,或者被微生物同化。本文将被土壤吸附和被微生物同化的铵态氮和硝态氮称为土壤中固持的肥料氮。通过计算铵态氮和硝态氮肥在土壤中的固持量发现,灭菌显著降低硝态氮肥在土壤中的固持量,与不灭菌土壤相比,降低幅度近50%(图4)。灭菌对铵态氮肥在土壤中的固持量没有显著影响。在未灭菌条件下,铵态氮肥和硝态氮肥在土壤中的固持量没有显著差异,但是灭菌后前者显著高于后者。进一步计算肥料氮损失发现,灭菌后硝态氮肥损失显著增加,但是对铵态氮肥损失没有显著影响。在未灭菌条件下,铵态氮肥损失量显著高于硝态氮肥,灭菌处理后前者仍高于后者,但是二者之间差异不显著(图4)。
通过计算铵态氮、硝态氮在土壤-环境系统中的分配比例(图5)发现,在施用铵态氮的条件下,未灭菌土壤中有25.3%的铵态氮通过硝化作用转化成为硝态氮,26.4%被土壤晶格和土壤微生物固持,8.1%损失。而在灭菌土壤中,由于缺乏土壤微生物的驱动,几乎没有肥料氮转化成为硝态氮,63.3%的肥料氮仍以铵态氮的形式存在于土壤中。同时,灭菌土壤肥料氮损失比例较未灭菌土壤有所增加。在施用硝态氮条件下,未灭菌土壤中绝大部分肥料氮(81.9%)仍以硝态氮形式存在,剩余部分(18.1%)被土壤和微生物固持,无肥料氮损失。而在灭菌土壤中,除仍以硝态氮形式残留的肥料氮(88.7%)外,仅有9.3%被固持,其余1.8%被损失。

图4 土壤灭菌对外源施入肥料在土壤中的残留、固持及损失的影响

图5 土壤灭菌对肥料氮在土壤-环境体系中的分配比例
3 讨论
3.1 15N 标记的铵态氮和硝态氮在土壤中的相互转化
硝化作用是指在硝化微生物参与下将铵态氮转化成为硝态氮的过程。在本研究中,当15N 标记的铵态氮肥施入未灭菌土壤中,培养30 d 后有25.3%的铵态氮转化为硝态氮,说明该土壤硝化作用较强。而在灭菌土壤中,施用铵态氮处理几乎没有标记的硝态氮产生,这意味着辐照灭菌土壤培养30 d后,土壤硝化作用近乎停止,暗示着硝化微生物的生长和活性可能被完全抑制。前人研究发现,不同的灭菌方式对土壤中硝化作用抑制的效果不同。通过熏蒸灭菌的方式可以在短期内抑制土壤中硝化微生物的活性,但当熏蒸胁迫解除,熏蒸的抑制效果消失[10]。高温蒸汽灭菌可以在土壤未被扰动的条件下持续80 d 显著抑制土壤硝化作用,若多次对土壤进行扰动取样,则抑制作用减弱[11]。因此,在通过灭菌手段研究土壤微生物功能时,应合理选择灭菌方式和取样方式。本研究结果表明,若仅在培养结束后取样,γ 射线辐照灭菌对土壤硝化微生物的抑制作用较强且持续时间较长,是微生物研究中土壤灭菌的较优选择。
当15N 标记的硝态氮肥施入土壤中,无论是否灭菌,土壤中被标记的铵态氮含量均趋近于零,说明在此试验条件下,无论是否有微生物的存在,施用的硝态氮均不会转化成为铵态氮。据报道,硝态氮异化还原成氨的过程易在厌氧或低氧状态下发生[12]。本试验全程保持通气状态且水分含量适中,因此即使是在微生物存在的情况下,也很难发生硝态氮的异化还原过程。
3.2 灭菌和外源投入铵、硝对土壤自身氮素矿化的影响
本研究结果表明,在未灭菌土壤中外源添加铵态氮培养30 d 后,来自土壤自身的铵态氮与硝态氮之和为75.7 mg·kg-1,高于灭菌土壤(51.32 mg·kg-1);添加硝态氮培养30 d 后,来自土壤自身的铵态氮与硝态氮之和为40.3 mg·kg-1,同样高于灭菌土壤(24.2 mg·kg-1)。说明在微生物存在的条件下,土壤中有机氮的矿化能力较强,更有利于土壤自身无机氮的释放。同时也发现,与施用硝态氮相比,在未灭菌土壤中外源添加铵态氮后土壤自身铵态氮和硝态氮的释放量显著增加,说明外加铵态氮比外加硝态氮对土壤有机态氮的矿化作用显著,这与吕殿青等[13]的研究结果相似。这一结果也说明,选择微生物较易同化的氮源可促进土壤自身有机态氮的矿化,为植物生长提供充足营养[14]。
当土壤灭菌后,由于硝化作用被完全抑制,施用铵态氮处理来自于土壤自身的硝态氮含量与试验初始值相似。值得注意的是,若灭菌条件下完全不存在氮素转化过程,则灭菌后来自土壤自身的铵态氮含量也应保持与初始值相似。但在本研究中,灭菌条件下施铵处理来自土壤自身的铵态氮含量较初始值有近48 mg·kg-1的增加,施硝处理来自土壤自身的铵态氮含量也有25 mg·kg-1的增加。说明无论施入何种形态氮肥,灭菌都会提高来自土壤自身的铵态氮含量,许多研究也发现了这一现象[15-16]。一方面原因可能是由于在灭菌的过程中微生物死亡进而释放出铵;另一方面,灭菌也在一定程度上有助于腐植质的分解和矿化,进而释放出少量的铵态氮[17]。也有研究表明,经过辐照后,部分微生物尽管不再增殖,但仍可能具有生物化学活性[17]。γ 射线可产生游离的氢和羟基,这些自由基具有很强的活性,并且可通过反应裂解土壤的C-C 键导致土壤有机碳的分解,土壤中溶解性有机碳浓度增加,进而可为存留下来的微生物提供良好环境[15]。因此,经过灭菌,土壤中可能仍存在有机氮的矿化过程,这可能也是灭菌土壤培养30 d后来自土壤自身铵态氮相比试验前增加的原因。但是,也有研究发现,γ 射线灭菌降低了土壤中碱解氮的含量[18]。这可能与土壤有机质含量有关。有机质含量较高的土壤更有利于营养元素的释放[19]。在倪国荣等[18]研究中,试验用土的有机质含量为2%,低于本研究土壤有机质含量3.6%,因此造成研究结果的差异。
3.3 15N 标记的铵态氮和硝态氮在土壤中的固持
本研究表明,当15N 标记的铵态氮施入土壤中,灭菌和未灭菌条件下土壤对铵态氮的固持量基本一致,证明即使在没有或缺乏微生物的条件下,土壤也能通过非生物途径固持26%的铵态氮。这与Davidson 等[20]的研究结果相似。一方面,土壤胶体带负电,对带正电的铵态氮具有很强的吸附作用[3];另一方面,土壤有机质也可吸附一小部分游离的铵根离子[20]。而当15N 标记的硝态氮施入土壤中时,灭菌土壤中被固持的肥料氮显著低于未灭菌土壤,证明微生物有助于硝态氮在土壤中的固持。这与普遍认为的微生物主要固持铵态氮而对硝态氮的固持作用较弱的观点不一致[21-22]。原因可能是由于本研究供试土壤采集自旱地农田,这种土壤中由于硝化作用较强,氮素形态一般以硝态氮为主,而土壤中又存在着硝化细菌和异养微生物对铵态氮的强烈竞争作用。若土壤中铵态氮的含量不足以满足微生物的需求,硝态氮就有可能被微生物所同化[23]。另外一方面,与铵态氮相比,微生物同化硝态氮需要更多的能量。在部分土壤中,有效态碳的数量可能是限制微生物同化硝态氮的主要因素[24]。本研究供试土壤的有机质含量较高,可为微生物提供充足碳源,因此,在本研究中,微生物对硝态氮在土壤中的固持具有重要作用。值得注意的是,尽管灭菌显著降低了土壤中固持的硝态氮数量,但仍有9.3%的硝态氮肥被固持。说明在本研究供试土壤中也发生了硝态氮的非生物固持。原因可能是由于该土壤发育自第四纪红粘土,含有大量表面带正电荷的铁铝氧化物,而对硝酸根有较强的吸附能力[25]。
3.4 15N 标记的铵态氮和硝态氮在土壤中的损失
在本研究土壤纯培养体系中,氮素不可能流失或淋失,只可能通过气态方式损失。对于铵态氮,氨挥发是主要损失途径,对于硝态氮,反硝化是主要损失途径。氨挥发是指土壤中的铵根离子与土壤中的水结合生成液相的氨分子,最终转化为气态的氨,损失进入大气的过程。该过程是物理化学过程。在本研究中,无论是否灭菌,均有10%左右的铵态氮肥损失进入大气。但是,在未灭菌的土壤中,施入的硝态氮并未损失,这可能是因为反硝化过程易在厌氧或低氧条件下发生[12]。本研究在培养过程中通气状况良好,基本不会有反硝化过程发生。而在灭菌土壤中,由于微生物固持的肥料氮的降低,硝态氮损失增加,造成损失的原因可能与一些非生物途径有关。本研究在室内进行,培养条件控制严格,如果在田间,微生物固持氮的能力降低很容易造成硝态氮的淋溶及反硝化损失,对大气和水体环境构成威胁。
4 结论
总体来看,土壤灭菌抑制了铵态氮向硝态氮的转化,并促进了土壤自身铵态氮的释放,却显著降低了土壤对硝态氮的固持,增加了硝态氮的损失。因此,灭菌有利于铵态氮的累积,而降低硝态氮的累积。与外源添加硝态氮相比,外源添加铵态氮更有利于土壤自身铵态氮的释放及其在土壤中的固持,却在一定程度上增加了氮素损失。在今后研究中,还需与植物吸收相结合,通过调控土壤氮素转化过程以提高植物的氮素利用效率。
