木犀草素纳米结构脂质载体的制备、优化及抗菌活性
2020-12-29刘媛媛
刘媛媛,贺 朝
(1咸阳职业技术学院,咸阳712000;2陕西中医药大学,咸阳712046)
木犀草素(luteolin,Lut)是从草本植物木犀草(Reseda alba L.)中提取分离得到的一种黄酮类化合物,已有研究表明,木犀草素具有消炎[1]、抗过敏[2]、抗肿瘤[3]、抗菌[4]等多种药理学活性,随着对木犀草素的抗菌、抗病毒活性研究深入,已证明其对金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌等多种细菌和病毒具有抑制作用,其作用机制是通过抑制DNA 拓扑异构酶的活性,进而阻断核酸mRNA 及蛋白质的合成[5],干扰细菌的分裂增殖。然而,木犀草素为水难溶性药物(水中溶解度仅为6 μg/mL)[6],不利于药物渗透至细菌内部,极大的降低了抑菌效果。为了提高木犀草素的溶解性,已将其制备成微乳[7]、聚合物胶束[8]、羟丙基-β-环糊精包合物[9]、磷脂复合物[10]等新型给药系统。纳米结构脂质载体(nanostructured lipid carriers,NLCs)是以一定比例的固态脂质和液态脂质作为基质,将药物包裹在纳米载体内核或吸附在其表面,构成的新型药物传递系统,与传统载体相比,NLC 具有增加药物溶解度及稳定性,提高渗透性以及抗菌活性,延长作用时间,在抗菌药物递送系统中具有广阔的应用前景[11-12]。本研究将木犀草素制备成纳米结构脂质载体,以提高药物的溶解度和渗透性,为木犀草素局部外用给药提供一种有效途径。
1 材 料
1.1 药品与试剂
木犀草素原料药(上海纯优生物科技有限公司,纯度:99.5%,批号:P006511);单硬脂酸甘油酯( 德国巴斯夫公司);辛酸癸酸三甘油脂(Miglyol®812,嘉法狮上海贸易有限公司);泊洛沙姆188(Lutrol®F68,德国巴斯夫公司)。
供试菌种:金黄色葡萄球菌(Staphylococcus aureus,革兰阳性菌,ATCC 3101),大肠埃希菌(Escherichia coli,革兰阴性菌,ATCC 8735)均由南京便诊生物科技有限公司提供。
1.2 仪 器
LC-100 高效液相色谱系统(上海伍丰科学仪器有限公司);JY98-IIIDN超声波粉碎机(上海净信实业发展有限公司);CM-120 型透射电子显微镜(荷兰Philips 公司);Zetasizer Nano ZS 90 型激光粒度测定仪(英国Malvern 公司);ZRD-1402DA 智能溶出度测试仪(北京北研科仪仪器有限责任公司);DF-101S集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司);超滤管(截留相对分子质量:100 kD,密理博中国有限公司);纤维素透析袋(截留相对分子质量:5 000~10 000 D,上海研拓生物科技有限公司)。
2 方 法
2.1 Lut-NLCs的制备
本研究以单硬脂酸甘油酯和Miglyol®812 分别作为固体脂质和液体脂质,以泊洛沙姆188作为表面活性剂,采用热熔乳化辅助探头超声制备Lut-NLCs[13]。制备工艺如下:称取处方量的单硬脂酸甘油酯和Miglyol®812加入到乙醇和丙酮的混合有机溶剂(1∶1)5 mL 中,溶解;将溶液放入到60 ℃水浴中保温,呈透明状溶液;称取处方量木犀草素加入到上述脂质溶液中,搅拌至药物完全溶解;另称取处方量泊洛沙姆188 加入到纯化水50 mL 中,水浴加热至60 ℃保温,搅拌溶解,得到溶液澄清透明;在高速(3 000 r/min)磁力搅拌下,将含药有机相快速加入到泊洛沙姆188水溶液中,分散形成黄色乳状溶液,保持60 ℃水浴温度,持续高速搅拌30 min,挥干有机溶剂,并向乳状液中补加同温度纯化水至50 mL;使用探头超声以400 W 超声功率处理乳液,超声频率为:超声5 s,间隔5 s,持续超声5 min;超声结束后迅速将乳状液放入到冰水浴中冷却,经0.8 μm 滤膜过滤,即得到外观呈黄色带有乳光的Lut-NLCs,放置到4 ℃冰箱中保存,备用。
2.2 粒径测定
采用激光粒度测定仪粒度仪测量Lut-NLCs 的粒径分布。使用移液枪移取Lut-NLCs 0.2 mL,加入蒸馏水5 mL稀释,轻轻振摇,取少量稀释液加入到直径为1 cm 的石英样品池中,放入到激光粒度测定仪中检测粒径分布,样品测定参数为:温度为25 ℃,He-Ne 激光器,功率为4 mW,检测波长为632.8 nm,散射角为90°。每个样品平行测定3次,取平均值。
2.3 包封率测定
本研究采用超滤离心法测定Lut-NLCs 的包封率[6]。精密移取Lut-NLCs 样品0.5 mL 加入到超滤离心管(截留相对分子质量:100 kD)上腔中,在4 500 r/min 下离心40 min,收集超滤液,将所得的超滤液全部转移至10 mL量瓶中,加入甲醇溶解并定容,经0.22 μm 滤膜过滤,采用HPLC 法测定药物含量,并计算得到Lut-NLCs 中游离药物浓度(cfree);另取同一批Lut-NLCs 样品0.5 mL 加入到100 mL 量瓶中,加入甲醇溶解并定容,经0.22 μm滤膜过滤,采用HPLC 法测定药物含量,并计算得到Lut-NLCs 中总药物浓度(ctotal),参照以下公式计算Lut-NLCs 的包封率。每个样品平行测定3 次,取平均值。 EE=(1 - cfree/ctotal)×100%。 测定Lut-NLCs 的包封率色谱条件[6]如下:色谱柱为Dikma Diamasil C18(4.6 mm×250 mm,5 μm),检测波长为350 nm,流动相为甲醇-水-乙酸(60∶40∶2),流速为1.0 mL/min。系统适用性结果显,在该色谱条件下辅料不干扰药物测定,色谱峰理论塔板数不低于6 000,拖尾因子在0.95~1.05 内;Lut 在质量浓度在0.5~50.0 μg/mL 范围内与峰面积呈线性关系,回归方程为A=36 984.3c - 1 253.6(r=0.999 9),进样精密度RSD 为0.5%(n=6),加样回收率平均值(100.5±0.3)%(n=9),验证结果显示,在该色谱条件适合Lut-NLCs的包封率测定。
2.4 Box-Behnken实验设计优化Lut-NLCs的处方
通过预实验发现,固体脂质单硬脂酸甘油酯浓度、液体脂质Miglyol®812 浓度和表面活性剂泊洛沙姆188 浓度是影响Lut-NLCs 的粒径分布和包封率的主要因素。因此,本研究采用Box-Behnken实验设计系统研究了这3 个关键处方变量对粒径分布和包封效率的影响。根据初步实验筛选结果确定3 个变量的浓度范围,即固体脂质浓度(X1)为10.0~30.0 mg/mL,液体脂质浓度(X2)为5.0~15.0 mg/mL,表面活性剂浓度(X3)为5.0~25.0 mg/mL,实验设计变量信息见表1。
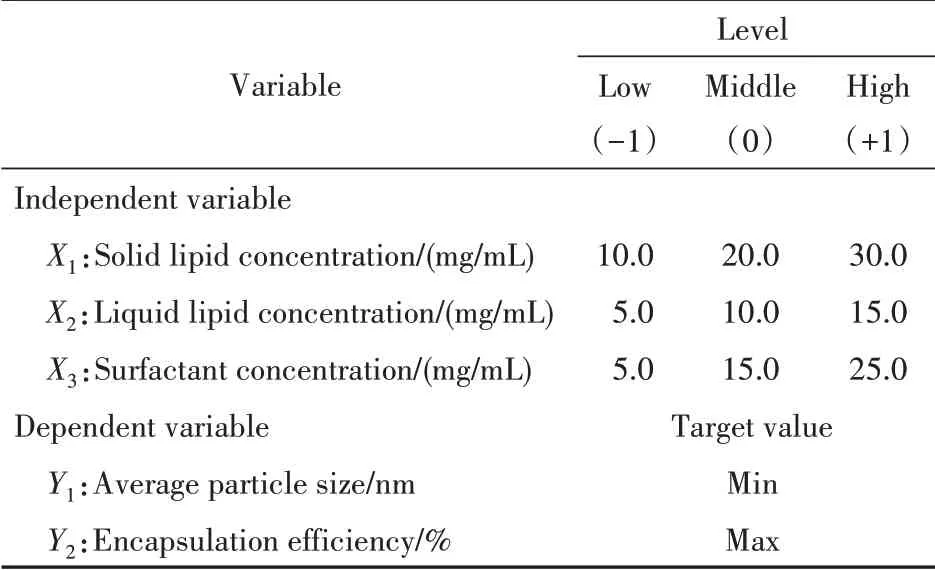
Table 1 Variable levels of Box-Behnken experiment design
2.5 微观形态观察
通过透射电子显微镜观察Lut-NLCs 的微观形态。取一滴Lut-NLCs 样品溶液铺展在200 目的铜网格涂层上,并用滤纸除去多余的水分,待水分挥干后,向铜网格表面滴加0.05 g/mL 磷钨酸溶液,负染10 min,室温环境中风干,将样品放置在透射电子显微镜下观察并拍摄电镜照片。
2.6 体外释药行为研究
取含有吐温-80(0.5%)的pH 7.4 磷酸盐缓冲液100 mL 加入到500 mL 烧杯中,水浴温度为32 ℃,对Lut-NLCs 体外药物释放行为进行考察。精密移取Lut-NLCs 5 mL 转移到透析袋(截留相对分子质量:5~10 kD)中,系紧两端,放入到烧杯中,另将一支长度为2.5 cm,直径为0.5 cm 圆柱形磁力搅拌子放入烧杯中,封口膜密封。开启磁力搅拌,搅拌速为100 r/min,在预定的时间间隔内从烧杯中取出溶出介质(同时补加等温等体积介质溶液)2 mL,经0.45 μm 微孔滤膜过滤;同法,取Lut原料药DMSO 溶液(药物质量浓度为5 mg/mL)按照上述方法操作。采用HPLC 法测定药物释放含量,计算Lut-NLCs 和Lut 溶液的药物累积释放度,绘制药物释放度-时间曲线。测定Lut-NLCs 中药物释放的含量色谱条件[6]如下:色谱柱为Dikma Diamasil C18(4.6 mm×250 mm,5 μm),检测波长为350 nm,流动相为甲醇-水-乙酸(60∶40∶2),流速为1.0 mL/min。系统适用性结果显示,在该色谱条件下释放介质中吐温-80 不干扰药物测定;Lut 在质量浓度在0.1~40.0 μg/mL 范围内与峰面积呈线性关系,回归方程为A=35 452.7c - 1 586.2(r=0.999 8),进样精密度RSD 为0.7%(n=6),加样回收率平均值(99.6 ± 0.4)%(n=9),验证结果显示在该色谱条件适合Lut-NLCs的释放度测定。
2.7 体外抑菌实验
通过抑菌圈实验比较Lut 原料药和Lut-NLCs的对金黄色葡萄球菌和大肠埃希菌的体外抑菌效果。分别取浓度为每毫升1×105CFU 金黄色葡萄球菌和大肠埃希菌菌液各200 μL均匀的接种到铺有培养基的表面皿中,做上标记,培养箱中培养24 h后,在每份培养基上均取直径为5 mm小孔,各3 个,分别将Lut 原料药(使用DMSO 溶解[14])和Lut-NLCs 加入到小孔内(给药剂量相同,均为每孔50 μg),放到培养箱中继续培养24 h,用游标卡尺测定抑菌圈直径,取平均值。
3 结果与讨论
3.1 模型选择
使用Box-Behnken 实验设计优化了Lut-NLCs的处方,共进行15次实验,实验结果见表2。
通过Box-Behnken实验设计软件对表2数据处理得到模型评价结果(表3),建议Y1和Y2均选用多元二次模型(Quadratic vs 2FI)拟合。
3.2 数据方差分析
应用统计软件对表2中的实验数据进行方差分析,统计分析结果分别见表3和表4,Y1和Y2的拟合多元二次方程模型P 值分别为0.000 1和0.000 2,均极为显著(P <0.01);Y1和Y2两个模型的失拟项P分别为0.123 6和0.294 1,均不显著(P >0.05),说明两个模型的预测值与实际值之间的差异较小,可信度较好,可用于实验优化。经统计软件拟合得到的两个多元二次方程为:
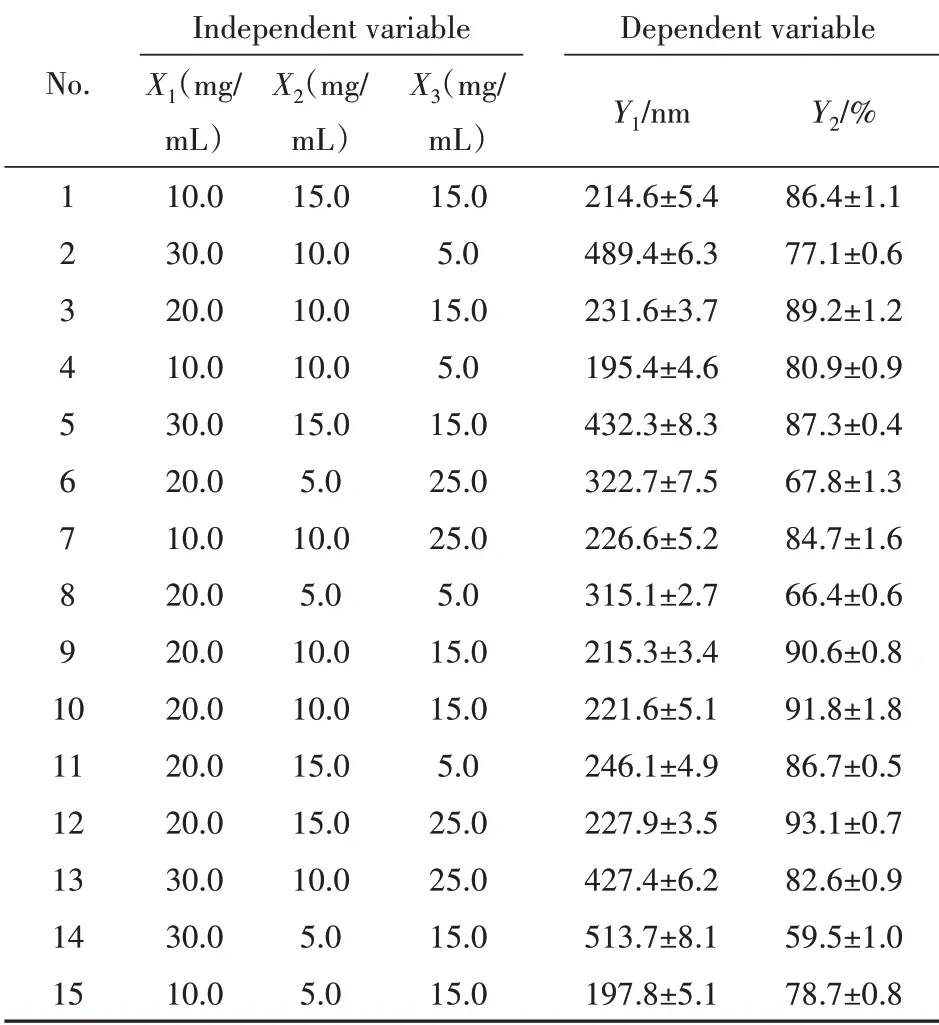
Table 2 Independent variables (X) and dependent variables (Y) in experiment design (xˉ± s, n = 3)

另外,统计分析结果(表5)表明,X1、X2、X1X2、X1X3、X12、X22、X32对Y1模型具有显著性影响(P <0.05),Y1方程中X12、X22、X32前面系数为正值,表示对Y1模型具有协同作用,而Y1方程中X1、X2、X1X2、X1X3前面系数为负值,表示对Y1模型具有拮抗作用;同理,X1、X2、X1X2、X12、X22、X32对Y2具有显著性影响(P<0.05),Y2方程中X1、X2、X1X2前面系数为正值,表示对Y2模型具有协同作用,而Y2方程中X12、X22、X32前面系数为负值,表示对Y2模型具有拮抗作用。通过3D 响应面图可直观解释自变量与因变量之间的关系,见图1,图2。
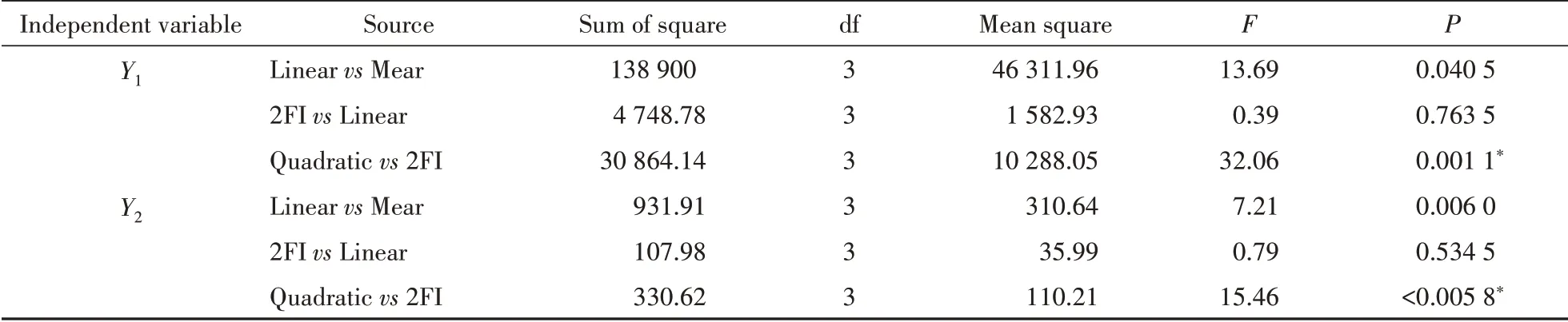
Table 3 Summary of results of regression analysis for average particle size (Y1) and encapsulation efficiency (Y2) of Lut-NLCs
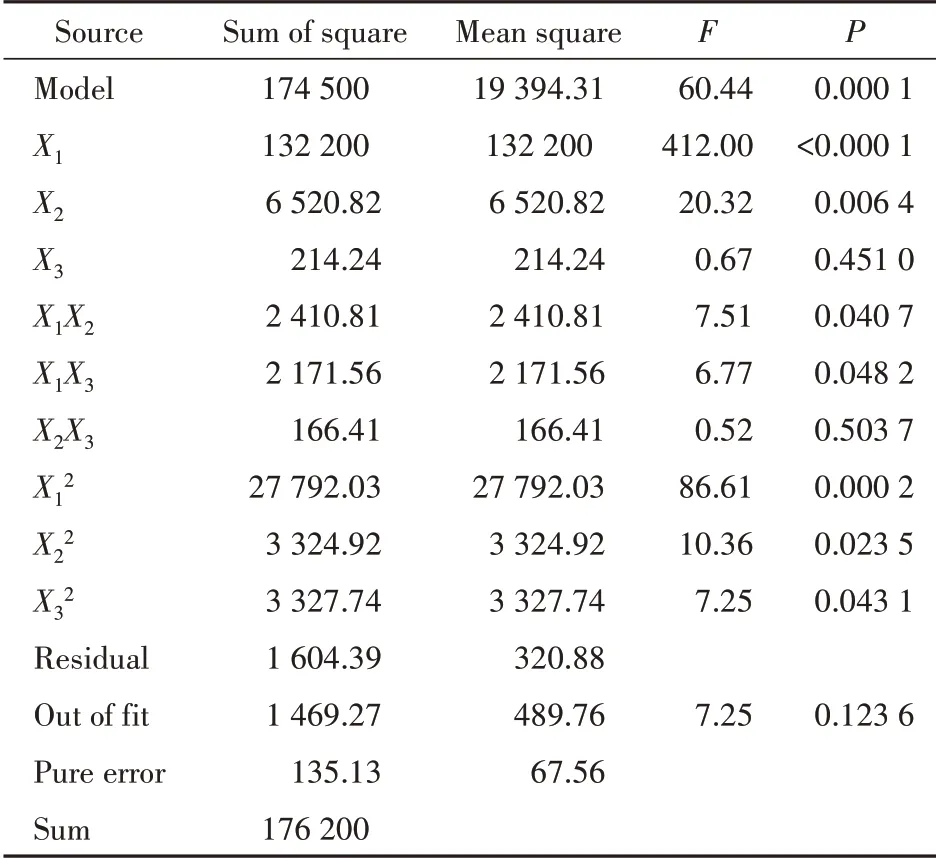
Table 4 Results obtained from ANOVA of Box-Behnken experiment design for optimization of average particle size (Y1) of Lut-NLCs
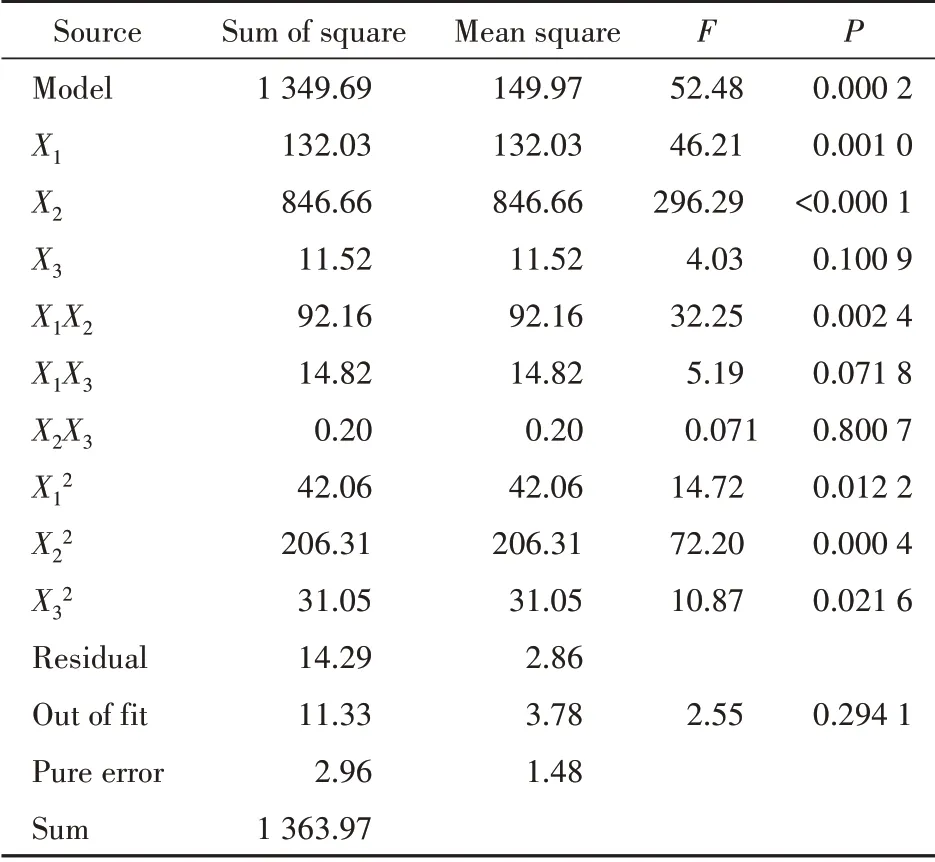
Table 5 Results obtained from ANOVA of Box-Behnken experiment design for optimization of encapsulation efficiency (Y2) of Lut-NLCs
曲面陡峭程度反映了因变量对自变量的敏感程度,当曲面陡峭时说明自变量对因变量的变化敏感性较大,而当曲面平坦时说明自变量对因变量的变化敏感性较小。由图1可知,固体脂质浓度和液体脂质浓度对Lut-NLCs 的粒径分布显示出较为陡峭的曲面,即随着固体脂质质量浓度的增加,粒径出现增大趋势,随着液体脂质质量浓度的增加,粒径出现减小趋势,这是由于固体脂质质量浓度的增加(或液体脂质质量浓度的降低),导致体系的黏度增大,所得到的Lut-NLCs 粒径较大;同样,由图2 可知,固体脂质质量浓度和液体脂质质量浓度对Lut-NLCs 的包封率显示出较为陡峭的曲面,包封率随着固体脂质质量浓度的增加而降低,随着液体脂质质量浓度的增加而增大。
Figure 1 Response surface diagram of solid lipid concentration (X1),liquid lipid concentration (X2) and surfactant concentration (X3) to the particle size distribution (Y1) of luteolin nanostructured lipid carriers (Lut-NLCs)

Figure 2 Response surface diagram of solid lipid concentration (X1),liquid lipid concentration (X2) and surfactant concentration (X3) to the encapsulation efficiency (Y2) of Lut-NLCs
粒径分布和包封率通常作为纳米给药系统的重要指标进行处方优化,本研究要求制备的Lut-NLCs 要求粒径分布达到“最小值”,包封率达到“最大值”,通过实验软件对建立的数学模型进行综合分析,得到Lut-NLCs 的最优处方为:固体脂质质量浓度为18.0 mg/mL、液体脂质质量浓度为13.0 mg/mL,表面活性剂质量浓度为15.0 mg/mL,预测粒径分布为206.0 nm,包封率为86.8%。按照最优处方制备3 批Lut-NLCs 进行验证,测定3 批样品粒径的平均值为(210.4±17.3)nm,包封率为(88.4±1.2)%,实验值与预测值相近,拟合的最优处方可信度较高。
3.3 微观形态观察
通过透射电子显微镜可观察到Lut-NLCs 为球状或类球状(图3),表面光滑圆整,粒径分布均匀,粒径大约在200 nm分布。

Figure 3 Transmission electron micrograph of Lut-NLCs
3.4 溶出度研究
Lut-NLCs和Lut溶液的体外释放曲线如图4所示,可以看出Lut 溶液在2 h 内药物可达到完全释放;而Lut-NLCs 在最初的2 h 内药物快速释放,超过40% 的药物从纳米结构脂质载体中释放出来,推测一部分药物吸附在纳米结构脂质载体表面,导致初始阶段药物呈爆发式释放,这种条件下有利于药物迅速达到抑菌浓度,快速抑制细菌增殖;在后期药物释放较为缓慢,在12 h 药物释放达到95%,这部分药物推测是通过扩散或脂质材料溶蚀的方式释放,后期的这种药物平稳缓慢释放可以维持稳定抑菌浓度,能够起到长效抑菌。

Figure 4 In vitro drug release rate of Lut-NLCs and Lut-solution (xˉ±s, n = 6)
3.5 体外抑菌实验
实验结果显示,Lut 原料药和Lut-NLCs 的对金黄色葡萄球菌和大肠埃希菌均具有抑菌效果,经测定Lut 原料药对金黄色葡萄球菌的抑菌圈直径为(16.7±0.8 mm)(图5-A),对大埃希菌的抑菌圈直径为(14.9±0.4 mm)(图5-C),而Lut-NLCs 对金黄色葡萄球菌的抑菌圈直径为(22.6±0.9 mm)(图5-B),对大肠埃希菌的抑菌圈直径为(24.1±0.8 mm)(图5-D),说明Lut-NLCs 对金黄色葡萄球菌和大肠埃希菌的抑菌效果优于Lut原料药。
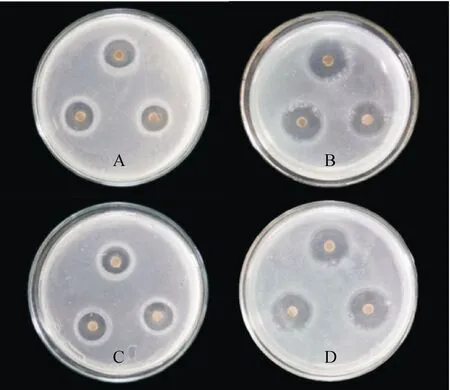
Figure 5 Inhibition zones of Lut APIs and Lut-NLCs against Staphylococcus aureus (A/B) and Escherichia coli (C/D)
4 讨 论
纳米结构脂质载体制备工艺包括:高压均质法、溶剂扩散法、微乳法、超声法、乳化蒸发-低温固化法、热熔乳化-超声法等[15],其中热熔乳化-超声法是制备纳米结构脂质载体的常用方法,该制备工艺是将热熔状态下的混合脂质(包含药物)油溶液加入到含有表面活性剂的水溶液中,形成初乳液,再将该溶液通过探头超声处理即可得到一定粒径大小的纳米结构脂质载体。热熔乳化-超声法与其他制备工艺相比,具有制备工艺简单,对设备要求不高、实验重复性良好等优点,因此本研究采用热熔乳化-超声法制备Lut-NLCs。
药物在纳米结构脂质载体中的包载方式分为吸附和包裹两种,其不同的包载方式决定其在体外的释药行为;吸附在表面的药物主要聚集在纳米结构脂质载体外周的表面活性剂中,在前期出现暴释现象;包裹在内部的药物主要包封在缺陷性结晶和脂质层中,在释药后期通过脂质溶蚀将药物释放出来,表现为后期释药平稳、缓慢。
本研究为了提高木犀草素的溶解性及渗透性,将其制备成纳米结构脂质载体,并通过抑菌圈实验证明Lut-NLCs 对金黄色葡萄球菌和大肠埃希菌的抑菌效果均高于原料药。这可能是由于Lut-NLCs的粒径极其微小,比表面积巨大,能够有效的吸附到细菌表面[16],且纳米结构脂质载体的外表面被泊洛沙姆188 所包裹,具有较强的亲水性,与细菌接触后能够渗透到细菌细胞壁中,改变细胞壁的结构,增加了细胞壁的渗透性[17],有助于Lut-NLCs迅速进入细菌内部,达到更好的抑菌效果。
