糖皮质激素辅助治疗重型新型冠状病毒肺炎的回顾性分析
2020-12-24朱天怡王美菊李聪聪徐张文静斌胡明冬
刘 熙 朱天怡 王美菊 李聪聪徐 瑜 郭 亮 张文静 王 斌胡明冬 李 琦 马 壮 宋 青
由严重急性呼吸综合征冠状病毒-2(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)引发的新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)于2019年12月被首次报告[1]。由于其具有高度传染性、聚集性以及人群普遍易感,该病迅速蔓延,成为严重的世界性公共卫生事件[2-6]。迄今为止,尚无高级别循证医学证据支持的抗SARS-CoV-2药物,仍以对症、支持、维持机体内环境稳定等综合治疗手段为主[7]。鉴于人体感染冠状病毒后潜在的炎症反应机制,糖皮质激素(简称“激素”)作为临床应用最为广泛的抗炎和免疫抑制剂,此次被写入官方指南和多个专家共识谨慎推荐使用[8-11]。尽管有最新研究提示,皮质类固醇可不同程度降低需要呼吸支持的COVID-19患者的病死率,但激素使用在临床实践中仍然存在较大争议[12-13]。本项目纳入某医院2020年2月28日在院且被确诊为重型COVID-19的患者,回顾性分析激素的使用情况及其影响,为进一步优化COVID-19的治疗策略提供参考。
材料与方法
一、研究对象
收集截至2020年2月28日24:00某医院普通病区在院且被确诊为重型COVID-19的患者,根据在院期间有无激素用药史分为激素组和非激素组,激素组根据激素累积使用剂量进一步分为<200 mg、200~399 mg、400~799 mg、>800 mg四个亚组(按甲泼尼龙计)。按照《新型冠状病毒肺炎诊疗方案(试行第六版)》,核壳蛋白基因、开放阅读编码框ORFlab 片段RT-PCR检测阳性作为COVID-19确诊标准[8]。重型患者须符合下列任何一条:(1)出现气促,呼吸频率≥30次/min;(2)静息状态下,指氧饱和度(SpO2)≤93%;(3)动脉血氧分压(PaO2)/吸氧浓度(FiO2)≤300 mmHg(1 mmHg=0.133 kPa)。肺部影像学显示24~48 h内病灶明显进展>50%者按重型管理。所有病例均符合以上诊断标准。
二、研究方法
记录所有患者的一般信息,包括性别、年龄、临床症状、基础疾病、病程(按起病至开始治疗时间计)、抗病毒治疗方案等。各组患者均随访至出院。激素组患者收集信息包括:激素用药方案,病程中不同阶段(激素给药前1天或最近1次、停药后3天)的体温、当日最佳指氧饱和度(简称“指氧饱和度”)、血常规相关信息(白细胞计数、中性粒细胞绝对值、淋巴细胞绝对值)、C反应蛋白(C reaction protein, CRP)、降钙素原(procalcitonin, PCT)以及相关不良反应发生情况和最后转归。非激素组患者收集信息包括:入院初和入院后1周的体温、指氧饱和度、血常规相关信息(同激素组)以及相关不良反应发生情况和最后转归。另收集各组患者咽拭子SARS-CoV-2核酸转阴时间,即该患者首次检测咽拭子SARS-CoV-2核酸结果“阳性”至首次结果“阴性”(检测两次,间隔至少24 h且均为“阴性”,以第一次时间计)的天数。
三、统计学方法
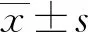
结 果
一、一般资料
共纳入符合诊断标准的195例患者,激素组72例,非激素组123例,性别构成、年龄、临床症状、合并基础疾病、病程(按起病至开始治疗时间计)、抗病毒治疗、体温等组间比较无统计学差异(P>0.05)。激素组指氧饱和度中位数略低于非激素组[96(92~98)vs. 97(95~98)],但组间比较存在明显统计学差异(P<0.05)。激素组患者白细胞计数、中性粒细胞绝对值均在正常范围内但明显高于非激素组(P<0.05),淋巴细胞绝对值明显低于非激素组[0.90(0.68~1.10)vs. 1.29(0.93~1.62)](P<0.05),CRP明显高于非激素组[34.56(9.69~62.27)vs. 7.60(2.19~37.28)](P<0.05)。因各组观察对象PCT结果缺失较多,为避免偏倚,在此未予纳入分析,见表1。
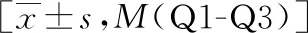
表1 各组患者一般资料比较
二、激素组(激素干预后)与非激素组(入院后1周)相关指标比较
激素组(激素干预后)和非激素组(入院后1周)指氧饱和度中位数有所提升,且前者明显高于后者[99(98~99)vs. 98(97~99),P<0.05];激素组(激素干预后)白细胞计数和中性粒细胞绝对值亦明显高于非激素组(入院后1周)(P<0.05),但仍在正常范围内;两组淋巴细胞计数均有所回升且水平相近[1.39(1.08~2.18)vs. 1.36(1.05~1.82)],但组间无统计学差异(P>0.05)。体温和CRP组间比较无统计学差异(P>0.05)。因各组观察对象PCT结果缺失较多,为避免偏倚,在此未予纳入分析,见表2。
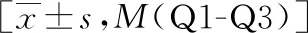
表2 激素组(激素干预后)与非激素组(入院后1周)结果相关指标比较
三、不同激素剂量亚组干预后相关指标比较
进一步比较不同激素剂量干预对相关指标的影响,采用方差分析比较了激素累积剂量<200 mg、200~399 mg、400~799 mg、>800 mg四个亚组指标的差异性,最小显著差异法多重比较发现各亚组指氧饱和度、白细胞计数和淋巴细胞绝对值之间均无统计学差异(P>0.05)。因个别亚组个别观察对象中性粒细胞绝对值和CRP结果异常增高,为避免偏倚,未行进一步亚组分析,见表3。
四、各组患者咽拭子SARS-CoV-2核酸转阴时间
激素组和非激素组患者咽拭子核酸转阴时间的中位数[20.00(15.00~26.00)vs. 19.00(13.00~23.00),天]相近,组间比较无明显统计学差异(P>0.05)。
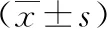
表3 不同激素剂量亚组干预后相关指标结果比较
五、各组患者不良反应发生情况及转归
激素组共报告6例、8人次不良反应,分别占该组总患者例数的8.33%和11.11%,男性为主,年龄均超过60岁,其中70岁以上占比2/3。不良反应均报告血糖较基线水平明显升高,其中还同时有2例出现血压较基线水平明显升高。非激素组无不良反应报告。各组患者均好转出院,未见病情恶化和死亡。
讨 论
作为一种新发疾病,人类目前对COVID-19认识还不够全面和深入,而当前疫情还在持续,各国政府和医学界都面临巨大挑战。长久以来,人类在特异性抗病毒药物的研发方面进展相对缓慢;此次疫情爆发以来,包括瑞德西韦、洛匹那韦/利托那韦在内的临床药物试验结果尚不尽如人意[14-15];而距离SARS-CoV-2疫苗的成功研发并获批推广还仍需时日。低氧血症、呼吸衰竭是重型COVID-19的突出临床表现,在目前抗病毒药物多数还处于试用阶段的情况下,以氧疗、呼吸支持治疗为主、维持机体内环境稳定、促进康复的治疗原则[7,11]就显得尤为重要。
SARS-CoV-2引发COVID-19的机制尚不十分清楚。研究发现SARS-CoV-2的基因序列与已有类SARS病毒变种相似性高达86%,有限的病理解剖结果也提示其引起的病理变化很可能与SARS存在诸多相似[16-17]。研究证实,机体感染冠状病毒后,局部器官大量炎症细胞浸润,释放出包括肿瘤坏死因子(tumor necrosis factor, TNF)-α、白介素(interleukin, IL)-1、IL-6、IL-8、IL-12、干扰素(interferon, IFN)-α、IFN-β、IFN-γ、单核细胞趋化蛋白(monocyte chemotactic protein, MCP)-1等在内的大量炎症因子,启动炎症风暴,降低细胞免疫和体液免疫功能,显著增强细胞凋亡和血管渗漏,使病毒清除受限,进而导致急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)甚至死亡等不良结局[18-19]。我国学者新近研究也发现,COVID-19患者初始血浆炎症因子浓度显著高于健康成人,提示炎症风暴发生基础的存在[20]。激素本身并无抗病毒作用,但其广谱对抗全身性细胞因子风暴的作用在动物研究中被证实,广州、香港等地经验也提示合理使用激素可能在降低病死率、延长生存时间、缩短住院天数以及控制免疫性肺损伤等方面使重症SARS患者更多临床获益[21-23]。碍于医院条件,纳入本项目的观察对象未能全面检测常见血清炎症标志物水平,故无法准确评估其炎症反应程度。但从表1可知,初始观察阶段,激素组患者中性粒细胞绝对值、CRP结果在基线水平上明显高于非激素组患者(P<0.05),尤其是CRP值;而患者体温正常,白细胞计数和中性粒细胞绝对值无明显异常升高,提示并发细菌感染可能性小。另有文献明确指出,成人,尤其是50岁以上者,外周血淋巴细胞明显减少是重型COVID-19的重要临床预警指标[11,24]。本项目发现,在初始观察阶段,激素组患者淋巴细胞绝对值中位数明显低于非激素组患者(P<0.05)。综上,间接推断,本项目中激素组患者的炎症反应程度可能较非激素组重,病情更甚,综合临床判断,在基础治疗之上给予该组患者激素行抗炎治疗亦符合指南和专家共识推荐意见[8-11]。
经过治疗,激素组(激素干预后)和非激素组患者(入院后1周)的指氧饱和度较各自初始观察阶段水平均有明显提高,且激素组(激素干预后)较非激素组患者(入院后1周)更优(P<0.05)。结合所观察到的CRP经激素干预后明显降低,且同非激素组患者(入院后1周)相近(P>0.05),推测激素组患者氧合改善更优于非激素组的变化可能直接得益于激素干预下机体炎症风暴水平的降低。观察发现,激素组患者(激素干预后)白细胞计数和中性粒细胞绝对值较治疗前增加,且和非激素组(入院1周后)比较存在明显统计学差异(P<0.05),结合临床上未见明显细菌感染相关征相,故推测可能与附着在血管壁和骨髓中的中性粒细胞在激素作用下进入循环血相关[25]。激素本身还可通过抑制淋巴细胞有丝分裂、促进淋巴细胞凋亡、增加其在脾和肺的破坏而使外周血淋巴细胞绝对值减少,进一步降低机体免疫功能[25]。而本项目观察到激素组患者(激素干预后)外周血淋巴细胞计数明显回升,结合其氧合能力的改善和CRP水平的明显下降,推测其与患者病情可能的良好转归相关。为了解不同激素剂量对患者氧合改善的影响,结合具体实际,根据患者病程中激素累积剂量将其划分为<200 mg、200~399 mg、400~799 mg、>800 mg四个亚组后进一步分析,但无阳性发现,不除外与样本量偏少相关。
另一方面,《柳叶刀》刊发述评提醒关注激素应用的潜在风险和危害,如糖代谢异常或糖尿病的恶化、类固醇性高血压、继发感染(包括细菌、真菌、分枝杆菌等)、消化道出血、缺血性坏死、精神异常、病毒清除延迟等[26]。本项目中,激素组共报告6例、8例激素相关性不良反应,主要表现为糖代谢异常和血压较基线水平明显升高,经对症处理,均控制在可接受的安全范围内,并无其他常见激素相关性不良反应报告。和非激素组相比,激素组亦无病情恶化和死亡病例报告。还有多个冠状病毒感染相关研究明确指出激素的使用可延缓病毒清除[27-29]。而本项目中,激素组患者咽拭子SARS-CoV-2核酸转阴时间与非激素组并无显著差异,同文献报道的平均咽拭子病毒RNA转阴时间(18.2 d)接近[30]。以上情况,可能与诊疗过程中严格遵循指南和专家共识、准确把握指征、方案和剂量个体化、短疗程、严密观察、动态评估等相关,也进一步提示激素治疗重型COVID-19的有效性和安全性。至于本项目研究关于激素相关不良反应的发生和各组病毒核酸转阴时间方面的结果同前述某些文献报道存在的差异,不排除与各研究观察对象的选择、激素用药时机、剂量和疗程以及其他混杂因素相关。
综上所述,在充分评估、准确把握指征的前提下,在其他强化治疗的基础上,给予重症COVID-19患者适当剂量和疗程的激素治疗,可能抑制机体炎症风暴、降低继发性多器官功能损伤风险,更有利于纠正低氧血症和呼吸衰竭,为患者后期康复赢得宝贵时间,且用药风险可控,转归预期好[31-32]。但本项目仍存在一定局限性:(1)本项目属于回顾性研究,关于氧合功能考察指标的选择,因所观察对象普遍缺少动脉血气分析结果,故未能采用氧合指数,而采用当日最佳指氧饱和度替代,信度因此受到一定程度影响;(2)病例样本数偏少,随访时间偏短,研究结果可能无法全面、真实的反应激素对重型COVID-19患者的影响。长期以来,激素在病毒性肺炎治疗中的使用一直备受争议,在当前“外防输入、内防反弹”的防疫抗疫大背景下,有必要进一步开展激素辅助治疗COVID-19的随机对照研究。
