多囊卵巢综合征造模药物对大鼠内分泌和组织结构影响的初步比较
2020-12-22李天鹤武香梅刘瑞霞阴赪宏
李天鹤,武香梅,刘瑞霞,阴赪宏*
(1.首都医科大学附属北京妇产医院 北京妇幼保健院,北京 100026;2.北京老年医院,北京 100095)
多囊卵巢综合征(PCOS)是育龄期女性常见的内分泌疾病,发病率大约为5%~10%。PCOS患者常常伴随生育力、内分泌和代谢功能的改变[1]。PCOS患者主要的临床特征,包括排卵功能障碍、高雄激素血症和卵巢多囊样改变等。此外,PCOS患者主要的代谢功能异常,包括肥胖、代谢综合征、胰岛素抵抗和脂质代谢异常[2]。近年来多项研究发现,PCOS患者发生非酒精性脂肪肝疾病(Nonalcoholic Fatty Liver Disease,NAFLD)、酒精性脂肪肝炎(Nonalcoholic Steatohepatitis,NASH)和心血管疾病的发生率高于普通人群[3-4]。
深入研究PCOS的病因学对其诊断和治疗具有重要的临床意义,但是由于人类伦理等因素限制了PCOS病因学的研究进程,而动物模型恰好能弥补这一不足,丰富PCOS病因学的基础研究,是PCOS发病机制研究过程中不可或缺的重要手段。自1960年起,陆续出现了猕猴、山羊和啮齿类动物的PCOS模型,其中在产前暴露于雄激素的山羊和非人类灵长类动物可以很好地模拟人类的PCOS表型[5-7]。山羊和猕猴产前暴露于雄激素均可以出现寡排卵或无排卵、卵巢多囊样改变、LH超分泌以及胰岛素抵抗等症状[8]。由于啮齿类动物的饲养成本低、繁殖较快,易于基因编辑,因此,目前多采用啮齿类动物作为模型研究PCOS的发病机制。目前文献中的啮齿类PCOS动物模型通常利用雄激素、雌激素、芳香酶抑制剂、抗孕激素以及改变光照等手段进行PCOS模型的构建。不同造模药物对大鼠内分泌和糖脂代谢的影响不同。
目前缺少PCOS动物模型相关的标准,以及对多种PCOS模型大鼠内分泌、糖脂代谢的综合比较。此外,关于多种PCOS动物模型中主要组织器官结构变化也鲜有报道。因此,本研究利用脱氢表雄酮(Dehydroepiandrosterone,DHEA)、双氢睾酮(Potent Non-aromatizable Androgen,DHT)和来曲唑(Letrozole,LET)这3种药物分别构建PCOS大鼠模型,通过分析各模型构建药物组大鼠内分泌代谢水平、各组织器官结构变化,初步了解不同造模药物在PCOS大鼠模型构建过程中的作用,为今后PCOS疾病的研究提供一定参考。
材料和方法
一、实验材料
1.实验动物:3~4周龄SD雌性大鼠(SCXK(京)2016-0002)购买并饲养在谱尼测试集团股份有限公司,SPF级屏障系统,饲养温度为24~26℃,湿度为50%~70%,光照黑暗时间比为12 h/12 h,自由饮水取食。本实验中动物的使用已获得中国科学院大学实验动物使用与管理委员会批准。所有动物实验操作过程符合NIH规定的实验动物福利和道德规定。
2.主要实验试剂及仪器:DHEA(D8950,北京索莱宝科技);DHT(S4757,Selleck,美国);LET(L6545,Sigma,美国);睾酮(T,MC12987)、雌二醇(E2,MC12312)、LH(MC12403)、FSH(MC12313)、胰岛素(Insulin,INS,MC12996)和ELISA检测试剂盒等均购买于北京美辰联创生物科技有限公司;甲醇(北京化工厂);瑞氏染色液(SL7030,北京酷来博科技);4%多聚甲醛(G1101,武汉赛维尔生物科技);显微镜(CKX41,Olympus,日本)。
二、实验方法
1.实验分组:选取3~4周龄SD大鼠40只,随机分为正常对照组、脱氢表雄酮(DHEA)组、双氢睾酮(DHT)组、和来曲唑(LET)组,分别给予皮下注射注射用油剂、6 mg/100 g DHEA[9]、85 μg DHT[10]、1 mg/kg LET[11],每天1次,连续注射21 d。造模第22天,将大鼠分为2部分,一部分用于取材(每组6只),一部分进行动情周期观察(每组4只)。
2.取材:大鼠造模第22天,用消毒的注射器从大鼠眼球取血并分离血清待测。大鼠断颈处死,将新鲜心、肝、脾、肺、肾和卵巢组织固定于4%多聚甲醛,24 h后用于HE染色。
3.体重的测定:每7 d称量大鼠体重。造模第22天,大鼠断颈处死分离心、肝、脾、肺、肾和卵巢组织并称重。
4.大鼠动情周期观察:从大鼠给药第22天开始,每天上午10:00用无菌棉签浸泡在0.9%的生理盐水中,沿阴道璧的前1/3处涂抹并沿同一方向涂抹到玻片上,用无水甲醇固定阴道脱落细胞5~8 min,滴加2~3滴瑞氏染色液染色3 min,滴加等量磷酸盐缓冲液,轻晃玻片至均匀,静置5 min,水洗至少3 min,待自然干燥或吸干,镜检[12],连续10 d,并绘制动情周期曲线。动情前期涂片特征:以小、圆、有核上皮细胞(鳞状上皮细胞)存在为特征;动情期:以不规则(角质化)的鳞状上皮细胞为特征;动情后期:以白细胞和角质化细胞为特征;动情间期:白细胞和圆上皮细胞出现为特征。大鼠失去规律的动情周期,或持续处于动情间期,则提示无排卵。
5.大鼠血清激素水平检测:取各组血清按照ELISA试剂盒说明书检测T、E2、LH和FSH含量,用酶标仪(Spark 10M,Tecan,Switzerland)于波长450 nm下检测其OD值。
6.大鼠血清生化检测:使用全自动生化分析仪Olympus AU400(Olympus,日本)检测各组大鼠血清中总胆固醇(Total Cholesterol,TCHO)、甘油三酯(Triglyceride,TG)、葡萄糖(Glucose,GLU)和INS含量。稳态胰岛素评价指数(HOMA-IR)是用于评价个体的INS抵抗水平的指标,HOMA-IR=空腹血糖水平×空腹胰岛素水平/22.5。
7. HE染色:将取到的心、肝、脾、肺、肾和卵巢等组织固定于4%多聚甲醛24 h后,常规石蜡包埋切片,HE染色后在显微镜下观察,记录染色结果。每次实验中每组选取3~4只大鼠,每次实验任意选取3~4张切片。
三、统计学方法
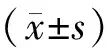
结 果
一、大鼠血清中激素水平测定
与对照组相比,DHEA组血清T、E2水平显著升高(P<0.05),而血清LH、FSH水平无统计学差异(P>0.05);与对照组相比,DHT组血清E2、LH水平显著升高(P<0.05),血清T、FSH水平无统计学差异(P>0.05);与对照组相比,LET组血清T、LH水平显著升高(P<0.05),血清E2水平显著降低(P<0.05),而FSH水平无统计学差异(P>0.05)(表1)。
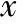
表1 各组大鼠血清激素水平比较(-±s)
二、动情周期的检测
经过连续10 d的涂片及镜下观察发现,各组动情周期变化如图1所示。与对照组相比,3种建模药物组均无明显的大鼠动情周期变化,持续处于动情间期,提示无排卵,其中DHEA组处于动情间期时间最长。
A:对照组;B:DHEA组;C:DHT组;D:LET组;P:动情前期;E:动情期;M/D:动情后期/间期图1 各组大鼠动情周期曲线
三、卵巢病理学改变
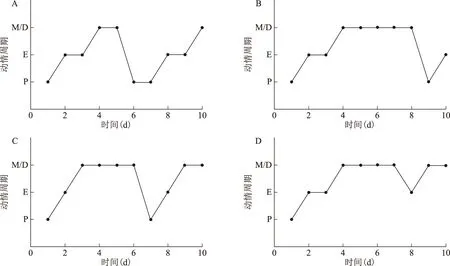
HE染色结果显示,3种建模药物均能引起卵巢组织发生囊样改变(箭头所示),其中DHEA组大鼠卵巢多囊样改变最为显著(图2)。
四、各组大鼠糖脂水平比较
与对照组相比,DHEA组TCHO、INS水平及HOMA-IR显著增高(P<0.05),TG、GLU水平无统计学差异(P>0.05);与对照组相比,DHT组TCHO、INS、TG、GLU水平及HOMA-IR均无统计学差异(P>0.05);与对照组相比,LET组TCHO、TG、GLU水平均无统计学差异(P>0.05),INS水平及HOMA-IR显著增高(P<0.05)(表2)。
五、大鼠体重及各组织重量的变化情况比较
与对照组相比,DHEA组、DHT组大鼠体重变化无统计学差异(P>0.05),而LET组大鼠体重显著升高(P<0.05)(图3A)。造模第21天,与对照组相比,DHEA组大鼠心脏/体重比、肝脏/体重比显著增加(P<0.05),而卵巢/体重比显著下降(P<0.05),脾、肺和肾/体重比无统计学差异(P>0.05);与对照组相比,DHT组和LET组大鼠的心、肝、脾、肺、肾和卵巢组织重量/体重比均无统计学差异(P>0.05)(图3B)。
A:对照组;B:DHEA组;C:DHT组;D:LET组;箭头示囊样改变图2 各组大鼠卵巢结构(HE染色 ×40)
表2 各组大鼠血清中糖脂含量比较(-±s)
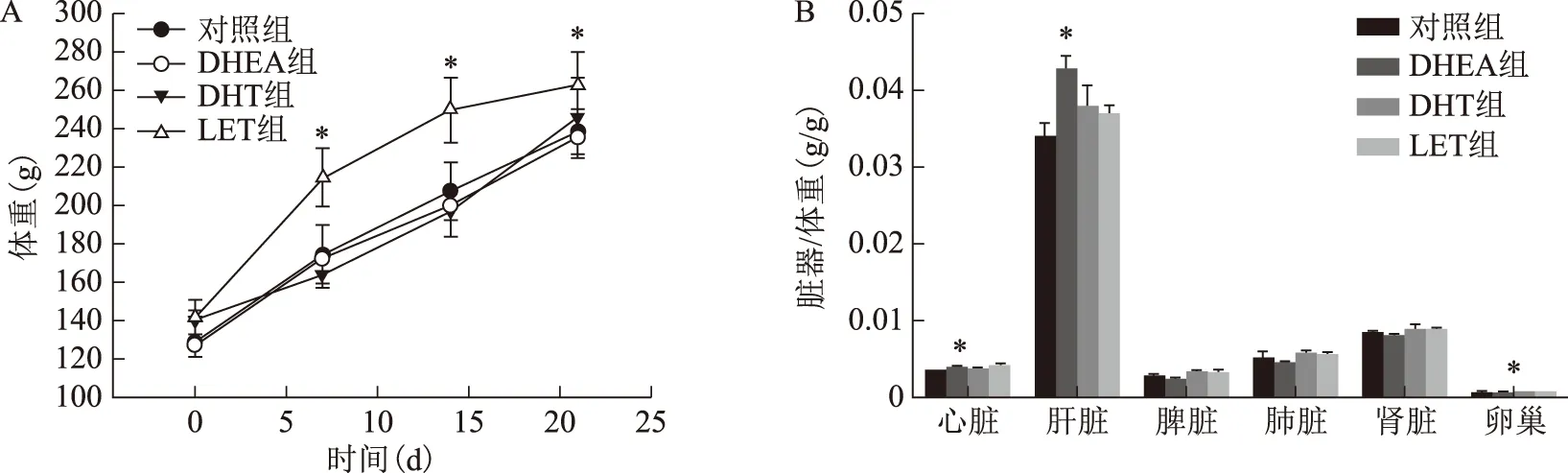
A:体重的变化;B:各组织器官重量的变化;与对照组比较,*P<0.05图3 各组大鼠体重及各组织重量的变化情况
六、各组大鼠主要组织器官结构的变化情况
对照组和DHEA组中大鼠心脏组织中的心肌细胞呈不规则形,核卵圆形,细胞核1~2个,位于细胞中央;DHT组和LET组大鼠心脏组织中的局灶细胞间可见少量淋巴细胞浸润。
对照组和DHT组大鼠肺脏组织中肺泡结构尚在,部分肺泡腔轻度塌陷,肺泡间隔增宽,间质内可见少许淋巴细胞、嗜酸性粒细胞浸润;DHEA组大鼠大部分肺泡腔轻度塌陷,间质内可见少许淋巴细胞、嗜酸性粒细胞浸润;LET组大鼠大部分肺泡间隔增宽,支气管周围淋巴组织增生。
各组大鼠的脾脏组织中,红髓和白髓结构清晰,脾小结生发中心明显,边缘带清晰可见,脾索及脾窦结构清晰,与对照组比较,DHEA组大鼠脾小结生发中心不明显,局部伴纤维组织增生(图4)。

图4 各组大鼠主要器官组织结构(HE染色 ×100)
讨 论
本研究建立并比较了3种PCOS造模药物对大鼠内分泌和各组织器官结构的影响。我们的研究结果显示,DHEA、DHT和LET 3种建模药物对大鼠血清激素水平、体重以及各组织器官结构等方面的作用各不相同,为今后构建PCOS动物模型提供一定参考。
高雄激素血症是PCOS临床诊断标准之一。大鼠孕期DHT短期处理可以显著上调雄激素水平[13],而本研究中,DHT处理育龄期大鼠 21 d后,大鼠PCOS表型不明显,T未出现升高趋势,E2和LH水平显著增加,卵巢组织出现多囊改变,这可能与药物处理时间的长短和处理方式有关系。DHEA处理可以上调大鼠血清中E2和T水平。而LET处理上调了LH水平,下调E2水平。因此,可以看出3种不同PCOS造模药物,对大鼠性激素的调控作用不同。此外,3种PCOS模型药物均可以诱导大鼠动情周期失调,可能与雄激素暴露有关。产后暴露于丙酸睾酮(Testosterone Propionate,TP)、产前暴露于DHT、长期暴露于DHT均可以导致大鼠排卵功能障碍,而DHEA处理大鼠可以导致生殖障碍[14-16]。
除性激素水平的改变外,肥胖和胰岛素抵抗也是PCOS的重要临床表现之一[17]。在模型构建期间,与对照组比较,DHEA组和DHT组大鼠体重无显著变化,但是DHEA组大鼠血清中TCHO含量显著增加(P<0.05),并表现出胰岛素抵抗症状。在造模第21天,LET组大鼠体重显著高于对照组(P<0.05),并表现出胰岛素抵抗,这可能与性激素水平有关[18-19]。因此,DHEA和LET诱导的PCOS动物模型可能更加适用于进行糖脂代谢相关方面的研究。
PCOS可以导致慢性无排卵、高雄激素血症、不孕和肥胖等疾病,增加NAFLD、NASH和心血管疾病的发生风险[20-21]。其中雄激素发挥了重要作用,长期T处理可以导致大鼠体重增加,导致胰岛素抵抗,进一步引起肝损伤[22]。利用DHEA处理大鼠21 d,诱导胰岛素抵抗发生,从而促进肝脏脂质沉积[23]。此外,雄激素对炎症的调控具有细胞特异性。DHT重建减少了过敏性肺炎症小鼠的肺部炎症,但它增强了肺泡巨噬细胞的M2极化。在体外也能增强IL-4刺激的M2巨噬细胞极化[24]。DHT组和LET组大鼠心脏组织中的局灶细胞间可见少量淋巴细胞浸润;DHEA处理可导致大鼠肺泡腔轻度塌陷,以及少许淋巴细胞、嗜酸性粒细胞浸润;此外,DHEA处理大鼠,可导致脾脏组织中脾小结生发中心不明显,局部伴纤维组织增生;LET处理可导致大鼠肺泡间隔增宽,支气管周围淋巴组织增生。可见,除诱导PCOS表型外,DHEA、DHT和LET还可对大鼠的部分组织和器官的结构造成影响。
