基于动态TOPSIS 法的中、美、日医药创新能力与潜力评价研究
2020-12-22张铭洺茅宁莹
张铭洺,茅宁莹
(中国药科大学国际医药商学院,江苏南京 211198)
医药产业是国民经济的重要组成部分,是支撑发展医疗卫生事业和健康服务业的重要基础。然而,长久以来,中国医药创新能力低,九成以上药物通过仿制获得[1]。在创新驱动发展成为国家“十三五”核心战略,将生物医药产业打造成为创新支柱产业之一的大背景下,国家陆续出台了多项创新科技发展政策,以提高我国医药创新能力。2018 年,我国医药工业累计实现主营业务收入25 840 亿元,同比增长12.7%;累计实现利润总额3 364.5 亿元,同比增长10.9%。近两年,创新品种药物研发成果显著,截至2019 年7 月,累计获得139 个品种新药证书,44 个1 类新药获批,我国创新药物能力水平得到了空前的发展[2]。
我国医药产业从低端仿制向创新强国发展,而当前我国医药创新能力整体水平如何,国家已实施的医药创新政策效果如何,还有赖于对我国医药产业创新能力的综合评价研究。但是,目前国内外对我国整体医药创新能力的客观评估研究还有所欠缺。此前,国外评估机构进行国家或区域创新能力评估,多以问询函方式根据医药行业内百名高管的咨询结果来进行宏观评估,缺少评价指标体系的数据量化结果,缺乏客观性。国内学者则大多从省、市等行政单元作为研究对象,研究其创新能力与潜力[3],国家层面上的研究较少。其次,国内学者多从创新投入、产出两方面建立指标体系评价我国医药创新性能力,但是,在创新过程环节,无论是指标体系研究还是量化评估研究都尚不充分。因此,本文将从创新过程环节,建立评价指标体系,分析评价当前我国医药创新能力与潜力,分析发现我国创新过程环节的薄弱点,为后续医药创新的发展布局建言献策。
1 医药创新能力与潜力评价指标体系建立
医药创新能力与潜力是国家医药产业经济增长的决定性因素。目前国际上,在评价国家创新能力的研究领域中影响力较大的研究有4 种,分别为世界经济论坛(The World Economic Forum,WEF)的《全球竞争力报告》(The Global Competitiveness Report),瑞士洛桑国际管理学院的《世界竞争力年度报告》,世界知识产权组织、欧洲工商管理学院以及康奈尔大学联合发布的《全球创新指数》,以及欧盟发布的《欧洲创新记分牌》(European Innovation Scoreboard,EIS)[4]。其中2018 年的《全球竞争力报告》是从有利环境、人力资本、市场、创新生态系统四个方面进行评估,创新生态系统则是从企业活力、创新能力两方面评价[5]。《欧洲创新记分牌》则是考虑了“框架条件”“投资”“创新活动”“影响”四种主要的指标类型[6],其中“创新活动”涵盖的是创新者、联系和知识资产三个创新维度。最初,国内外创新能力评价指标体系的研究主要集中在人员投入、资金投入、创新环境等方面[7-8],之后,国内学者尝试从创新投入—创新过程—创新产出产业链来探索研究创新能力评价指标体系,目前来看,大多学者的研究集中在创新投入和创新产出环节[9],在创新过程环节的研究尚不充分,如赵丽等[10]从创新投入和产出层面选取七个指标建立创新绩效评价指标体系,孙峰等[11]从创新基础、创新资源、创新投入、创新产出、创新效率等五个方面建立创新潜力评价指标体系,唐力等[12]从创新资源投入、创新支撑、创新产出能力三个方面构建医药创新能力评价指标体系,吴玲霞等[13]则是从科研层面上的科研基础、科研投入、科研产出三个维度来评价医药制造业的创新能力。
从医药行业的创新产业链角度来看,医药行业除人员、资金等的创新投入、新产品的业务收入等的创新产出外,创新过程中的临床前研究和临床研究需要更加深入的探索研究。此外,在医药创新的临床前药物试验和临床试验两阶段,大多会伴有论文发表和专利申请的出现。因此,本文决定在医药创新过程环节建立医药创新潜力的评价指标体系,包括5 个一级指标临床试验数量、药物研发公司数量、药物研发数量、专利申请数量和论文发表数量以及26 个二级指标包括各期临床试验开展数量,药物研发全生命周期的药物研发公司数量和药物研发数量,专利家族数量、发明授权率、专利平均进入国家数、医药创新领域发文量等(见图1)。

图1 药物研发全生命周期
2 数据获取
为客观评价目前我国的医药创新能力与潜力的发展情况,本文从科睿唯安cortellis 竞争情报数据库中,采集2008 年1 月1 日至2018 年12 月31 日期间内的26 项二级指标数据。同时,本文将我国的医药创新潜力与发达国家的医药产业创新潜力进行横向对比研究,鉴于数据库中“base”筛选的可操作性,本文仅采集同时期美国、日本的有关数据,欧盟地区暂不做考虑。此外,由于数据采集时的筛选项为“Small molecule compounds”(小分子化合物),因此,本文26 项二级指标数据也不涉及中药等。
3 中美日创新过程指标数据分析
3.1 临床试验开展情况
3.1.1 临床试验总量
从临床试验开展总量整体来看,2008—2018 年间,中、日持平,约为美国的1/4。11 年里,中国总共开展临床试验13 439 个,日本共开展14 010 个,美国最多共计开展57 459 个。图1 中为中国、美国、日本11 年间的年度临床试验开展总量与增长率变化情况,可看出中国2012 年增长率最高,同比增长了3.8 倍;日本2013 年出现增长顶峰,同比增长了3.2 倍;美国临床试验开展总量整体呈现下降趋势,仅2014 年出现明显增长,同比增长1.2 倍。十年间的复合增长率来看,2008 年中国临床试验开展数量为328 个,2018 年为3 084 个,累计增长了8.4 倍;美国2008 年开展数量为11 602 个,2018 年为4 247个,减少了60%;日本2008 年为561 个,2018 年为1 371 个,仅增长了1.4 倍。由此可见,中国临床试验的发展速度远超美国、日本。
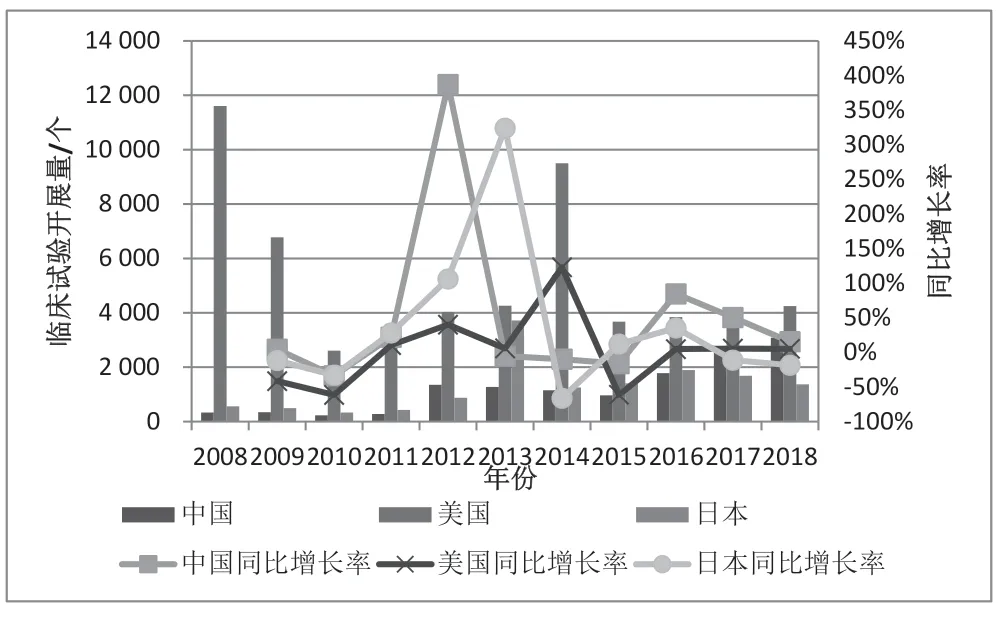
图2 2008—2018 中、美、日临床试验开展总量及同比增速
3.1.2 临床试验分期占比
从临床分期数量占比情况来看,2008—2018 年间,中国临床试验开展数量占比0 期最少,II 期最多。0 期临床试验数量仅占总量的0.71%,Ⅱ期占比32.53%。中国的0 期临床试验由最初的数量0,发展为2018 年35 个,尚处于起步发展阶段,而美国0 期临床试验从2008 年的28 个,发展到2018 年的243 个,因此,可以看出与美国成熟的早期临床研发体系相比,我国的基础研发能力与美国仍有较大差距,亟待发展。
同样的,中国开展数量占比最多的Ⅱ期临床试验,在数量上也仅为美国的1/5、日本的3/5。虽然中国Ⅱ期临床试验开展数量从2008 年的46 个开展到2018 年的1 284 个,增长近30 倍,但美国11 年间一直保持着每年最少1 000 左右的Ⅱ期临床试验数量,表明我国通过近十年的快速发展才将将追赶到美国的平均水平左右,后续能否保持持续增长显得尤为重要。与日本相比,则会发现,日本多年间在I 期临床试验未见明显增长的情况下,II 期临床试验数量呈现明显增长趋势,表明日本在I 期临床项目的转化成功率高于中国,我国要考虑如何提高研究项目和研究水平质量的问题。
此外,Ⅰ期临床试验数量增长态势也十分可观,增长近30 倍。Ⅲ期临床试验,2017、2018 年两年中,中国开展数量约为美国的一半;IV 期临床试验开展数量却已经超过美国,可能是由于一致性评价政策的出现所造成的。
总的来讲,越是早期的临床试验越能代表药物研发的基础研究能力。2008—2018 年,中国0 期临床试验数量共计96,仅占总数量的0.71%;占据绝大部分临床资源的则是Ⅱ期、Ⅲ期和Ⅳ期临床试验,说明我国的基础研究能力还有待提高,Ⅱ期、Ⅲ期和Ⅳ期临床试验项目虽多,但质量如何、是否值得耗费如此多的临床资源仍待商榷。

图3 2008—2018 年中、美、日各期临床试验数量及占比
3.2 开展药物研发的公司数量情况
3.2.1 药物研发公司总量
2008—2018 年间中国开展药物研发的公司数量一直多于日本,但仍不足美国的1/3。中国开展药物研发的公司数量十年间复合增长了2.4 倍,略高于美国的2.2 倍,日本的1.5 倍。图4 可见,中国在2012 和2017 年的同比增长率最高,年度增长率在30%左右。美国和日本整体的增长趋势较为平稳。
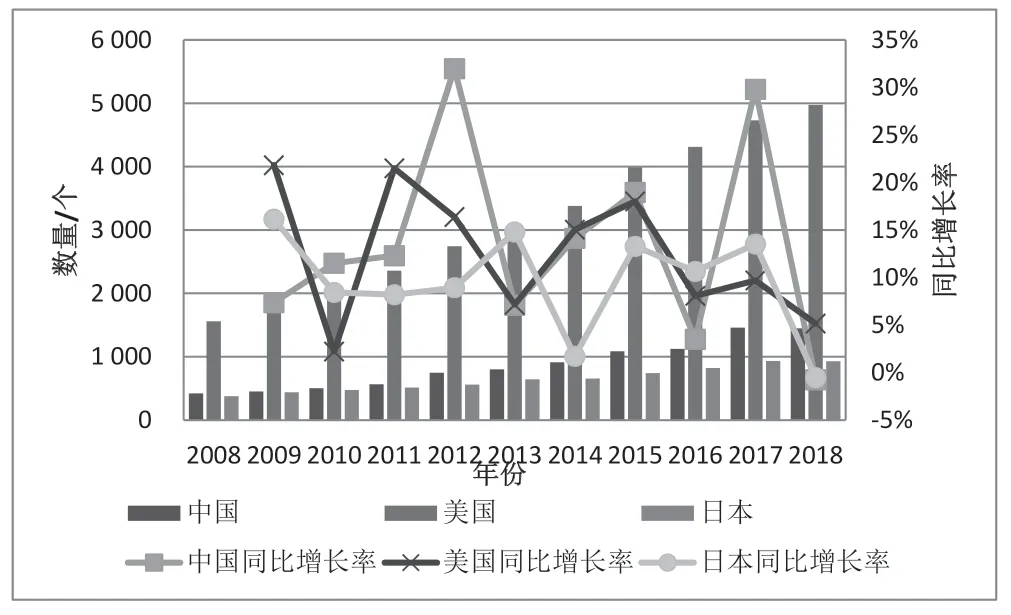
图4 2008—2018 年中、美、日药物研发公司数量及增长情况
3.2.2 药物研发阶段的公司数量占比
图5 为按照药品研发全生命周期阶段划分,中国、美国、日本开展药物研究处于不同阶段的公司数量及占比。本文按照研发投入和获取收益的分界点来将药物研发的全生命周期划分为两个阶段,前期为包括从discovery 到Ⅲ期临床等四个阶段为研发投入阶段,后期为pre-registered、registered 和launched 三个阶段的收益阶段。
在2008—2018 年间,中国绝大多数公司处于研发投入阶段,共7016 个,占比73.7%;而处于收益阶段的公司数量为2504 个,占比26.3%;同样按照研发投入和收益阶段来划分,美国处于研发投入阶段的公司占比79.5%,收益阶段的公司20.47%;日本则是处于研发投入阶段的公司占比59.3%,收益阶段的公司占比40.7%。从药品研发不同阶段的公司数量的增长趋势来看,中国、美国的增长趋势大体一致,日本增长乏力。


图5 2008—2018 年中、美、日开展各期药物研发的公司数量占比
3.3 药物研发数量情况
3.3.1 药物研发总量
2008—2018 年间中国药物研究数量一直多于日本,但不到美国的1/3。中国药物研发的数量十年间复合增长了2.8 倍,低于美国的3.6 倍,高于日本的2.0 倍。图6 可见,中国在2012、2015 和2017 年的同比增长率相对较高,年度增长率达30%左右,但其余年份增长不明显。而美国和日本整体的增长趋势较为平稳。结合药物研发公司数量的变化情况来看,中国的药物研发公司数量的增长幅度大于药物研发数量的增长幅度,美国则相反,表明整体而言,美国的药物研发公司的实力要高于我国。
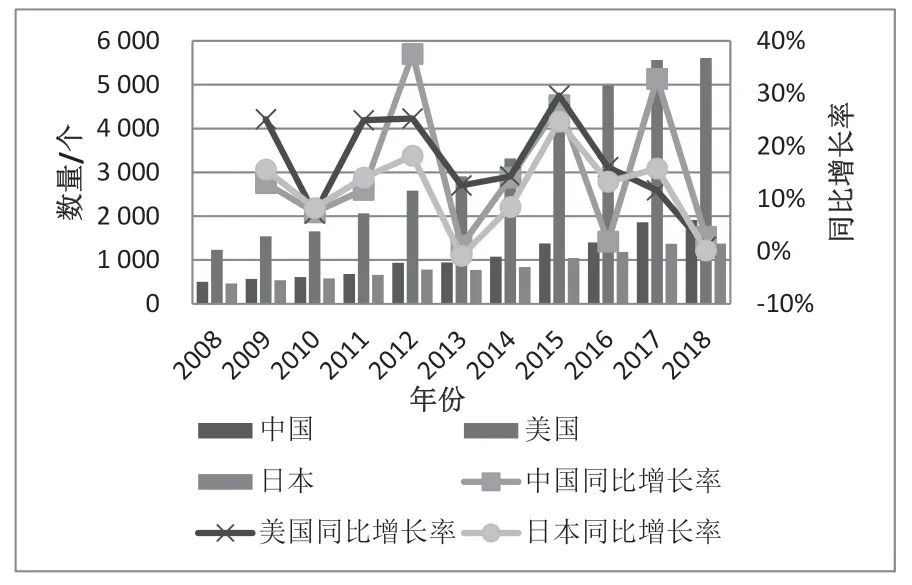
图6 2008—2018 年中、美、日药物研发数量情况
3.3.2 药物研发不同阶段的数量占比
从图7 看出,在2008—2018 年间,中国处于研发投入阶段的药物数量为7 736 个,占比65%;处于收益阶段的药物数量为4 127 个,占比35%。美国处于研发投入阶段的药物数量为27 993 个,占比78%;处于收益阶段的数量为7 755,占比22%;而日本处于研发投入阶段的药物数量为4 549 个,占比47%;处于收益阶段的数量为5 058 个,占比53%。由此可见,医药产业的研发态势美国比中国、日本更为强劲。具体到不同阶段的增长情况来看,十一年间,中国pre-registration 预注册阶段和registered注册阶段的药物数量分别增长近6 倍和3 倍,而Launched 上市阶段的药物数量,除2012 年以外,未见明显增长,因此,需推进完善药品注册后到上市阶段的衔接政策,如MAH 制度等。

图7 2008—2018 年中、美、日药物研发数量占比
3.4 专利数量
由于专利申请、授权等的滞后性,专利家族数量、发明授权率和专利平均进入国家数主要分析研究2008—2016 年的相关数据。
3.4.1 中国专利家族数量
2008—2016 年,医药领域平均每年申请专利家族数量中国32 022,美国11 282,日本4 516。图8可看出,至2016 年,中国专利家族的申请数量呈快速上升趋势;美国和日本均呈缓慢下降趋势。表明我国医药产业相关技术的发明创造能力有了明显的提升,逐渐形成了重视和保护知识产权的良好氛围,有利于医药产业的进一步发展。

图8 2008—2018 年中、美、日专利家族数量
3.4.2 中国专利发明授权率和平均进入国家数
2008—2016 年,医药领域平均每年的发明专利申请的授权率中国为37.27%,美国为51.10%,日本为58.89%。图9 可见,日本的发明授权率历年处于高位,美国次之,中国较低。也就是说,每年中国申请的专利仅有不到40%的专利获得了授权,与美国、日本相比,我国申请的发明专利的质量还有待提升。
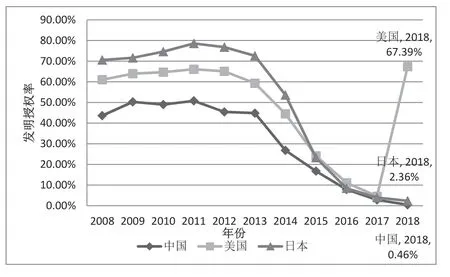
图9 2008—2018 年中、美、日发明授权率
2008—2016 年,平均每年的获得授权后的专利平均进入国家数中国1.41,美国4.73,日本4.98。图10 可看出,平均进入国家数中国和美国没有显著变化;日本在2013 年后略有下降。专利平均进入国家数越高,表明专利的创新性和质量也越高,从该项指标可以看出,我国与美国、日本在发明专利的质量层面存在明显差距。

图10 2008—2018 年中、美、日授权专利平均进入国家数
3.5 中国论文发表数量
2008—2018 年,医药领域中国年均论文发表量为94 624 篇,美国为330 178,日本54 340。由图11 可见,2008—2018 年间中国论文发表数量增长迅猛,美国、日本增长平稳。在发表数量上,中国已经远超日本,但论文的创新性和影响力还有待进一步评估。
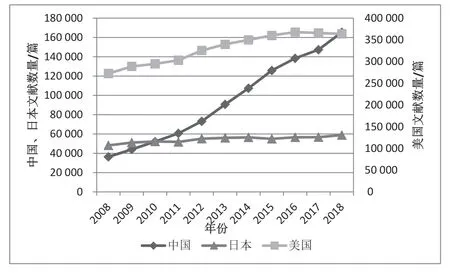
图11 2008—2018 年中、美、日论文发表数量
4 综合评价
4.1 综合评价方法
综合评价是采用一定的方法给每个评价对象赋予一个评价值,再据此择优或排序的过程。目前常用方法有模糊综合评价、因子分析法、聚类分析法、TOPSIS 法等[14]。此类评价方法,大多是根据每个评价对象的客观值进行赋值比较,例如霍明等[15]采用层次分析法(AHP)将专家打分转化为客观权重分数,利用TOPSIS 法对农业科技园区的创新潜力进行评价和排名,倪艳亭等[16]利用熵权TOPSIS 模型对都市圈创新潜力进行评价。而对于本文所研究的医药创新潜力而言,作者认为将年度增量纳入评价考量,综合评价对象的客观值和增量值进行加权赋值,更能代表某个国家或地区的创新潜力。因此,本文选择动态TOPSIS 法进行综合评价。
4.2 动态TOPSIS 法及其原理
动态TOPSIS 法,是在TOPSIS 法的理论基础上,将年度增量纳入评价考量,引入静态指标值与指标增量值的协调系数θ以及代表不同时刻重要程度的时间权向量wk,最后得到综合评价值hi的综合评价方法。动态TOPSIS 法是王一任等[17]首次提出,将其引入到医疗质量评价中应用,目前,动态TOPSIS法的应用尚不普遍,本文首次尝试将动态TOPSIS 法运用到医药创新潜力综合评价领域,以期能够得到目前我国医药创新潜力更为客观的评价结果。
首先,进行同趋势化处理和归一化处理,得到归一化矩阵。动态TOPSIS 法的归一化结果可看成是静态序列与动态增量加权合成的 结果,,θ为兼顾静态指标值与指标增量值的协调系数(,表示只考虑静态指标值;标示只考虑增量值)。然后,确定有限方案中的最优方案和最劣方案,并计算各时点各评价对象与最优方案和最劣方案的距离。再分别计算不同时刻各评价对象与最优方案的接近程度。之后,引入时间权向量熵I 和代表不同时刻重视程度的时间度λ,由初始时间权重向量迭代计算求果得到时间权向量wk。最后,计算综合评价值值越大越优。。
4.3 综合评价结果
本文以0.02 为起始值,构造n=11 的等差数列作为初始时间权重向量。取λ=0.1-0.9 的值,采用SAS 软件进行迭代计算,结果见表1。结果可见,只有当λ取0.3-0.6 时,才能得到有意义的解。因此,考虑到λ取0.4 时,既能得到有意义的解,且其值相对保守,本文最终选定λ=0.4 时的时间权重向量纳入运算。

表1 时间权重向量迭代计算结果
θ=0.5;wk=(0.051 8,0.057 4,0.063 6,0.070 4,0.078 0,0.086 3,0.095 6,0.105 9,0.117 3,0.129 9,0.143 9)时,动态TOPSIS 法求得的结果见表2,分别为各时间点()中国、美国、日本三国的最优距离、最劣距离、接近程度以及综合评价值。
评价结果显示,2008—2018 年,中国、美国、日本动态TOPSIS 的综合评价值分别为0.306 6、0.453 5、0.211,可以认为在本文建立的指标体系下,采用动态TOPSIS 的综合评价的结果是中国的医药创新潜力已初步赶超日本,正在追赶美国。
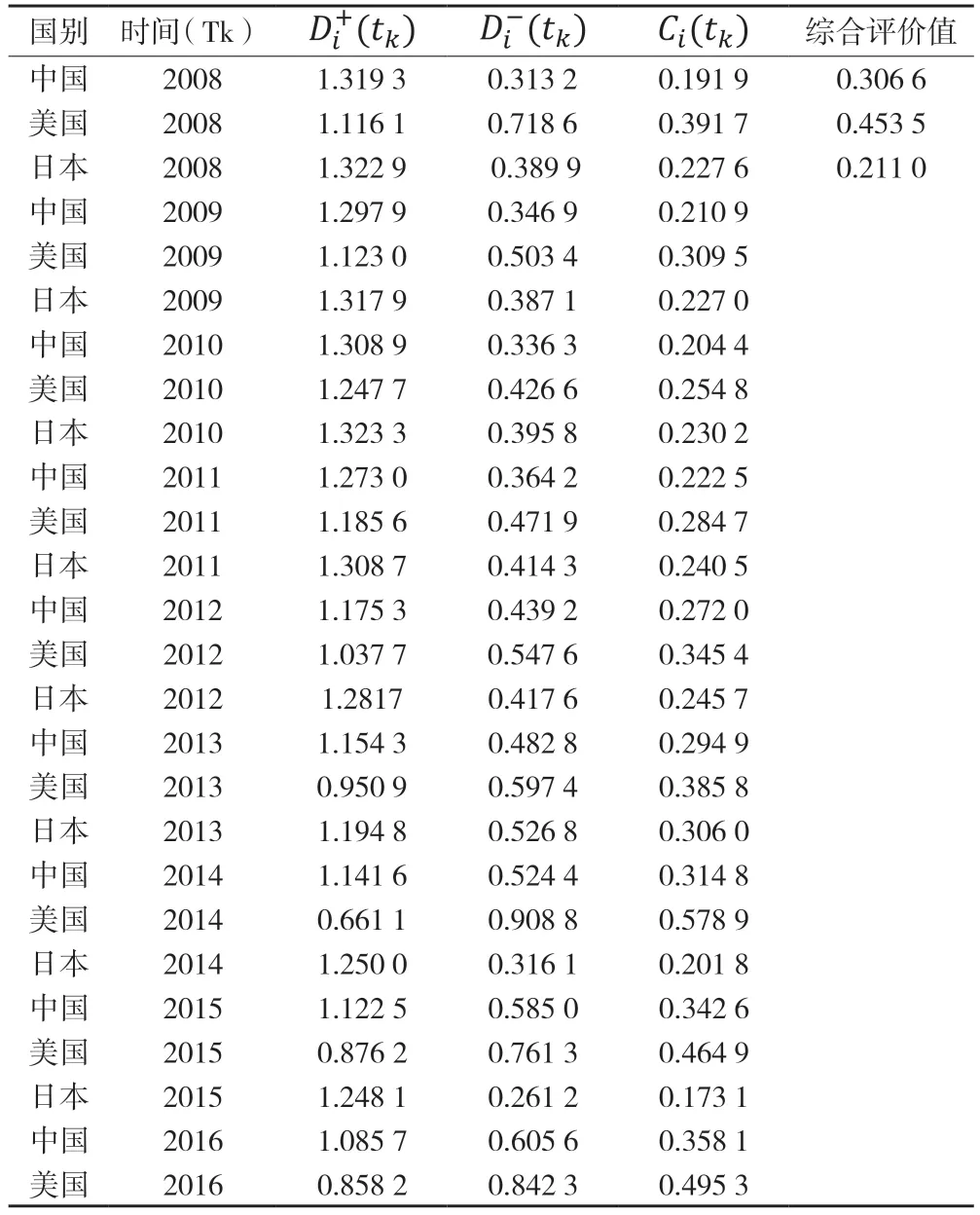
表2 中国、美国、日本动态TOPSIS 综合评价结果

表2(续)
5 结果与讨论
自2008 年以来,国家药物政策体系不断完善,医药企业自我创新意识不断提高,中国在医药创新过程环节中的临床试验开展数量、药物研发公司数量、药物研发数量、专利家族数和论文发表数量等方面大步追赶美国和日本,在数量层面上实现了显著的增长,同时,创新能力与潜力有了显著的提升。
(1)中国医药创新潜力初步赶超日本,正在追赶美国。综合评价值,美国>中国>日本。
(2)中国医药创新积极性提升明显,药物研究开展广泛,医药产业尚未进入收获期。中国临床试验数量已经超越日本,II 期临床试验开展数量最多,Ⅲ期、IV 期临床试验开展数量增速超过美国和日本,0 期临床试验尚处于起步阶段。中国药物研发公司数量与药物研发数量均超越日本,但中国企业研发的药物多处于早期研发阶段,且医药企业发展尚不成熟,与日本、美国已经进入收获期的医药产业相比,仍存在一定差距。
(3)创新过程产出的专利、文献数量大,但质量和影响力有待提高。中国专利家族申请数量最多,且增长迅猛;但发明授权率和平均进入国家数最低,专利质量有待提高。中国论文发表数量增长迅猛,增速远超美国、日本,但影响力水平有待进一步评估。
6 医药创新体系布局建议
中国医药产业正处于创新能力快速发展期,创新潜力巨大,但如何继续保持增速,并经长期量的积累飞越至质的改变,使我国医药创新能力得到整体提升,真正实现医药产业的创新驱动发展,还需要国家政策体系上的保障,大量资金的不断投入,创新全产业链的精准布局以及医药产业的协同创新发展的同步推进。
(1)重视基础研究。十余年来,临床前药物研究与临床试验研究开展数量突飞猛进,处于早期研发阶段的药物数量高居不下,但0 期和I 期临床试验的发展形势不如Ⅱ、Ⅲ、Ⅳ期,国家科研项目立项时应继续大力支持基础临床研究项目,并加强科研项目管理。
(2)引导多渠道资金融通。长久以来,我国大多数药物研究处于研发投入阶段。由于医药行业高投入、高风险特性,处于研发初期阶段的药物研究需要大量资金支持。除国家项目资金支持、鼓励医药企业自主研发外,还需提供税收、财政、金融等方面的优惠政策,引导多种渠道资金支持,助力医药产业创新发展。
(3)持续推进国家药物政策体系完善。优化审评审批制度,贯彻落实优先审评审批制度;完善知识产权保护制度、MAH 制度,加快技术成果转化;做好药品集中招标采购与创新药物进入医保目录的遴选和支付方式等政策制度的衔接,促进创新药的临床使用。
(4)打造科技创新园区和科研创新平台。政府出台相关优惠政策,助力打造科技园区与创新平台,加快校企联合培养人才步伐,实行开放的人才引进政策,汇集国内外医药行业尖端人才,集中力量攻坚克难,以临床需求为导向,实现“政企学研用”深度合作,构建形成体系化创新新载体,提高我国专利的实用性及科研成果论文的影响力。
7 结语
本文是国内首次着重在创新过程层面开展的国家医药创新能力与潜力的评价研究。本文的不足之处也在于评价指标建立时集中关注了创新过程环节指标,缺少在创新投入和产出层面的全面研究。另一方面,二级评价指标中缺少更多质量层面的指标数据,还需进一步完善。
