颈动脉CT 斑块特征与颈动脉支架成形术后新发脑缺血灶的相关性
2020-12-13季爱华郭大乔
季爱华 林 江 唐 骁 郭大乔 吕 鹏△
(1复旦大学附属中山医院放射科,3血管外科 上海 200032;2上海市影像医学研究所 上海 200032)
近年来颈动脉支架成形术(carotid artery stenting,CAS)已经逐步应用于临床,可部分替代颈动脉内膜切除术(carotid endarterectomy,CEA)用于治疗颈动脉粥样硬化狭窄。Sardar 等[1]的研究显示,多项随机前瞻性研究结果表明CAS 在防治颈动脉粥样硬化引起的脑卒中方面与CEA 能力相当。
CAS 术后颅内DWI-MRI 显示的新发脑缺血灶(new brain ischemic lesion,NBIL)是常见并发症。CAS 术后出现新发脑缺血梗死灶提高了患者远期脑血管缺血事件的再发率[2],也与CAS 术后认知功能下降[3]和痴呆[4]的发生密切相关。
颅内缺血梗塞灶的发生主要是支架置入颈动脉的过程中颈动脉斑块脱落所致,而这又与颈动脉斑块特征关系密切。Yoshimura 等[5]利用TOFMRI 序列识别斑块内出血(intraplaque hemorrhage,IPH),并得出IPH 斑块CAS 术后发生NBIL 的风险更大,据此建议含IPH 斑块患者尽量选择CEA 手术。Chung 等[6]对IPH 较敏感的重T1 序列分析后,认为IPH 与CAS 术后发生NBIL 无关。但是,Yoshimura 等[5]TOF 序列识别IPH 的准确率不高,以上研究均只涉及MRI 图像上IPH 单个因素的定性研究。Stojanov 等[7]的研究显示,CTA 图像上的纤维脂质斑块较纤维钙化斑块CAS 在术后出现的NBIL 数量更多。但以上研究只按有无钙化粗略分组,没有细致对斑块的成分及相关特征进行分析。
既往缺乏系统和定量化地研究斑块内各种成分及位置,且CT 相关研究甚少。而颈动脉CT 血管成像(computed tomography angiography,CTA)简便易行,在临床中应用广泛。CT 不仅能够准确评价颈动脉狭窄程度,还能清晰显示颈动脉斑块的表面形态、区分钙化斑块与非钙化斑块[8-9],检测钙化斑块的敏感度为100%[10]。因此,本研究旨在通过颈动脉CTA 成像定量及综合分析多种斑块特征,探索CTA 斑块特征与CAS 术后NBIL 之间的相关性。
资料和方法
研究对象回顾性分析2015 年1 月至2019 年10 月于复旦大学附属中山医院行颈动脉支架手术治疗的颈动脉狭窄患者。纳入标准:(1)拟行CAS手术;(2)症状性颈动脉狭窄≥50%或非症状性颈动脉狭窄≥70%。排除标准:(1)血管炎、夹层等非粥样硬化疾病导致的颈动脉狭窄;(2)血管闭塞;(3)颈动脉狭窄术后再狭窄;(4)CT 检查禁忌证。
所有患者均于术前2 周内接受颈动脉CTA 检查,术前1 周内接受头颅DWI-MRI 检查,期间患者无一过性脑缺血发作或脑卒中等新发缺血事件发生。术后72 h 内接受头颅DWI-MRI 复查。研究由本院医学伦理委员会批准(伦理号:B2014-004),所有患者均于检查前签署知情同意书。
颈动脉CTA 检查所有检查均在佳能320CT(Aquilion ONE)上完成。扫描范围为自主动脉根部到颅顶,扫描参数为:管电压140 kV,管电流80 mAs,螺距为0.6 mm,球管旋转时间为0.5 s/圈,层厚为1 mm。使用非离子型对比剂(碘必乐,I 370 mg/mL),根据患者体重计算对比剂总量,男性为75~80 mL,女性为65~75 mL。双筒高压注射器,经肘静脉注入造影剂,注射流率为4~5 mL/s,随后注射生理盐水约25~30 mL。采用团注追踪程序自动触发技术,触发扫描点位置定在主动脉弓,阈值设为100 Hu。
头颅DWI-MRI 检查头颅3T DWI 具体参数为:TR/TE 6400/86.0 ms,层厚5 mm,层间距1.5 mm,b 值为0 和1 000 s/mm2,FOV 220 mm×220 mm。扫描时间为46 s。
CAS 手术过程所有CAS 手术均由同一组的血管外科团队操作。所有患者术前1 周内开始口服肠溶阿司匹林(100 mg/d)和氯吡格雷75 mg/d,所有患者均行全身麻醉、经股动脉入路。通过头颈部血管造影评估颅内大脑半球血流状态、颈动脉狭窄程度及斑块表面形态。脑保护伞释放到位后进行颈动脉狭窄的预扩,所有患者在路径图模式下释放脑保护伞及颈动脉支架,残余狭窄≤30%。本研究应用了3 种脑保护装置:Emboshield NAV6(美国Abbott 公司),Filterwire EZ(美国Boston Scientific公司),Spider FX(美国Medtronic 公司);4 种支架:RX Acculink(美国Abbott 公司),Wallstent(美国Boston Scientific 公司),Precise(美国强生Cordis 公司),Protege(美国ev3 公司)。支架置入后即行血管造影,确认颈动脉远端有无新发栓塞,确保支架术后残余狭窄≤30%。
图像分析
颈动脉狭窄程度 参照NASCET 标准[11]:Ⅰ级(1%~29%),轻度狭窄;Ⅱ级(30%~49%)和Ⅲ级(50%~69%),中度狭窄;Ⅳ级(70%~99%),重度狭窄;Ⅴ级,闭塞。颈动脉斑块病变长度:将斑块长度定义为沿颈动脉长轴的病变范围。
不同类型斑块的分类标准 软斑块CT 值<60 HU,混合斑块CT 值为60~130 HU,钙化斑块CT值>130 HU[12]。
斑块表面形态学分类 根据文献[8]将颈动脉斑块的表面形态分为光滑、不规则以及溃疡3 种类型。溃疡定义为斑块表面局限性内膜缺损,宽度≥1 mm,CTA 上表现为突向斑块内的小龛影,深度至少为1 mm[13]。
钙化分类标准 根据管腔最窄处钙化斑块的位置将钙化斑块分为3 组:(1)内膜钙化组,钙化紧贴血管管腔面;(2)中间钙化组,钙化介于管腔面、血管外膜之间的斑块;(3)外膜钙化组,钙化位于血管腔外膜处。钙化范围分为5 级:0 级,无钙化;1级,钙化范围<1/4 血管圆周;2 级,钙化范围界于血管圆周的1/4~1/2;3 级,钙化范围界于血管圆周的1/2~3/4;4 级,钙化范围>3/4 血管圆周。
颈动脉斑块图像后处理所有CTA 原始图像上传至佳能工作站,利用Viteafx 6 软件进行后处理,软件自动勾画出斑块层面血管管腔和管壁,自动识别各类型斑块。横断面勾画出管壁区域及斑块成分后手动修改,软件自动计算出斑块总体积、长度、最大面积及最大厚度。记录并测量钙化斑块的范围、大小及位置,观察并记录斑块表面形态。
统计学分析采用SPSS 21.0 软件进行统计学分析。连续型变量用描述,应用独立样本t检验。分类变量用百分比表达,应用χ2检验。所有潜在危险因素进行单因素分析后,将P<0.05 的因素纳入多因素回归分析模型计算出预测CAS 术后出现NBIL 的独立危险因素。P<0.05 为差异有统计学意义。
结果
临床基本资料共有127 例拟行CAS 治疗的颈动脉狭窄患者满足入组标准,其中4 例患者因图像质量欠佳而被排除,最终共纳入患者123 例,其中男性107 例,女性16 例;年龄48~86 岁,平均(67.97±6.96)岁。所有患者均成功实施CAS 手术,1 例患者术后出现视网膜动脉栓塞,无患者围手术期出现心肌梗死或死亡等严重并发症。
患者术后3 天内复查头颅DWI-MRI 显示61 例NBIL(61/123,49.6%)。颅内NBIL 共142 灶,9 例患者出现双侧颅内NBIL。根据CAS 术后有无NBIL 将患者分为NBIL(+)组及NBIL(-)组,两组患者临床基本资料见表1。
单因素和多因素回归分析NBIL(+)组内有症状患者36 例(59.0%),NBIL(-)组内有症状患者35 例(56.5%),两组间差异无统计学意义。同时两组患者基本临床资料,包括缺血性心脑血管疾病、高血压、糖尿病的发病率、是否吸烟、主动脉弓类型、脑保护装置类型、支架类型的分布差异均无统计学意义。CTA 共检测出19 例斑块溃疡。CTA 所示斑块特性中斑块体积、斑块长度、斑块表面形态的差异均无统计学意义(表1)。
NBIL(+)组钙化总体积与NBIL(-)组比较差异无统计学意义[(225.40±179.35)mm3vs.(192.69±162.94)mm3],而NBIL(+)组最窄处钙化厚度大于NBIL(-)组[(1.79±1.38)mmvs.(1.38±0.83)mm,P=0.020]。NBIL(+)组内膜钙化的概率明显高于NBIL(-)组(34.4%vs.8.1%,P=0.002)。1 例术后出现右侧额叶NBIL(图1)。将以上两者纳入多因素回归分析模型中,并校正年龄、性别及斑块患侧因素,分析得出与无钙化斑块相比内膜钙化斑块(OR=15.65,95%CI:1.34~98.75,P=0.028)及斑块最狭窄处钙化厚度(OR=1.35,95%CI:1.01~2.10,P=0.045)是预测CAS 术后NBIL 的独立危险因素(表2)。而外膜钙化斑块及中间钙化斑块与CAS 术后NBIL 的发生无明确相关性。
表1 NBIL(+)组和NBIL(-)组患者临床基本资料和CT 斑块特征比较Tab 1 Patient clinical information and CT features between NBIL(+)group and NBIL(-)group[n(%)or]
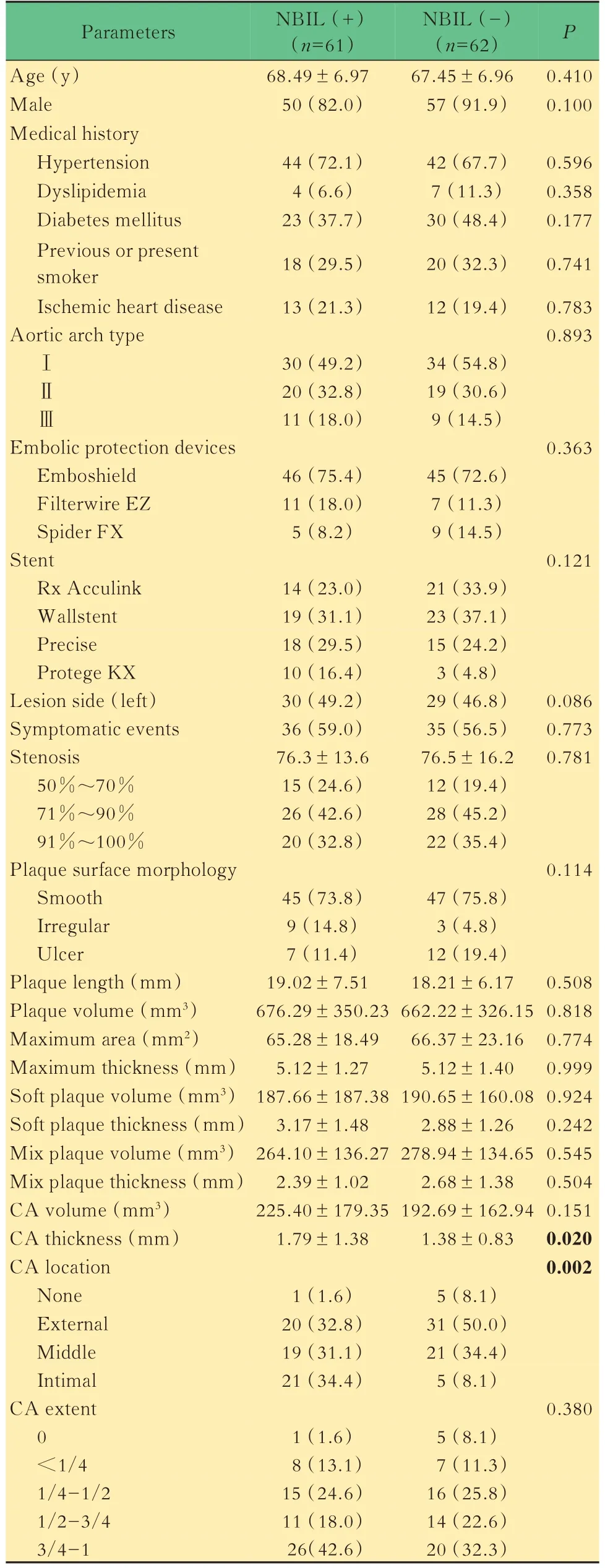
表1 NBIL(+)组和NBIL(-)组患者临床基本资料和CT 斑块特征比较Tab 1 Patient clinical information and CT features between NBIL(+)group and NBIL(-)group[n(%)or]
狭窄处钙化厚度预测NBIL 的ROC 曲线分析斑块最窄处钙化厚度预测NBIL 的ROC 曲线下面积是0.726(图2),临界值为1.75 mm,特异性为88.7%,敏感性为57.4%。阳性预测值为83.3%,阴性预测值为67.9%。
讨论
CAS 手术因创伤小、术后恢复快、无颅神经麻痹的风险以及术后心血管并发症发生率较低在临床的应用越来越广泛。但Cho 等[14]通过Meta 分析得出CAS 组术后出现NBIL 的概率明显高于CEA组(37.4%vs.13.0%),同时CAS 组术后发生脑卒中及一过性脑缺血事件的概率也高于CEA 组(4.1%vs.1.8%)。因此,术前评估CAS 手术的安全性并调整治疗方案降低术后NBIL 的发生是必要的。
本研究中,我们利用CTA 分析得出CAS 术后NBIL 的发生与狭窄处钙化的位置及厚度相关。当钙化斑块位于管腔内膜时,CAS 术后发生NBIL 的比例为34.4%,发生NBIL 的风险是无钙化病灶的约15 倍。当狭窄处钙化厚度以1.75 mm 作为预测CAS 术后NBIL 发生的界值时,其具有较高的特异性(83.3%)和阳性预测值(88.7%)。斑块的其他易损因素,如脂质坏死核心、薄的或破损纤维帽等,也有可能参与形成CAS 术后NBIL,导致狭窄处钙化厚度单因素的预测敏感度较低(57.3%)。

图1 1 例颈动脉内膜钙化患者CAS 术后出现NBILFig 1 NBIL of a patient with intimal calcified carotid plaque after CAS

表2 单因素及多因素Logistic 回归分析CAS 术后NBIL 相关因素Tab 2 Factors related to NBIL after CAS predicted by univariate and multivariate Logistic regression analysis

图2 狭窄处钙化厚度预测CAS术后NBIL 的ROC 曲线分析Fig 2 The ROC of the CA thickness for the predicton of NBIL after CAS
既往临床研究结果显示,钙化斑块是颈动脉斑块的稳定成分、不易自发破裂,颈动脉斑块钙化患者较无钙化患者较少表现出脑卒中等脑缺血症状[15]。但对于CAS 手术,钙化斑块会使支架扩展不充分、产生远端栓塞,且术后易产生持续性低血压、术后再狭窄、支架断裂等严重并发症[16]。而钙化斑块是否会引起CAS 术后颅内NBIL 的研究较少且结论存在争议[7,17-19]。Stojanov 等[7]的研究显示,CTA 图像上的纤维脂质斑块较纤维钙化斑块CAS术后出现的NBIL 数量更多。AbuRahma 等[18]的研究结果则显示,重度钙化组(钙化范围超过周长的1/2)在术后30 天内发生脑卒中的概率为6.3%,而无钙化或轻中度钙化组的概率为1.2%。Setacci等[20]的研究得出类似结论,即病灶处钙化组围手术期发生脑卒中的概率大于无钙化组(6.5%vs.2.3%)。以上研究在考虑钙化因素时,或没有对钙化进行明确的定量,或没有考虑钙化位置的因素。本研究对钙化斑块成分进行了定性定量分析,明确了钙化位置的重要性,提示位于内膜的钙化及钙化厚度是CAS 的危险因素。
重度钙化斑块增加了CAS 术中预扩、释放脑保护装置(embolic protection device,EPD)、支架定位、支架扩张等操作技术上的难度[19]。在重度狭窄斑块病例中,通常需对病变处进行渐进性预扩,先使用较小直径(2 mm)球囊进行预扩,以降低斑块破裂、远端栓塞的概率。而重度钙化斑块病例则需要使用更大直径的球囊(5 mm)进行预扩,确保随后支架能够顺利到位。预扩时重度钙化斑块需要更大的球囊压力来克服钙化斑块的挤压,钙化斑块受到的压力增大,增加了钙化斑块碎屑脱落的风险。重度钙化也增加了EPD 通过斑块的技术难度,使EPD无法顺利通过病变位置。在支架扩张时,由于病变处钙化、局部血管壁僵硬,导致血管壁与支架贴覆不完全,斑块局部压力增大[18],可造成支架内栓子形成,或支架内再狭窄及局部支架断裂。Barrett等[21]通过体外模型试验得出颈动脉斑块处增大的钙化体积将降低斑块拉伸力,会增加支架在置入颈动脉时斑块破裂的风险。而在支架置入过程中形成的较坚硬的钙化碎片更容易通过过滤器的孔隙导致远端颅内微栓塞的形成[22]。本研究中钙化体积在两组间的差异无统计学意义,提示单纯的钙化成分定量分析仍不能预测NBIL 发生,位于中层或外膜的钙化亦可形成较大体积的钙化。而位于狭窄处内膜粗大钙化直接承受球囊扩张、支架扩张时施加于斑块的压力,更易造成斑块碎片脱落,导致远端颅内微栓子形成。
我们的研究存在一些局限性。首先,鉴于CT无法准确地区分斑块内纤维组织、脂质核心、疏松基质、斑块内出血、纤维帽的成分,未对上述因素进行更细致的统计分析,在今后的研究中可联合MRI斑块序列共同分析斑块各项特征;其次,本项研究为单中心研究,仍需要更大的样本量及多中心研究来进一步验证钙化斑块预测CAS 术后发生NBIL的能力;再次,研究对象为CAS 手术患者,存在一定的入院偏倚;最后,研究对象为CAS 手术患者,无法获得斑块病理标本进行病理对照研究。
颈动脉钙化位置及钙化厚度与CAS 术后发生NBIL 相关。因此,在颈动脉支架术前CTA 检查中如检测出内膜钙化、狭窄处钙化厚度大于1.75 mm时,应评估患者全身状态,谨慎选择手术方式以降低术后心脑血管缺血事件的发生。
