干旱胁迫及复水对朱槿幼苗生理特性的影响
2020-12-11黄旭光黄玲璞王卫南
黄旭光 黄玲璞 王卫南


摘要 为了研究朱槿(Hibiscus rosa-sinensis Linn.)对干旱胁迫的响应,以朱槿盆栽幼苗为材料,进行干旱胁迫及复水试验,并对朱槿相关的生理指标进行测定。结果表明,叶片叶绿素随干旱胁迫强度的增加呈明显下降趋势,渗透调节物质、丙二醛(MDA)、保护酶(POD、SOD)活性均随干旱胁迫强度的增加而增加,复水后有所恢复,但都没有完全恢复到胁迫前的水平。综上,朱槿的自身调节能力较好,对干旱胁迫有较好的适应能力。
关键词 朱槿;干旱胁迫;复水;生理
中图分类号 Q945.78 文献标识码 A 文章编号 0517-6611(2020)21-0137-03
Abstract In order to study the response of Hibiscus rosasinensis Linn. to drought stress, this paper used Hibiscus rosasinensis Linn. potted seedlings as experimental materials to carry out drought stress and rehydration tests, and determined the physiological indexes related to Hibiscus rosasinensis Linn.. The results showed that the chlorophyll of leaves increased with the increase of drought stress intensity. The activities of osmotic adjustment substances, malondialdehyde (MDA) and protective enzymes (POD, SOD) increased with the increase of drought stress intensity. The change presents a very significant correlation. In summary, drought stress has a significant effect on the physiological indexes of Hibiscus rosasinensis Linn..
Key words Hibiscus rosasinensis;Drought stress;Rehydration;Physiology
基金项目 南宁市科技攻关项目“锦葵科木槿属优异种质资源收集与品种选育”(20192060)。
作者簡介 黄旭光(1978—),男,广西贵港人,高级工程师,硕士,从事园林植物研究与应用工作。*通信作者,硕士研究生,研究方向:园林植物及其应用。
收稿日期 2020-03-30;修回日期 2020-04-22
朱槿(Hibiscus rosasinensis Linn.)是常绿灌木,至今已有1 700年以上的栽培历史,几乎全年开花,花大且花量多,广泛分布于亚热带地区,具有优良的观赏价值,可作为观花植物,也可作药用,用途广泛[1]。全球陆地面积中干旱地区占了大部分,干旱是目前限制植物生长最主要的因素之一,在全球范围内,它显著影响着植物分布。近年来气候变化频繁对全球降水产生了显著影响,对地区性干旱分布也有影响,因此植物对水分的适应能力变得越来越重要。缺水不仅影响了植物生长、生理,长期严重缺水甚至可以影响植物的生态表现[2-3]。在城市园林绿地中,也常出现浇水不均的现象,这就要求作为园林绿化的植物具有较好的干旱适应能力,即使在缺水的状态下也能维持较好的观赏外形[4]。目前对于朱槿的研究较少,且集中于基质、花粉活力、病虫害等方面,对于朱槿在逆境中适应能力的研究较少。在朱槿扦插方面,谌振等[5]研究了朱槿扦插的最佳基质配比与最佳植物生长调节剂,张福平等[6]研究了4种植物生长调节剂对朱槿插枝生根的影响,结果表明不同品种朱槿的最佳基质配比与最佳生长调节剂浓度不同;易双双等[7]、李玉萍等[8]研究了不同朱槿品种的花粉活力,结果表明不同朱槿的花粉活力差异显著,最适培养基为20%蔗糖+0.02%硼酸;玉舒中等[9]研究紫外光胁迫对2种朱槿的影响,结果表明七彩朱槿的抗UV-B辐射能力比红色重瓣朱槿强。朱槿为南宁市市花,但在南宁市景观运用中,朱槿的应用还比较局限,研究朱槿对干旱胁迫的适应能力,可以了解朱槿对逆境的适应能力,为朱槿的生产及应用提供指导,也可以为朱槿在其他较干旱地区的应用提供指导。
1 材料与方法
1.1 材料
试验于2018年8—12月在广西南宁市园林科研所苗圃基地进行,该基地位于南宁市青秀区长塘镇。试验盆规格为内口径20.0 cm、底径15.2 cm、高20.5 cm。栽培基质为田园土,土壤全氮含量0.45 g/kg,全磷含量1.42 g/kg,有机质含量7.2 g/kg,田间持水量为33.55%,试验用苗木采用半年生的朱槿苗木,移植后进行相同的光照和水分管理,缓苗60 d。
1.2 方法
2018年8月,采用称重法人工模拟自然干旱胁迫,在试验前将土壤风干,确定土壤的田间持水量和最低含水量,再进行装盆移苗,缓苗期为2个月。缓苗期过后进行干旱胁迫试验,按 Hsiao[10]和黎裕[11]的标准划分,对供试植物进行对照CK(含水量90%~95%)、中度干旱胁迫(含水量50%~55%)、中度干旱胁迫及复水、重度干旱胁迫(含水量30%~35%)、重度干旱胁迫及复水共5种控水处理,每个处理10株。对照、中度干旱胁迫、重度干旱胁迫处理组在设定的含水量下处理40 d,中度干旱胁迫复水、重度干旱胁迫复水试验组在设定的含水量下处理30 d后复水10 d。
各样品于测定当天08:00—09:00进行采集,每次采植物的第3~8片大小均一的功能叶用以测定各项生理指标,每个处理3个重复。叶绿素含量采用分光光度法测定[12];可溶性蛋白采用考马斯亮蓝G-250法测定[13];叶片可溶性糖含量采用蒽酮-浓硫酸法测定[14];脯氨酸含量采用酸性茚三酮法测定[15];丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定;POD、CAT活性采用分光光度法测定;SOD活性采用氯化硝基四氮唑蓝(NBT)光化还原法进行测定[14]。
1.3 数据分析
数据用Excel进行整理和统计,运用SPSS Statistics 19.0软件对数据进行方差分析及相关性分析比较。
2 结果与分析
2.1 干旱胁迫及复水对朱槿叶绿素含量的影响
由表1可知,在干旱胁迫试验中,叶绿素a、叶绿素b、总叶绿素之间差异都达到极显著水平(P<0.01),叶绿素含量随干旱胁迫的加剧呈现减少趋势。对照组(CK)的叶绿素a、叶绿素b、总叶绿素含量均为最高,分别为1.22、0.69、1.90 mg/g;中度干旱胁迫和重度干旱胁迫的叶绿素含量有明显降低,且重度干旱胁迫的含量明显低于中度干旱胁迫,在复水之后均有恢复,复水后的含量低于对照。
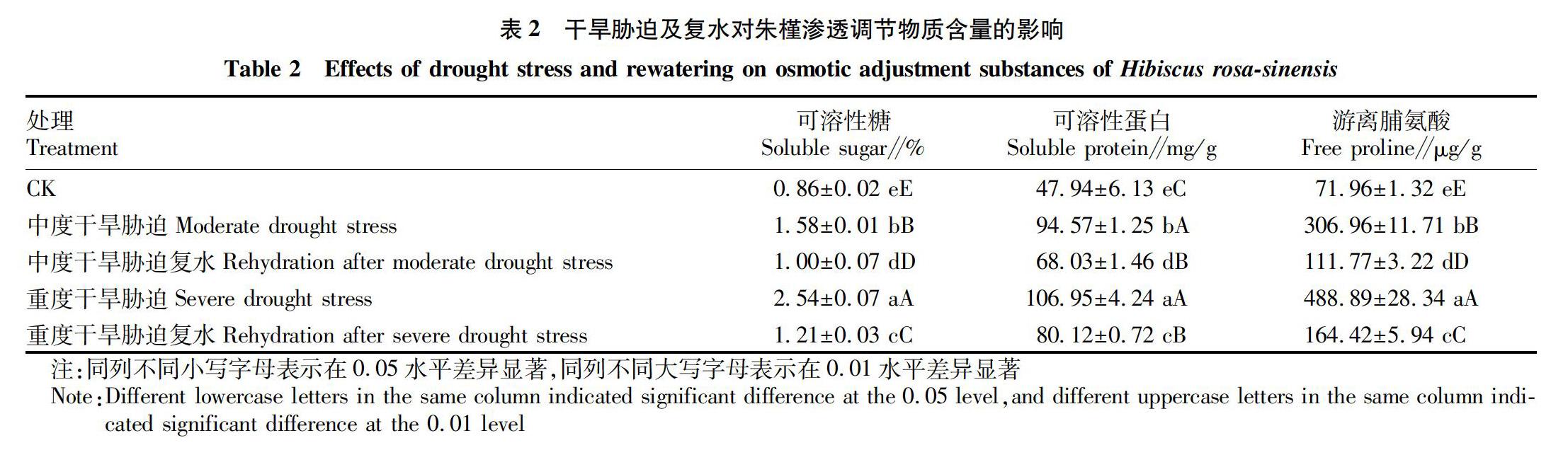
2.2 干旱胁迫及复水对朱槿渗透调节物质含量的影响
植物的渗透调节物质主要有可溶性糖、可溶性蛋白、游离脯氨酸等,其在植物渗透调节中起着重要作用[16]。 由表2可知,干旱胁迫对朱槿叶片的渗透调节物质可溶性糖、可溶性蛋白、游离脯氨酸的影响都极显著(P<0.01),且随干旱胁迫的程度加深而增加,在复水后含量减少。重度干旱胁迫的可溶性糖、可溶性蛋白、游离脯氨酸含量均为最高,分别为2.54%、106.95 mg/g、488.89 μg/g,复水后的含量均在对照与胁迫处理之间,还没有恢复到胁迫前的水平。
2.3 干旱胁迫及复水对朱槿抗氧化酶(POD、SOD)活性和丙二醛(MDA)含量的影响
SOD、POD 是极重要的抗氧化酶,丙二醛是反映植物在逆境环境下所受伤害程度的一个积累量[17]。
由表3可知,干旱胁迫对朱槿叶片抗氧化酶、丙二醛的影响极显著(P<0.01),抗氧化酶活性和丙二醛含量都随胁迫水平的加深而增加,在复水后明显接近于对照组。胁迫引起植物的抗氧化酶、丙二醛含量明显变化,在重度干旱胁迫下的影响尤其明显,POD活性为25.72ΔA470/(min·g),SOD活性为429.41 U/g,丙二醛含量为45.19 μmol/g,都明显高于对照组,复水处理含量接近于对照组但仍高于对照组。
2.4 干旱胁迫及复水对朱槿生理指标影响的相关性分析
由表4可知,综合各项生理指标相关性分析表明,生理指标之间的变化相关性较为显著。叶绿素随干旱胁迫的程度加深而减少,复水后有所增加,与可溶性糖、可溶性蛋白、丙二醛、游离脯氨酸、POD、SOD的变化呈现相反规律,在相关性分析中,叶绿素含量与可溶性糖、游离脯氨酸、POD有显著的负相关性,与可溶性蛋白、丙二醛、SOD存在极显著正相关性。叶绿素含量与可溶性糖、丙二醛有显著的负相关性。朱槿可溶性糖与可溶性蛋白之间有显著的相关性,丙二醛、游离脯氨酸、POD、SOD之间存在极显著相关性。这些相关性的变化显示水分对各项生理指标影响的变化存在明显的规律性,水分变化是影响朱槿生理指标变化的主要因素。
3 讨论与结论
3.1 讨论
在城市园林绿地中,植物常常会受到干旱胁迫的影响。在受到干旱胁迫后,植物体内的水分减少,影响植物体内生命循环,生长过程减缓;在干旱持续或加重的情况下,为减少水分的损失和提高水分利用效率,植物通過调节各项生理指标使其长期处于一个生长的平衡状态,并形成了独特的调节机制。
在朱槿的干旱胁迫中,叶绿素含量随含水量的降低而减少,在复水后有所恢复。由此推测,朱槿通过减少叶绿素含量控制植物对光照的吸收,从而降低朱槿的光合作用和蒸腾作用,缓解植物体内水分的亏缺,也减少水分消耗。由于叶绿体是产生活性氧(ROS)的主要细胞器,干旱胁迫抑制了朱槿叶片的碳同化,使得细胞中的能量过剩,加剧了叶绿体氧化胁迫,引起丙二醛和电解质渗漏,导致膜脂质过氧化损伤,使得代谢相关酶失活,损伤DNA,产生氧化伤害[18]。为了缓解干旱胁迫,朱槿启动自身的应激反应,引起一系列渗透调节物质、抗氧化酶(POD、SOD等)的变化。
干旱胁迫中,朱槿幼苗叶片内积累更多的可溶性糖、可溶性蛋白、游离脯氨酸等渗透调节物质,在复水后渗透调节物质含量逐渐恢复正常水平。可溶性糖等碳水化合物代谢具有瞬时敏感性,在植物干旱的脱水过程中,可溶性糖作为渗透保护剂可以保护植物细胞膜,并保持细胞膨压,可溶性蛋白含量的增加提高了细胞的保水能力,与可溶性糖调控植物的生长发育,响应逆境胁迫,其含量与大多数植物的耐旱性呈正相关[19]。游离脯氨酸能促进蛋白质水合作用,可作为蛋白质和细胞膜的稳定剂,使植物处于干旱环境时具有一定的抗性。这些渗透调节物质都可减轻渗透胁迫、增强保水能力、防止膜质和蛋白质的过氧化作用等[20]。
丙二醛是植物膜脂受活性氧作用下过氧化物的最终分解产物,会对植物的生理活性造成毒害,朱槿在受到胁迫时,丙二醛大量积累,其含量越多表示植物损伤越严重。在朱槿的干旱胁迫试验中,随着干旱胁迫程度增加,SOD、POD等抗氧化酶的活性增强,在复水后活性下降。相关研究表明,SOD可通过一系列反应清除植物体内多余的超氧根阴离子,POD可在干旱胁迫中清除H2O2,它们都是保护酶体系中的关键酶[16]。干旱胁迫期间它们可以清除植物体内具有潜在危害的H2O2,从而最大限度地减少·OH的形成,使自由基维持在一个低水平,从而保护细胞膜的结构功能,缓解逆境胁迫对植物的损伤,两者活性变化能够较好地反映植物对土壤水分变化的适应能力[21]。
3.2 结论
该研究结果表明,朱槿的自身调节能力较好,在胁迫中维持较高水平的抗氧化酶活性,从而使植株具有较强的氧化还原能力,对干旱环境适应能力较强;复水处理的植物先受到土壤干旱胁迫,在复水后胁迫趋于缓解,植物体内酶、渗透调节物质逐渐恢复到胁迫前水平,但各生理指标含量仍低于对照组,说明干旱对植物体造成了一定的伤害,并且伤害还没有完全消除[22]。
参考文献
[1]熊秉红,赖玉林,刘春艳,等.朱槿花卉优良品种的选育[J].现代农村科技,2016(22):43-44.
[2]李瑞姣,陈献志,岳春雷,等.干旱胁迫对日本荚蒾幼苗光合生理特性的影响[J].生态学报,2018,38(6):2041-2047.
[3]王帆,何奇瑾,周广胜.夏玉米三叶期持续干旱下不同叶位叶片含水量变化及其与光合作用的关系[J].生态学报,2019,39(1):254-264.
[4]张佳丽,关兴良,陈超.干旱、半干旱地区城市园林绿化的探索与思考[J].城市发展研究,2014,21(2):17-20.
[5]谌振,杨光穗,张东雪,等.基质与植物生长调节剂对4个朱槿品种扦插繁殖的影响[J].热带作物学报,2018,39(1):13-19.
[6]张福平,范金笋.朱槿扦插试验研究[J].北方园艺,2007(12):175-177.
[7]易双双,谭春丽,杨光穗,等.朱槿不同品种花粉生活力的测定[J].分子植物育种,2016,14(10):2837-2843.
[8]李玉萍,罗凤霞,王嘉敏.朱槿品种分类与花粉活力初探[J].江苏农业科学,2015,43(9):202-204.
[9]玉舒中,吕文玲,杨振德,等.紫外光胁迫对二种朱槿生理生化指标的影响[J].北方园艺,2010(18):106-109.
[10]HSIAO T C.Plant responses to water stress[J].Annual review of plant physiology,1973,24(1):519-570.
[11]黎裕.作物抗旱鉴定方法与指标[J].干旱地区农业研究,1993,11(1):91-99.
[12]杨敏文.快速测定植物叶片叶绿素含量方法的探讨[J].光谱实验室,2002,19(4):478-481.
[13]郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:67-68.
[14]蔡永萍.植物生理学实验指导[M].北京:中国农业大学出版社,2014:170-172.
[15]陈建勋,王晓峰.植物生理学实验指导[M].广州:华南理工大学出版社,2006:66-67.
[16]LECKIE B M,STEWART C N.Agroinfiltration as a technique for rapid assays for evaluating candidate insect resistance transgenes in plants[J].Plant cell reports,2011,30(3):325-334.
[17]GRATANI L,VARONE L.Leaf key traits of Erica arborea L.,Erica multiflora L.and Rosmarinus officinalis L.cooccurring in the Mediterranean maquis[J].Flora,2004,199(1):58-69.
[18]羅海婧,张永清,石艳华,等.不同红小豆品种幼苗对干旱胁迫的生理响应[J].植物科学学报,2014,32(5):493-501.
[19]严琳玲,张瑜,白昌军.蝴蝶豆属种质苗期抗旱性鉴定研究[J].广东农业科学,2015,42(24):66-73.
[20]张文婷,王子邦.6种常见彩叶灌木对干旱胁迫的生理响应[J].江苏农业科学,2018,46(8):123-126.
[21]赵丽英,邓西平,山仑.活性氧清除系统对干旱胁迫的响应机制[J].西北植物学报,2005,25(2):413-418.
[22]罗青红,宁虎森,何苗,等.5种沙地灌木对干旱胁迫的生理生态响应[J].林业科学,2017,53(11):29-42.
