白藜芦醇激活Notch1/Hes1信号减轻大鼠川崎病诱发心肌损伤的机制
2020-12-11熊凤梅孔令恒石曌玲
熊凤梅,孔令恒,孙 娜,丁 辉,石曌玲
川崎病(Kawasaki disease, KD),又被称为皮肤黏膜淋巴结综合征,是一种常见于5岁以下婴幼儿,以全身非特异性中、小动脉血管炎性反应为主要病理特点的急性发热性、出疹性疾病,病因不明,易侵害冠状动脉进而引起冠状动脉扩张和冠状动脉瘤,严重危害患儿的心脏功能[1-3]。流行病学结果显示,KD发病率逐年升高,并且已经取代风湿热成为婴幼儿获得性心脏病的主要原因之一[4]。部分KD患儿还会出现血栓栓塞、心肌炎或心肌梗死[5,6],加之KD继发的心肌损伤的病因和具体机制未完全阐明,这使得临床上至今还未有针对KD诱发心肌损伤的有效治疗方法。因此,有必要探讨KD诱发心肌损伤的机制并寻找有效的治疗药物和潜在的治疗靶点,为临床上治疗KD心肌损伤提供理论依据。
白藜芦醇(resveratrol, Res)是一种存在于葡萄、桑葚、花生和多种中药材中的多酚类化合物,化学结构式为3,5,4′-三羟基二苯乙烯,由于其具有明显的抗肿瘤、抑制炎性反应、抗动脉粥样硬化等生物学活性及心血管保护作用,受到了广泛关注[7-10]。Notch信号通路是一类进化高度保守的跨膜受体家族,由配体、受体和下游分子组成,在胚胎期和成年后细胞稳态以及组织损伤修复中发挥重要作用,该通路的活化还参与炎性反应和氧化应激过程[11-13]。有研究表明,Notch1可减轻心肌缺血损伤,改善心肌梗死后心脏功能,并在梗死区修复中发挥重要作用[14]。然而Notch信号通路是否在KD诱发的心肌损伤中有变化,是否介导Res改善KD诱发心肌损伤的作用还不清楚。因此,本研究拟采用幼年雄性SD大鼠KD模型,即腹腔注射干酪乳酸杆菌胞壁成分(lactobacillus casei cell wall extract, LCWE)制备KD,并探讨Res对KD诱发心肌损伤的保护作用以及对Notch信号通路的调控,为阐明KD诱发心肌损伤的机制提供新的实验依据。
1 材料和方法
1.1 材料 幼年雄性SD大鼠(4周龄)48只,体重80~100 g,购买于西安交通大学医学院实验动物中心。Bax、Bcl2、Notch1和Hes1抗体均购买于Cell Signaling Technology公司,GAPDH购于谷歌生物科技有限公司(武汉);TNF-α和IL-1β含量检测试剂盒购买于碧云天生物技术公司;RIPA裂解液购于碧云天生物技术有限公司(上海);蛋白酶抑制剂购买于Roche公司;BCA蛋白定量试剂盒购于Thermo Fisher公司;Res购于Sigma公司(上海);干酪乳酸杆菌(Lactobacillus case)购于工业微生物菌种保藏中心;乳酸杆菌肉汤培养基和鼠李糖定量试剂盒购于上海广锐生物科技有限公司。
1.2 制备KD模型 首先培养干酪乳酸杆菌,采用文献[15]报道的方法:将购买的干酪乳酸杆菌菌种接种于肉汤培养基中,并在37 ℃厌氧环境中培养2 d;将培养基以5000 g离心20 min,弃上清,沉淀中加入40 g/L SDS过夜以充分裂解。以5000 g离心裂解液30 min,PBS洗涤后,加入RNA酶(250 μg/ml)混匀,37 ℃孵育4 h,离心弃上清,重复3次。再加入DNA酶(250 μg/ml)混匀,37 ℃孵育4 h,离心弃上清,重复3次。最后沉淀中加入胰蛋白酶(250 μg/ml),37 ℃孵育4 h,离心弃上清,重复3次。用PBS将沉淀重悬,超声破碎仪冰上破碎2 h,低温高速离心机4 ℃ 12 000 g离心1 h,上清即为LCWE。采用比色法定量,并将LCWE终浓度稀释为1 mg/ml。
1.3 实验分组 幼年雄性SD大鼠(4周龄)48只,随机分为对照组、Res对照组(Res组)、KD模型组(KD组)和Res处理KD组(Res+KD组);其中,对照组大鼠仅腹腔注射0.5 ml生理盐水,Res组仅腹腔注射Res(100 mg/kg),KD组大鼠腹腔注射0.5 ml LCWE(1 mg/ml),Res+KD组大鼠腹腔注射0.5 ml LCWE(1 mg/ml)和Res(100 mg/kg)。每天监测大鼠的生存状况,包括体重、饮水、饮食和活动状况等。在造模后28 d结束实验取材,并检测相关指标。
1.4 小动物超声检测各组心脏功能 4%异氟烷麻醉大鼠,并将大鼠仰卧位固定在Visual Sonics Vevo 2100小动物超声仪加热板上,将恒温加热板温度设定为37 ℃。将左胸前被毛脱去后开始检测。用探头置于大鼠左胸前,在乳头肌水平位置用M型取样线监测心率,测量收缩期左室内径、舒张期左室内径等指标,并经计算得到左室射血分数(left ventricular ejection fraction, LVEF)和左室短轴缩短率(left ventricular fractional shortening, LVFS)。
1.5 HE染色 实验结束后,将各组大鼠心脏取下放入PBS中清洗,再固定于4%多聚甲醛中过夜,采用常规脱水复蜡方法进行石蜡包埋,并切成3 μm厚的薄片,然后行常规HE染色步骤,光镜下观察各组心脏形态结构。
1.6 心肌组织TNF-α和IL-1β含量检测 各组均称取50 mg的心肌组织并放入离心管中,加入1 ml预冷的PBS,用眼科剪将心肌组织剪成小块,低温高速离心机4 ℃ 3000 g离心5 min,弃上清,沉淀中加入RIPA裂解液(质量/体积比1∶5)和蛋白酶抑制剂,在冰上将心肌组织充分研磨并裂解30 min,低温高速离心机4 ℃ 12 000 g离心30 min,吸取上清,弃沉淀。按照TNF-α含量检测说明书,采用分光光度计在450 nm处测量吸光值并根据说明书绘制标准曲线计算各组心肌组织中TNF-α含量;按照IL-1β含量检测说明书,在450 nm处检测吸光值并根据标准曲线计算各组心肌组织中IL-1β含量。
1.7 Western blot检测蛋白表达 实验结束后,各组称取50 mg重量的心肌组织并放入离心管中,加入1 ml预冷的PBS,用眼科剪将心肌组织剪成小块,低温高速离心机4 ℃ 3000 g离心5 min,弃上清,沉淀中加入RIPA裂解液(质量/体积比1∶4)和蛋白酶抑制剂,在冰上将心肌组织充分研磨并裂解30 min,低温高速离心机4 ℃ 12 000 g离心30 min,吸取上清,弃沉淀;采用BCA法进行蛋白定量,采用常规电泳和湿转法将蛋白转移至PVDF膜,并用5%脱脂奶粉室温下封闭1.5 h,将条带放入相应的Bax抗体(1∶1000)、Bcl2抗体(1∶1000)、Notch1抗体(1∶1000)、Hes1抗体(1∶1000)和GAPDH抗体(1∶5000)中,摇床4 ℃过夜孵育;TBST洗膜5次,6 min/次,将条带放入山羊抗兔或山羊抗鼠二抗(1∶5000)室温摇床孵育1 h,TBST洗膜5次,6 min/次,用ECL显色液避光检测,Image Lab统计灰度值。
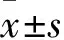
2 结 果
2.1 Res改善KD诱发的心脏功能障碍 超声结果显示,和对照组比较,Res组大鼠心脏功能没有明显变化;和对照组比较,KD组大鼠心脏LVEF和LVFS显著降低(P<0.05);而和KD组比较,Res+KD组大鼠心脏LVEF和LVFS明显升高(P<0.05,图1和表1)。

图1 各组大鼠心脏超声原始图

表1 各组川崎病大鼠诱发心脏LVEF和LVFS的比较
2.2 Res减轻KD诱发的心肌细胞凋亡 Western blot和TUNEL染色结果显示,和对照组比较,Res组大鼠心肌细胞凋亡数量和凋亡相关蛋白表达无明显变化;和对照组比较,KD组大鼠心肌细胞凋亡数量和Bax蛋白表达增加,Bcl2蛋白表达减少(P<0.05);而和KD组比较,Res+KD组大鼠心肌细胞凋亡数量和Bax蛋白表达降低,Bcl2蛋白表达增加(P<0.05,图2,表2和图3)。

图2 各组川崎病大鼠诱发心肌损伤Bcl2和Bax蛋白表达的western blot结果

表2 各组川崎病大鼠心肌组织Bcl2和Bax蛋白表达的比较

图3 各组川崎病大鼠心脏TUNEL染色结果
2.3 Res减轻KD引起的心肌组织炎性反应 HE染色和ELISA结果显示,对照组和Res组大鼠心肌纤维排列整齐,心肌组织中TNF-α和IL-1β含量无明显差异;和对照组比较,KD组心肌纤维排列紊乱,并出现部分断裂,心肌组织中TNF-α和IL-1β含量显著增加(P<0.05);而和KD组比较,Res+KD组心肌纤维排列改善,断裂减轻,心肌组织中TNF-α和IL-1β含量明显降低(P<0.05,图4和表3)。

图4 各组川崎病大鼠心脏HE染色结果(200×)

表3 各组川崎病大鼠心肌组织Bcl2和Bax蛋白表达的比较
2.4 Res激活KD心肌组织中Notch1/Hes1信号 Western blot结果发现,和对照组比较,Res组大鼠心肌组织中Notch1和Hes1蛋白表达没有明显差异;和对照组比较,KD组心肌组织中Notch1和Hes1蛋白表达明显降低(P<0.05);和KD组比较,Res+KD组心肌组织中Notch1和Hes1蛋白表达显著升高(P<0.05,图5和表4)。

图5 各组川崎病大鼠诱发心肌损伤Notch1和Hes1蛋白表达的western blot结果

表4 各组川崎病大鼠心肌组织Notch1和Hes1蛋白表达的比较
3 讨 论
川崎病已经成为婴幼儿获得性心脏病的主要原因之一,作为一种急性、发热性和出疹性疾病,由于病因和机制不明,使其成为临床诊断和治疗的难点。KD主要以非特异性血管炎为病理特征,对冠状动脉的侵害尤为严重,对患儿心血管系统直接或间接的损害是KD引发损伤甚至导致死亡的重要原因[16]。为了进一步阐明KD的发病机制,为临床治疗寻找潜在的药物和可能的治疗靶点,本研究利用LCWE制备幼年雄性SD大鼠KD模型,观察了Res对KD诱发心肌损伤的保护作用和机制,证明Res可通过激活Notch1/Hes1信号,减轻心肌细胞凋亡和心肌炎性反应发挥保护KD心肌损伤的作用。
幼年雄性SD大鼠腹腔注射LCWE制备的KD模型,是目前实验室比较常用的动物模型,为阐明KD病因及其对心血管损伤的分子机制提供了重要手段[15]。本研究发现,KD组大鼠心脏LVEF和LVFS明显降低,同时,心肌组织Bcl2蛋白表达降低,Bax蛋白表达升高,心肌细胞凋亡指数明显增加,心肌组织炎性分子TNF-α和IL-1β含量显著增加,这些结果说明,KD组大鼠心脏功能障碍,心肌细胞凋亡和炎性反应明显增加。
Res是从多种天然植物中提取的多酚类化合物,在抗衰老、降脂、抗氧化、抗癌、抗炎性反应和改善心血管疾病等方面均具有生物学活性,尤其是在心血管保护方面受到了广泛关注。有研究表明,Res能改善血管内皮功能紊乱,抑制TNF-α诱导的NF-κB核转位,减轻细胞炎性反应[17]。同时,Res还能通过调控NF-κB、Sirt1、Nrf2或AMPK等分子在心肌梗死、缺血/再灌注损伤和心力衰竭等疾病的进展过程中发挥保护作用[18,19]。本研究在成功制备KD模型的基础上,又进一步观察了Res对KD诱发心肌损伤的保护作用。结果发现,Res处理KD组大鼠心脏LVEF和LVFS得到改善,心肌组织Bcl2蛋白表达升高,Bax蛋白表达和心肌细胞凋亡指数也明显降低,同时,心肌组织炎性分子TNF-α和IL-1β含量明显降低,这些结果说明,Res可以改善KD组大鼠心脏功能障碍,并减轻KD诱导的心肌细胞凋亡和炎性反应。
Notch1/Hes1信号在组织器官发育、细胞增殖、分化和修复中发挥重要作用,而Hes1是Notch信号下游重要的靶基因[11]。越来越多的研究表明,Notch1/Hes1信号在心血管疾病中扮演重要的角色[12,20]。因而,我们又观察了Notch1/Hes1信号在Res改善KD诱发心肌损伤中的作用。结果发现,KD组心肌组织中Notch1和Hes1蛋白表达均显著降低,而给予Res处理后,可明显上调Notch1和Hes1蛋白表达。这些结果说明,Res能够激活KD引起的Notch1/Hes1信号抑制发挥心肌保护作用。
总之,本研究进一步明确了Res在KD诱发心肌损伤中发挥保护作用,其作用与Res减轻KD导致的心肌细胞凋亡和降低心肌组织炎性反应有关,而Res发挥保护作用的机制可能与激活Notch1/Hes1信号有关。这为临床上预防和治疗KD诱发的心肌损伤提供了新的实验依据和策略。
