一种高效提取干燥植物样品DNA的方法
2020-12-09任梦云陈彦君王建军王美兴黄益峰杜龙岗关潇
任梦云 陈彦君 王建军 王美兴 黄益峰 杜龙岗 关潇
摘要:野外采集样品通常采用硅胶干燥的方法,但会不同程度降解DNA影响提取效果。为解决干燥植物样品DNA难提取的问题,提出CTAB法与全式金植物基因组DNA提取试剂盒相结合的方法,并以4种中药材为试验材料,利用改良CTAB法、传统CTAB法及试剂盒法等进行鉴定,并用PCR扩增和酶切验证检测提取DNA的质量。结果表明,CTAB法与全式金植物基因组DNA提取试剂盒相结合的方法能够有效去除多酚和糖类物质对DNA提取的干扰,并有效富集DNA,尤其适用于临近干燥或枯萎的植物干燥叶片,PCR扩增和酶切反应进一步证明利用该方法提取DNA能够达到下游试验的要求。本研究有效解决了传统方法提取干燥样品DNA低效的问题,能为接下来分子标记的开发、遗传多样性和后续遗传学分析提供基础。
关键词:干燥植物;DNA提取方法;DNA产率;琼脂糖凝胶;电泳;PCR扩增;酶切试验
中图分类号:Q94-34+1;S184 文献标志码: A
文章编号:1002-1302(2020)19-0048-04
收稿日期:2019-10-08
基金项目:浙江省农业(粮食)新品种选育重大科技专项(编号:2016C02050-9-2)。
作者简介:任梦云(1991—),女,安徽淮北人,博士,助理研究员,从事分子生物学研究。E-mail:916103207@qq.com。
通信作者:关 潇,博士,高级工程师,从事转基因作物风险评估工作,E-mail:cynthia815@126.com;杜龙岗,硕士,副研究员,从事鲜食玉米新品种选育及相关耕作制度研究,E-mail:dlg138@163.com。
从植物组织中提取高质量的基因组DNA是进行分子生物学研究的第1步和必要条件[1]。高质量的基因组DNA是进行如简单重复序列标记(SSR)、限制性内切酶片段长度多态性(RFLP)、随机扩增多态性DNA标记(RAPD)、简单重复序列间扩增(ISSR)等后续遗传多样性分析的基础[2]。迄今为止,人们提出了诸多提取DNA的方法,目前最常用的提取方法是十二烷基苯磺酸钠(SDS)法、十六烷基三甲基溴化铵(CTAB)法[3]。远距离采样一般无法对材料即刻提取DNA,通常采用硅胶脱水干燥保存。然而有研究表明,从硅胶保存的植物样品中提取的基因组DNA会出现不同程度的降解现象,而且DNA的质量和浓度不及从新鲜样品中提取到的DNA[4]。尤其枯萎的植物样品中DNA易被核酸内源酶降解,硅胶干燥后DNA降解程度更加严重,造成DNA提取质量下降[5]。因此,亟待开发一种能够适用于临近枯萎植物干燥样品的基因组DNA提取通用方法以适应研究要求。
本研究以山莨菪(Anisodus tanguticus)、桃儿七(Sinopodophyllum hexandrum)、四数獐牙菜(Swertia tetraptera)、椭圆叶花锚(Halenia elliptica)4种中草药为材料,分别从紫外吸光度、凝胶电泳、PCR扩增、酶切验证等方面对传统CTAB法、改良CTAB法和试剂盒法3种DNA基因组的提取方法进行比较,以期寻找能提取干燥样品较好质量DNA的方法。
1 材料与方法
1.1 材料
山莨菪、桃儿七、四数獐牙菜、椭圆叶花锚分别来源于甘肃省门源县、碌曲县神山山、临潭县贡巴寺和贡巴寺,样本均于2016年9月采集。
本研究中的改良CTAB法裂解缓冲液与常规配方相同,具体如下:CTAB 20 mg/mL,NaCl 1.4 mol/L,二胺四乙酸(EDTA)0.01 mol/L,三羟甲基氨基甲烷(Tris)0.1 mol/L,调节pH值至8.0。
1.2 DNA提取
分别采用传统CTAB法、北京全式金生物技术有限公司提供的DNA提取试剂盒(目录号为EE111)法(简称试剂盒法)以及改良CTAB法(即利用传统CTAB法与试剂盒法相结合的方法)提取4种植物的基因组DNA。改良CTAB法中所述的EB、BB1、CB1、WB1、RnaseA均来自北京全式金生物技术有限公司提供的DNA提取试剂盒(目录号为EE111),根据该试剂盒说明书的记载,EB、BB1、CB1、WB1分别为溶解液、结合液1、清洗液1、洗液1。
取90 mg干燥植物材料,粉碎,分装,分别用上述3种方法提取DNA,DNA提取试剂盒的方法严格按照操作说明进行。改良CTAB法步骤:(1)称取30 mg干燥植物干材料,粉碎(如前所述);(2)加入已预热CTAB裂解缓冲液和一定体积的RnaseA,涡旋振荡,于65 ℃下水浴30~50 min,每隔5 min上下颠倒混匀;(3)转移上清至干净的离心管中,加入等体积的三氯甲烷-异戊醇(体积比为24 ∶1,下同),颠倒混匀,15 ℃,12 000 r/min,离心10 min,取上清;(4)转移上清至干净的离心管中,加入上清液2/3体积的预冷至-20 ℃的异丙醇,轻颠倒混匀,于-20 ℃下静置30 min;(5)静置液于15 ℃、12 000 r/min条件下离心10 min,倒掉上清,在离心管中加入400 μL EB溶液溶解沉淀,同时加入 400 μL 的三氯甲烷-异戊醇混合液,上下颠倒混匀,于15 ℃、12 000 r/min條件下离心 10 min,取上清;(6)转移上清至干净的离心管中,加入等体积的BB1,颠倒混匀,将混合液转移至干净的离心柱中,于15 ℃、12 000 r/min条件下离心 5 min;(7)弃液体,加入500 μL CB1,静置5 min,于15 ℃、12 000 r/min 条件下离心5 min;(8)弃液体,加入500 μL WB1,于15 ℃、12 000 r/min条件下离心 5 min,重复本步骤至少1次;(9)弃液体,于15 ℃、12 000 r/min条件下离心5 min,彻底去除残留的WB1;(10)弃离心管,将离心柱放置在干净滤纸上风干5 min;(11)将离心柱转移到干净的离心管中,向离心柱中心膜上加入40 μL预热至60~70 ℃的EB,静置2 min,于15 ℃、12 000 r/min条件下离心 2 min,重复本步骤至少1次;(12)弃离心柱,收集所得离心液,即得植物基因组DNA;(13)测定DNA的浓度和纯度,-20 ℃保存。
1.3 DNA产率和质量检测
1.3.1 琼脂糖凝胶电泳检测
比较不同方法提取DNA的得率,琼脂糖凝胶电泳时每个样品上样3 μL DNA溶液。配制1%琼脂糖凝胶,电泳液为1×TBE缓冲液[生工生物工程(上海)股份有限公司],GoldView(北京赛百盛基因技术有限公司)染色,于100 V条件下电泳30 min。利用UPV紫外成像系统(EC3 system,美国)扫描成像。
1.3.2 分光光度计检测
采用紫外分光光度计(Merinton,SMA4000)分别测量DNA溶液在230、260、280 nm处的吸光度。通过计算D260 nm/D280 nm和D230 nm/D260 nm的值分别获得DNA溶液中蛋白、多糖、酚类的含量以及RNA的污染度,从而估算DNA浓度,公式为DNA样品浓度(μg/μL)=D260 nm×稀释倍数×50。
1.3.3 PCR检测
通过PCR(德国Biometra公司)反应验证改良CTAB法所获得的DNA的质量,25 μL PCR反应体系包含12.5 μL 2×Taq PCR Master Mix、上下游引物各0.5 μL、2 μL基因组DNA(浓度约为40 ng/μL)、9.5 μL ddH2O。用于扩增ITS序列的1对通用引物的序列为ITS1(5′-AGAAGTCGTAACAAGGTTTC-3′)、ITS4(5′-TCCTCCGCTTATTTATATGC-3′)[6]。PCR反应程序:95 ℃预变性5 min;95 ℃变性30 s,52 ℃退火45 s,72 ℃延伸1 min 40 s,35个循环;72 ℃终延伸10 min,16 ℃,停止反应。
1.3.4 酶切验证
20 μL酶切体系包括:5 μL DNA模板(200 ng/μL),2 μL 10×FlyCutTM Buffer,0.5 μL EcoRⅠ酶(20 U/μL),12.5 μL ddH2O。PCR程序为37 ℃ 10 min,65 ℃ 20 min。
2 结果与分析
2.1 DNA得率和质量
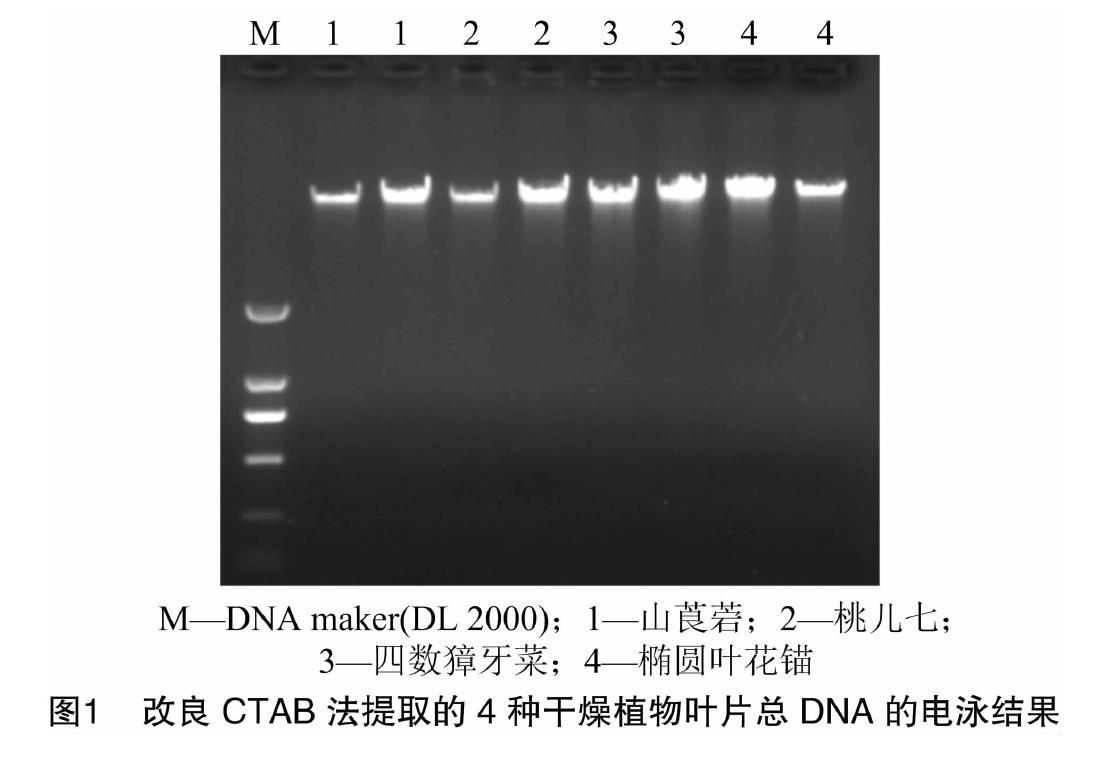
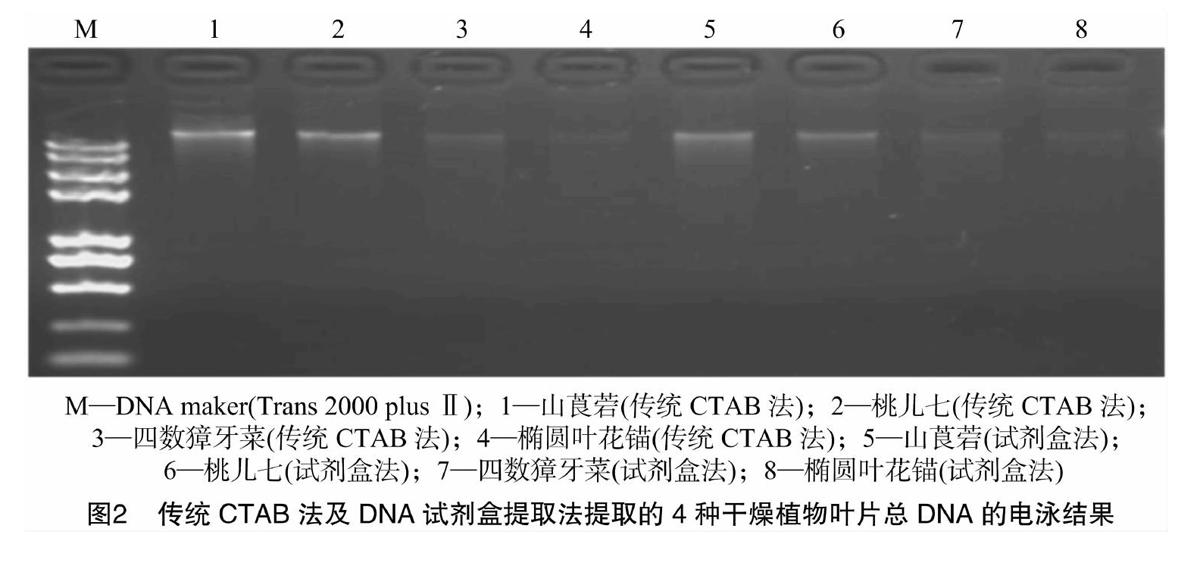
用3种不同的方法提取样品基因组DNA,琼脂糖凝胶电泳结果如图1、图2所示,DNA条带清晰,无明显降解拖尾现象,尤其改良CTAB法提取的DNA条带清晰、明亮(图1)。
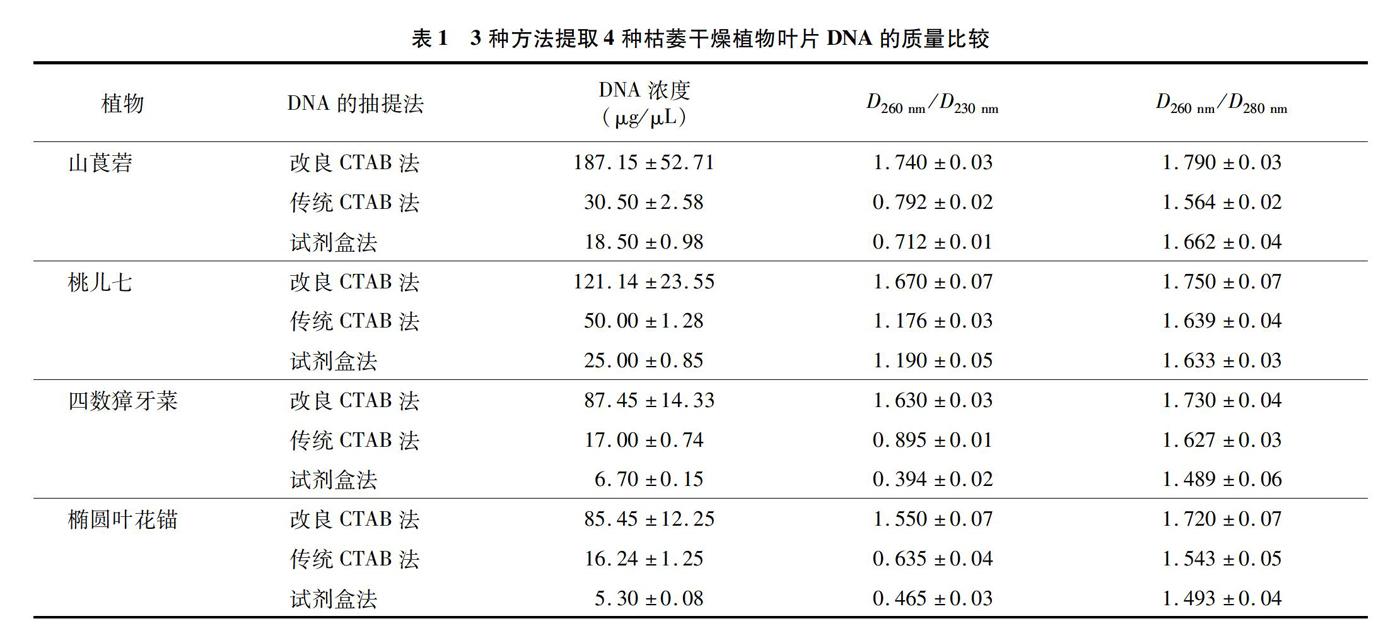
根据D260 nm/D280 nm的检测值(表1)发现,改良CTAB法提取的DNA质量较好,传统CTAB法和试剂盒法略差(D260 nm/D280 nm<1.7),说明这2种方法抽提的DNA中可能含有蛋白质杂质。改良CTAB法提取的DNA的濃度明显高于其他2种提取方法,除山莨菪试剂盒法提取的DNA浓度最低。
2.2 PCR验证和酶切试验
DNA的提取是分子生物学研究中至关重要的第1步,因此DNA提取方法的适用性还需要下游试验的验证。本研究通过PCR和酶切进一步验证该提取方法所获得的DNA的质量。
利用ITS引物以本研究提取获得的上述4种植物基因组DNA为模板,进行PCR扩增,结果见图3。
4个样品中都扩增出了清晰的目的条带。PCR试验结果证明,改良CTAB提取法获得的植物基因组DNA符合下游试验的要求。
EcoRⅠ限制性内切酶酶切电泳结果如图4所示,酶切获得的条带在凝胶上呈均匀的弥散状分布,这表明改良CTAB法的DNA纯度良好,符合酶切试验及下游试验的要求。
3 讨论与结论
在正常条件下,传统CTAB法以及试剂盒法都可以用于植物基因组DNA的抽提,但是如果从DNA的浓度、纯度和质量上综合考虑来说,本试验改良CTAB法提取干燥样本植物基因组DNA效率最好。在实际工作中,仍然须要根据植物本身的特性和不同的试验要求来选择合适的提取方法[7-8]。
目前最好的植物基因组DNA提取材料是鲜样或者是-80 ℃冻存保留的样本材料[9-13]。但是当采样地位于野外时,野外采样一般无法对材料即刻提取DNA,通常采用硅胶干燥,而经过硅胶干燥保存的植物样品的基因组DNA会发生不同程度的降解,提取的DNA质量和浓度远比从鲜样中提取的差。尤其枯萎的植物样品中DNA易被核酸内源酶降解,硅胶干燥后DNA降解程度更加严重,提取质量下降。因此,针对长期远距离采样难保存样品的问题,应寻找一种新的、简便经济实用的干燥样本DNA提取方法。
本研究利用全式金基因组DNA提取试剂盒所改良的CTAB法,能够有效去除多酚和糖类物质对DNA提取的干扰,尤其适应于临近干燥或枯萎的植物干燥叶片,能够有效地富集DNA,并消除颜色对DNA的影响。PCR试验结果证明,改良CTAB法获得的DNA能够达到下游试验的要求。与现有技术相比,该方法具有以下优点:(1)利用该方法从干燥植物样品组织中获得的DNA量显著高于普通提取方法获得的DNA,且DNA纯度符合下游应用的要求。(2)经PCR和酶切试验证明最终获得的DNA能够达到一般分子生物学研究的要求。(3)该提取方法具有通用、高效和简便的特点。从表1和图4可以看出,传统CTAB法以及试剂盒法均不能从上述样品中成功提取出DNA,紫外分光光度计检测结果表明提取获得的DNA纯度较差,不符合下游试验要求。本研究的改良CTAB法适合干燥样本,干燥样本操作方便,不受太多地理及环境因素的限定,适用于远距离样品的采集。
参考文献:
[1]陈宗礼,陈昱宇,王睿婷,等. 组培枣苗基因组DNA提取方法及其含量的比较[J]. 基因组学与应用生物学,2011,30(1):110-116.
[2]李金璐,王 硕,于 婧,等. 一种改良的植物DNA提取方法[J]. 植物学报,2013,48(1):72-78.
[3]Murray M G,Thompson W F.Rapid isolation of high molecular weight plant DNA[J]. Nucleic Acids Research,1980,8(19):4321-4325.
[4]梁紅艳,付梦瑶,杨果果,等. 不同保存方法对柽柳基因组总DNA产量和质量的影响[J]. 基因组学与应用生物学,2016,35(8):2168-2172.
[5]Stange C,Prehn D,Arce-Johnson P.Isolation of pinus radiata genomic DNA suitable for RAPD analysis[J]. Plant Molecular Biology Reporter,1998,16(4):366.
[6]王国勋,张明理. 应用核DNA ITS序列探讨广义花楸属(Sorbus L.)属下系统关系[J]. 园艺学报,2011,38(12):2387-2394.
[7]李 萌,李 翔,庞晓明,等. 珍稀树种庙台槭不同组织DNA高效提取方法分析[J]. 分子植物育种,2019,17(4):1228-1237.
[8]Thomson D,Henry R.Use of DNA from dry leaves for PCR and RAPD analysis[J]. Plant Molecular Biology Reporter,1993,11(3):202-206.
[9]谢中稳,葛 颂,洪德元. 从普通野生稻硅胶干燥的小量叶片中制备DNA用于RAPD分析和总DNA库的建立[J]. 植物学报,1999,41(8):807-812.
[10]吴 翼,刘 蕊,郭爱汕,等. 硅胶干燥对棕榈科植物DNA提取效果的影响[J]. 江苏农业科学,2019,47(18):83-86.
[11]Marla M P,Robert P A. In situ preservation of DNA in plant specimens[J]. Taxon,1989,38(4):576-581.
[12]Rogstad S H.Saturated NaCl-CTAB solution as a means of field preservation of leaves for DNA analyses[J]. Taxon,1992,41(4):701-708.
[13]Chase H W,Hills H H.Silica gel:an ideal material for field preservation of leaf samples for DNA studies[J]. Taxon,1991,40(2):215-220.
