免疫检查点抑制剂联合治疗在小细胞肺癌中的研究进展*
2020-12-03廖龙飞杨青青陈燕综述肖洪涛审校
廖龙飞,杨青青,陈燕 综述,肖洪涛审校
610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 临床药学部(廖龙飞、陈燕、肖洪涛);610200成都,国家知识产权局专利局 专利审查协作四川中心(杨青青)
小细胞肺癌(small cell lung cancer,SCLC)是一种来源于支气管上皮细胞的强侵袭性神经内分泌肿瘤,约占所有肺癌总数的15%[1-2]。其特点为最初对放化疗较为敏感,但恶性程度高,易发生转移,大部分患者都会出现复发和耐药,预后极差[3-4]。因此,近30年来对于局限期和广泛期小细胞肺癌(extensive-stage small cell lung cancer,ES-SCLC)的一线治疗方案无重大突破,仍延用依托泊苷联合铂类同步放疗的经典治疗方案,而二线治疗拓扑替康疗效不佳[2,5]。近年来,随着对肿瘤形成机制的深入研究,研究者们发现肿瘤细胞能够促进免疫检查点分子活化来抑制免疫细胞发挥正常功能,以此“躲避捕杀”[6-7]。因此,免疫检查点抑制剂(immune checkpoint inhibitor,ICI)可阻断两者结合以防止肿瘤细胞免疫逃逸,有效延长肿瘤患者的总生存期(overall survival,OS)[8]。ICI的成功给SCLC的治疗模式带来了天翻地覆的变化,但同时ICI单药治疗层出不穷的问题也限制了其疗效进一步的发挥。因此,ICI联合治疗开始逐步成为当前研究主流趋势。研究ICI联用策略和效果将是未来治疗肺癌领域的重点、热点和难点。本文通过对ICI单药或联合治疗SCLC的临床试验进行总结归纳(表1),对现有ICI治疗SCLC的进展、不足以及未来的发展方向进行阐述,以期为临床工作和研究提供帮助。
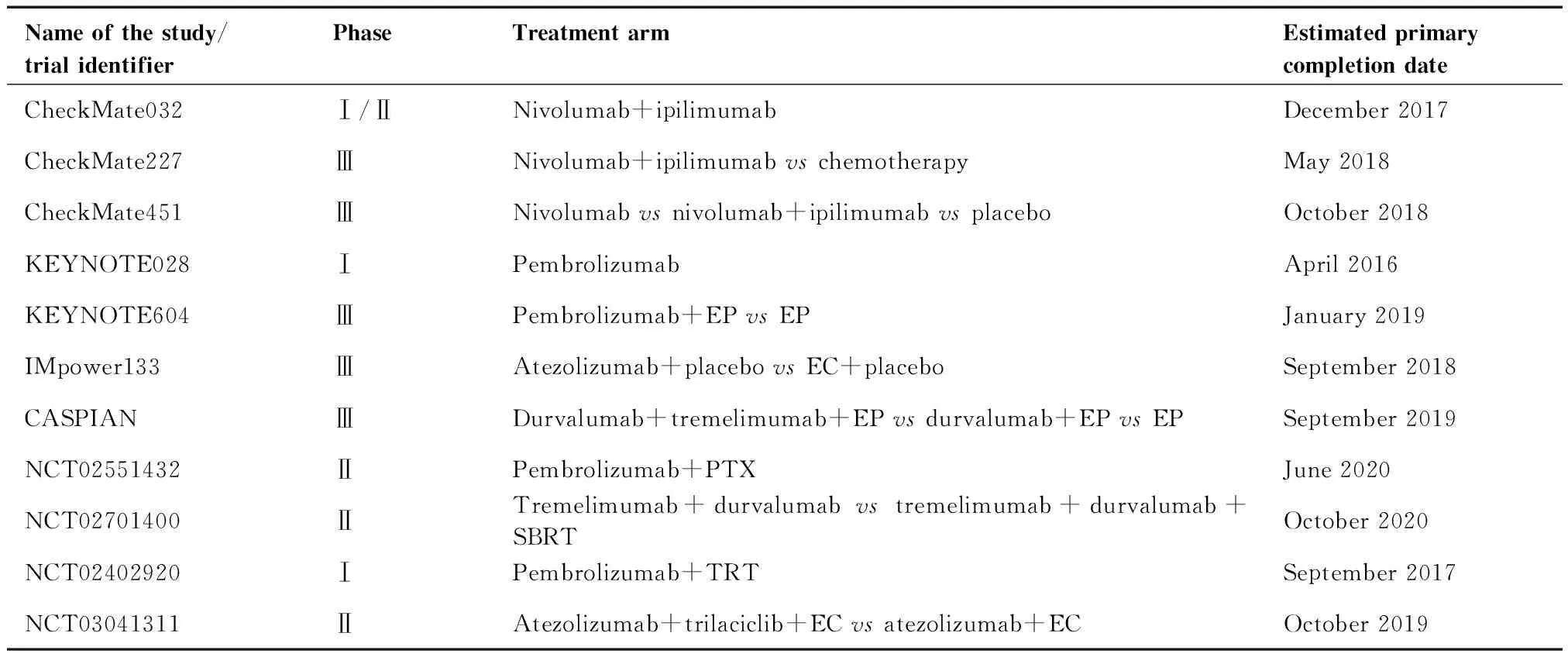
表1 已经完成和正在进行的免疫治疗用于SCLC的临床试验Table 1. Completed and Ongoing Immunotherapy Trials in SCLC
1 ICI单药治疗SCLC 现状
1.1 PD-1抑制剂
程序性死亡受体-1(programmed death-1,PD-1)为表达在活化效应T细胞上的跨膜糖蛋白,其拥有的配体称为程序性死亡配体-1(programmed cell death-Ligand 1,PD-L1)[9]。PD-L1可与活化T细胞表面的PD-1结合抑制T细胞的免疫功能[10]。因此,阻断、干扰PD-1/PD-L1信号通路是重新激活抗肿瘤免疫应答的关键。
纳武利尤单抗(Nivolumab)作为最早被FDA批准上市的PD-1抑制剂,可应用于多种类型癌症。在CheckMate032研究中,Nivolumab单药作为复发SCLC的三线或者更晚期治疗用药具有良好的疗效和耐受性[11]。同样为PD-1抑制剂的帕博利珠单抗(Pembrolizumab)单药在KEYNOTE.028试验中对ES-SCLC癌患者显示出了良好的疗效:客观有效率(objective response rate,ORR)为33%,中位无进展生存期(progression-free survival,PFS)为9.8个月[12],并且Pembrolizumab对PD-Ll阳性表达的SCLC患者治疗效果更佳[13]。
1.2 PD-L1抑制剂
阿特朱单抗(Atezolizumab)和德瓦鲁单抗(Durvalumab)均是针对PD-Ll的人源化单克隆抗体。Atezolizumab[14]单药对SCLC患者显示出了一定的抗肿瘤活性,但经过进一步研究发现Atezolizumab单药作为SCLC患者的二线治疗方案与化疗相比,PFS及OS均无显著性差异[15]。同时,Durvalumab单药以其对SCLC的显著疗效获得了FDA孤儿药资格认定,其与化疗联合治疗ES-SCLC的Ⅲ临床试验“CASPIAN”也在紧锣密鼓地进行中[16]。
1.3 CTLA-4抑制剂
细胞毒T淋巴细胞相关抗原-4(cytotoxic T-lymphocyte-associated antigen-4,CTLA-4)是表达于活化T淋巴细胞表面跨膜蛋白受体,可以与配体相结合在免疫反应的初期影响效应T淋巴细胞的激活与增殖[17]。伊匹单抗(Ipilimumab)和替西木单抗(Tremelimumab)作为CTLA-4抑制剂可以消除肿瘤细胞产生的抑制信息并激活抗肿瘤活性,但两者单药治疗肺癌的表现均不佳[9]。
2 ICI单药在治疗SCLC中的局限性
2.1 不良反应
由ICI引起的独特的不良反应被称为免疫相关不良事件(immune-related adverse events,irAEs),其与常规化疗导致的细胞毒性有非常大的区别:其通常表现形式为患者发生免疫抑制反应,如果及时地发现并进行处理可以逆转其不良反应所造成损伤,但如果失败可能出现严重的不良反应甚至死亡[18]。KEYNOTE028研究显示Pembrolizumab单药治疗SCLC时可加重自身免疫现象。在该试验中,有66.7%患者出现irAEs:关节痛、乏力、皮疹、腹泻、疲劳等[19]。在CheckMate032研中,Nivolumab也有类似的不良反应。而且,CTLA-4抑制剂如Ipilimumab单独使用相比于PD-1抑制剂(如Nivolumab和Pembrolizumab),irAEs的发生率更高。但如果两者联用,irAEs的发生率将保持稳定,不会增高[20]。
2.2 耐药机制
在免疫治疗中,肿瘤细胞由于某种原因逐渐产生可以提前中和或消除针对肿瘤抗原的T细胞的过程,称之为原发性或获得性耐药[21]。其机制与下面几个因素有关:1)免疫原性低的肿瘤细胞对于免疫治疗不敏感;2)某些肿瘤细胞可以破坏树突细胞的成熟与迁移以降低其抗原呈递作用,减少T细胞产生;3)肿瘤细胞内在基因和通路的改变导致了与突变相关抗原的缺失,以此消除ICI对于肿瘤抗原的封锁[22];4)IFN-γ、TGF-β等作为重要的调节因子在肿瘤细胞的耐药性上起到关键作用:IFN-γ信号通路的基因缺陷可以引起对Ipilimumab的耐药[23],导致其在SCLC治疗中效果不佳;TGF-β形成的肿瘤微环境通过限制T细胞浸润来抑制抗肿瘤免疫反应的发生[24]。
2.3 低响应性
临床研究表明,肿瘤突变负荷(tumor mutational burden,TMB)高的肿瘤患者使用PD-1/PD-L1抑制剂治疗效果较为理想,利用TMB作为生物标记有助于精准筛选敏感人群[25]。同理,错配修复缺陷(mismatchrepair,MMR)高的突变型肿瘤对于ICI响应度和敏感度较高,相应的治疗效果也较好;但研究发现TMB/MMR低的肿瘤患者(对ICI的响应度和敏感度较低)占到了绝大多数,接近95%的水平[26]。因此,寻找新的生物标记物和联合治疗方法是扩大治疗受益人群的关键。
3 ICI联合治疗SCLC
3.1 不同类型的ICI联合治疗
肿瘤细胞拥有多个免疫信号通路调节途径,只抑制其中一个可能会导致其它免疫检查点代偿性上调分子表达。这种机制对ICI单药治疗有明显的限制作用。而如果将两种不同类型的ICI联用就可以通过作用于不同的位点来调节T细胞,早期刺激大量特异性T细胞的产生,在晚期可恢复衰竭T细胞的免疫功能,从而实现抗肿瘤的协同作用[27]。
在Ⅱ期临床试验CheckMate032[11,28]中,接受过化疗的216名ES-SCLC患者使用3 mg/kg Nivolumab(3N)单药或1 mg/kg Nivolumab+1 mg/kgIpilimumab(1N+1I);1 mg/kg Nivolumab +3 mg/kgIpilimumab(1N+3I);3 mg/kg Nivolumab +1 mg/kg Ipilimumab(3N+1I)联合治疗。所有组给药4次后均采用3N维持治疗2周。发现其ORR分别为:10%、33%、23%、19%。同时,其3~4级的irAEs发生率分别为:13%、0%、30%、19%。相比于单药组,联合用药组显示出了更高的抗肿瘤活性和安全性。因此,美国国家癌症综合网(National Comprehensive Cancer Network,NCCN)指南推荐Nivolumab+Ipilimumab(N+I)作为治疗复发SCLC患者的二线方案。但同时该研究者也承认试验存在没有随机分组和组间差异大等局限性:1N+1I组为过渡组,主要为了测试实验者对于联合用药的耐受性,该组人数较少,所得数据不具有较强的说服性。因此,联合用药组的具体使用剂量、时间、顺序等问题需要进行进一步论证。
全球多中心双盲Ⅲ期试验CheckMate451[29]继续对N+I联合、Nivolumab单药、安慰剂对ES-SCLC维持治疗的效果进行比较:共纳入834患者,联合组按1N+3I、q3w给药,N单药组按240mg、q2w给药,一直给满两年。结果发现联合组(HR=0.92;95%CI: 0.75~1.12)、单药组(HR=0.84; 95%CI: 0.69~1.02)相比安慰剂组并没有显著提升OS。同时,两组的安全性保持一致。虽然试验结果与预期有所出入,表明Nivolumab单药或N+I联合对于ES-SCLC患者的维持治疗效果不佳。但联合组患者显示出一定的获益趋势,相关临床试验仍在进行以期获得更多优化联合用药方案的数据。
鉴于两种类型的ICI联合治疗SCLC的良好效果。研究者将目光转向了有着相同作用机制的Durvalumab+Tremelimumab(D+T)联合治疗SCLC上。在II期临床试验NCT02937818[30]已经初步证实了这组“黄金搭档”具有不错的安全性和可靠的抗肿瘤活性之后,CASPIAN作为Ⅲ期临床试验[16]将继续考察两者的协同作用。
3.2 ICI与化疗联合
研究发现ICI与化疗药物联用对免疫细胞有激活作用:在节律性(高频低剂量)化疗刺激特异性抗肿瘤免疫细胞后使用ICI可以维持T细胞的激活状态。因此,ICI与化疗联合能产生协同效应,增强抗肿瘤免疫反应,清除代谢竞争。这将使消除耐药性肿瘤细胞成为可能,而这一效果仅靠任何一种治疗方式都无法单独达到[31]。
IMpower133研究[32]旨在评价Atezolizumab联合依托泊苷和卡铂(Etoposide+Carboplatin,EC)治疗ES-SCLC患者的有效性和安全性。403例患者随机分入Atezolizumab联合EC组或安慰剂联合EC组进行4×21天的治疗。其结果显示Atezolizumab组和安慰剂组为的中位OS和PFS分别为12.3个月和10.3个月(HR=0.70; 95%CI:0.54~0.91;P=0.007);5.2个月和4.3个月(HR=0.77; 95%CI:0.62~0.96;P=0.02)。Atezolizumab联合EC作为近20年来首次给ES-SCLC患者的OS和PFS均带来显著提升的方案被NCCN指南推荐用于SCLC的一线标准治疗[33]。
同样作为PD-L1抑制剂Durvalumab也在CASPIAN试验的中期结果中显示出了联合化疗的优越性[16]:Durvalumab联合依托泊苷和顺铂(Etoposide+Platinum,EP)组与单纯EP化疗组相比OS显著提升(HR=0.73,95%CI: 0.59~0.91,P=0.0047),中位OS为13个月和10.3个月。但同时PFS未有显著提升(HR=0.78,95%CI:0.65~0.94)。这也是CASPIAN和IMpower133不同之处:IMpower133中患者的OS和PFS均得到显著提升。研究者考虑其可能原因是在CASPIAN超过半数的患者接受了6个循环的化疗而IMpower133中最多只接受了4个循环的化疗。另外,两组试验对于ICI和铂类的选择也不径相同可能是导致上述结果的原因之一[16]。鉴于Durvalumab联合EP的良好效果,2020年第2版的NCCN肺癌指南中推荐其作为治疗SCLC一线首选方案[33]。
看到PD-L1抑制剂联合化疗取得了良好的疗效,研究者举一反三,将CTLA-4 抑制剂与化疗联合[34]:ES-SCLC患者接受Ipilimumab联合EP或单纯EP治疗的中位OS为11个月和10.9个月(HR=0.94, 95%CI: 0.81~1.09;P=0.3775)、中位PFS:4.6个月和4.4个月(HR=0.85, 95%CI:0.75~0.97)。Ipilimumab联合化疗对于患者作用有限,未能显著提升OS和PFS。其可能原因是Ipilimumab只能刺激外周T细胞活化而对肿瘤微环境中的T细胞无效。与此同时,Atezolizumab则可以激活瘤内未能完全耗尽的T细胞而产生了抗肿瘤作用[31]。
NCT02551432[35]为II期临床试验,共纳入26例铂类耐药的ES-SCLC患者接受紫杉醇(Paclitaxel,PTX)175mg/m2,q3w×6。Pembrolizumb 200mg从第2次用药开始加入持续治疗。结果显示:ORR为23.1%,中位PFS和OS为分别 5.0个月 (95%CI:2.7~6.7) 和 9.2个月(95%CI:6.6~15.1)。Pembrolizumab和PTX联合治疗显示出可观的活性和可控的毒性。后续研究需要确定受益患者的类型。在Ⅲ期试验KEYNOTE604[36]中Pembrolizumab联合 EP治疗与EP单独治疗作为ES-SCLS患者的一线治疗方案进行比较,预计2020年完成初步试验目标。
3.3 ICIs与放疗联合
研究表明放疗后死亡的肿瘤细胞将产生和暴露新抗原,从而调节肿瘤免疫微环境以及全身免疫应答,增强肿瘤T细胞浸润。放疗可以作为ICI不敏感(TMB/MMR低)患者补充的治疗[37]。因此,两者合理联用可以增强局部和系统的抗肿瘤免疫反应,提升治疗成功率[38]。
在II期临床试验(NCT02701400)中[39],SCLC患者随机接受Tremelimumab 1500 mg+Durvalumab 75 mg,q4w (A组),另一组患者在此基础上,对选定的病灶进行立体定向放疗。A组和B组的PFS分别为2.1个月和3.3个月(HR=2.44, 95%CI: 0.75~7.93,P=0.122),中位OS分别为2.6个月和5.7个月(HR=1.50, 95%CI: 0.45~4.99,P=0.507)。研究显示在SCLC中在免疫治疗的基础上联合放疗有增加疗效的趋势,但和未联合组相比OS和PFS没有显著性差异。
在I期试验(NCT02402920)[40]中,研究评价了ES-SCLS患者接化疗后受Pembrolizumab联合胸段放疗(thoracic radiation therapy,TRT)的安全性,发现接受Pembrolizumab联合TRT治疗的患者耐受性良好,严重不良事件发生率低。虽然受限于随访时间短和数据样本少的问题,但该试验联合治疗组和欧洲Ⅲ临床试验中TRT单独治疗组[41]的PFS,OS 分别为6.1个月和4个月;8.4个月和8个月,展现了联合优越性。I期试验对该联合方案的安全性和有效性研究对未来的前瞻性研究奠定了坚实的基础。
3.4 ICI与分子靶向药物联合治疗
随着分子生物学的进展,逐步揭示了SCLC的几个候选的治疗靶点:聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)、组蛋白甲基化转移酶(enhancerofzeste homologue 2,EZH2)、δ 样配体3(delta-like ligand 3,DLL3)等。ICI联合PARP抑制剂、靶向DLL3的抗体偶联药物等将成为治疗耐药性SCLC研究的新方向[42]。
奥拉帕尼(Olaparib)作为PARP抑制剂可以阻止携带受损DNA的肿瘤细胞进行自我修复,达到杀死肿瘤细胞目的[43],其与替莫唑胺(Temozolomide)联合用于SCLC二线治疗的,结果ORR为41.7%;中位PFS和OS分别为4.2个月和8.5个月[44]。进一步研究发现,PARP抑制剂可以增强T细胞在SCLC模型小鼠中的浸润,激活体内免疫反应,与PD-L1抑制剂联合治疗可以使SCLC细胞对免疫治疗更加敏感,从而增强了抗肿瘤活性、提升了联合治疗效果[45],是未来联合用药重点研究方向之一。
Trilaciclib是一种高效、可逆的细胞周期蛋白依赖性激酶4和6 (CDK4/6)抑制剂,可减轻治疗期间骨髓造血干细胞的消耗,实现保护免疫系统的功能[46]。Atezolizumab联合化疗受限于骨髓毒性在SCLC的治疗中无法发挥全部作用,添加Trilaciclib能够带来显著的临床获益。一项Trilaciclib+Atezolizumab+EC对比Atezolizumab+EC一线治疗ES-SCLC的II期研究[47](NCT03041311)为其“减毒增效”效果提供了新的证据:Trilaciclib在没有影响Atezolizumab+EC疗效的同时降低了骨髓抑制作用,显著性地提升了治疗的安全性和耐受性,该结果为ICI联合治疗SCLC提供了一种新的研究思路和策略选择。
4 总结与展望
在日新月异的SCLC治疗领域,ICI治疗的临床初步数据令人惊艳,但单药治疗时部分患者出现不良反应、耐药、低响应性等缺点正在逐步显现。因此,ICI联合治疗有望提升疗效、减免不良反应、提高应答率、降低耐药性。
然而相较于完善的单药临床试验而言,联合治疗通常缺少充足的安全性和有效性的临床试验数据。同时,ICI的独特作用机制可能会增加联合治疗时相互作用的风险,给患者带来意想不到的损害。因此,需要高度重视联合治疗的复杂性与不确定性,充分考虑并证明联合治疗的合理性证据,进一步研究其协同机制,不断优化和调整联用策略,包括联合治疗的方案和联合用药的种类、剂量、顺序、持续时间。实时监测irAEs的发生,做到及时发现和合理处置。
SCLC是一种以恶性程度高、易转移、易耐药等特点而闻名的难治性癌症。因此,在研究ICI联合治疗SCLC时是否可以借鉴NSCLC甚至其他癌种的联合治疗的成功经验,这是研究者心中巨大的疑问。例如,CheckMate227试验测试了N +I联合用于TMB高(TMB≥10个突变/Mb)的晚期NSCLC患者一线治疗的情况。该研究发现 ICI联合治疗PFS和 ORR与化疗相比均有显著性提升:7.2个月和5.5个月;45.3%和26.9%[48]。该试验的经验被成功“移植”到SCLC的CheckMate032和CheckMate451 试验中:同样的组合模式;同样剂量;同样四个周期的给药时间,最终结果同样也显示出了ICI联合治疗的优越性[28-29]。同时,机制类似D+T的联合治疗不同种类的肺癌却有着不同的表现:在SCLC治疗中取得可观的疗效[30,39],但却在NSLCS治疗中效果不佳[48]。因此,SCLC试验可以在一定程度上借鉴NSCLC上取得成功的联合治疗方案,但是不能全盘抄袭。
综上所述,联合治疗的复杂性使和SCLC的特殊性使ICI联合治疗的难度陡增。大量的研究已表明ICI联合治疗SCLC不能是简单的“复制、粘贴”,更不能是简单的“生搬硬套”其他的试验设计。要针对SCLC自身特点,在找到“共性”的前提下,吸收、借鉴现有研究成果,筛选出疗效确切的单药、治疗手段,制定出具有协同作用的联合策略并在临床试验中逐步实施。
随着免疫机制及肿瘤微环境研究的深入,关于ICI联合治疗的研究从一开始的寥寥无几正逐步走向多元化、常态化。虽然,现在大多数试验还处在Ⅰ期、Ⅱ期的阶段,但随着时间的推移更多的研究者将投身于其中,推动联合治疗更好发展,为SCLC患者带来更多的获益。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。
