羧甲基壳聚糖水凝胶亚慢性全身毒性试验植入剂量探讨
2020-12-02贾莉芳孙吉梁洁袁暾连欢马静郑利萍
贾莉芳 孙吉 梁洁 袁暾 连欢 马静 郑利萍


【摘要】 目的 采用不同植入剂量, 对羧甲基壳聚糖(CMC)水凝胶亚慢性全身毒性试验剂量的选择进行探讨。方法 设置5 ml/kg和50 ml/kg的植入剂量, 综合临床观察、血液学、临床生化、大体尸检和组织病理学检查结果, 对CMC水凝胶亚慢性全身毒性进行比较研究。结果 植入剂量为50 ml/kg时, 实验动物初期皮肤刺激损伤明显, 试验终期临床生化指标及组织病理指标提示受试物在该剂量条件下有潜在的亚慢性全身毒性。而植入剂量为5 ml/kg时未见明显的亚慢性全身毒性。结论 生物材料器械亚慢性毒性评价应遵循个体化原则, 根据产品的预期使用目的、使用方式、临床最大使用剂量及前期的研究资料, 在动物可耐受的情况下, 设计科学合理的试验方案对其进行全面评价。
【关键词】 羧甲基壳聚糖;亚慢性全身毒性;植入剂量
DOI:10.14163/j.cnki.11-5547/r.2020.30.001
Discussion on implantation dose of carboxymethyl chitosan hydrogel in subchronic systemic toxicity test JIA Li-fang, SUN Ji, LIANG Jie, et al. National Engineering Research Center for Biomedical Materials, Sichuan University, Chengdu 610064, China
【Abstract】 Objective To discuss the implant dose of carboxymethyl chitosan (CMC) hydrogel in subchronic systemic toxicity test. Methods The implantation doses of 5 ml/kg and 50 ml/kg were set, and the results of clinical observation, hematology, clinical biochemistry, autopsy and histopathology were integrated to compare the subchronic systemic toxicity of CMC hydrogel. Results The skin irritation injury was obvious in the experimental animals at the initial stage. The clinical biochemical indexes and histopathological indexes at the end of the experiment indicated that the test material had potential subchronic systemic toxicity at the dose of 50 ml/kg. However, there was no obvious subchronic systemic toxicity at the dose of 5 ml/kg. Conclusion The subchronic toxicity evaluation of biomaterials and devices should follow the principle of individualization. According to the expected use purpose, use mode, clinical maximum dosage and previous research data, scientific and reasonable test scheme should be designed to comprehensively evaluate the toxicity of biomaterials and devices under the condition that animals toleration.
【Key words】 Carboxymethyl chitosan hydrogel; Subchronic systemic toxicity; Implantation dose
近年來医疗器械行业飞速发展, 创新型、高科技产品层出不穷。但由于我国医疗器械生物学评价起步较晚, 传统亚慢性全身毒性评价方法多借鉴化合物、药物重复给药毒性试验方法, 且多采用器械/材料的浸提液进行评价[1-4], 一方面样品消耗量大, 对高附加值产品的生产研发企业造成了经济负担;另一方面试验期间的多次重复接触, 不符合大多数植入性医疗器械的临床应用方式, 且给药剂量远远超过了临床最大使用剂量。亚慢性全身毒性试验作为生物材料器械非临床安全性评价的重要内容, 目的是通过器械或材料可沥滤物对实验动物的毒性反应, 向人外推, 以评估其对人的危害及危险性。目前医疗器械产品种类复杂, 不同材料器械亚慢性全身毒性试验的接触方式、接触剂量及接触周期都各有不同, 为其长期毒性的评价带来了一定的难度。医疗器械生物学评价国际标准化组织(ISO TC194)WG7工作组专家Dr. Daniel McLain认为和组织接触的医疗器械的亚慢性全身毒性评价可以以植入的方式接触动物, 如引流系统、可吸收性止血纱布、透明质酸凝胶、体外循环管路等[5]。羧甲基壳聚糖(carboxymethyl chitosan, CMC)是壳聚糖羧甲基化后的产物, 由于它既保留了壳聚糖可降解、生物相容性良好的优点, 又极大地改善了水溶性[6], 广泛应用于术后粘连[7]、药物载体[8, 9]、止血材料[10]、医用敷
料[11]、组织工程[12]等领域。Fu等[13]在大鼠体内腹腔植入135 mg/kg的CMC, 14 d后测定实验动物的凝血功能、纤溶功能、抗凝性能和血液流变证实CMC经降解吸收后对动物血液系统无影响。Molinaro等[14]将
4种不同脱乙酰度的壳聚糖水凝胶注射到大鼠后爪来评价其生物相容性, 结果均引起了不同程度的炎症反应, 提出脱乙酰度较高的壳聚糖具有更好的生物相容性。本研究选用以戊二醛为交联剂的CMC水凝胶为研究对象, 模拟临床接触途径, 采用植入方式对其亚慢性全身毒性进行评价。现报告如下。
1 材料与方法
1. 1 动物选择及分组 从检疫后SD大鼠中挑选80只, 雌雄各半。称重后随机分为试验组1、对照组1、试验组2和对照组2, 每组每种性别各10只。
1. 2 接触方式 术前经腹腔注射1%戊巴比妥钠溶液(40 mg/ ml)麻醉动物。麻醉后, 将试验动物背部向上固定, 除去背部被毛, 常规消毒去毛区皮肤。在动物背部沿脊柱两侧注射试验样品或对照样品。各组植入位点及植入剂量见表1。本试验周期共计90 d。
1. 3 临床观察 每天观察并记录各组动物的一般状态、毒性表现。包括皮肤、被毛、眼、黏膜的改变以及呼吸、循环、自主和中枢神经系统、躯体运动及行为模式等变化发生的时间、严重程度和持续时间等。
1. 4 动物体重 试验前称量并记录每只动物体重, 植入后每周称量1次动物体重。试验结束时, 即时称量每只动物体重。
1. 5 临床病理 试验终期于腹主动脉采血, 用于血液学和临床生化指标的检测。血液学指标包括:淋巴细胞百分比(LPR)、单核细胞百分比(MPR)、中性粒细胞百分比(GPR)、血红蛋白浓度(HGB)、红细胞数(RBC)、血小板计数(PLT)、红细胞压积(HCT)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、白细胞计数(WBC);临床生化指标包括:天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、白球比(A/G)、总胆固醇(TC)、甘油三酯(TG)、血糖(GLU)、肌酐(CREA)、尿素(UREA)、尿酸(UA)、总胆红素(TBIL)、钾(K)、钠(Na)、氯(Cl)、钙(Ca)。
1. 6 大体病理 所有动物在试验终结时进行大体尸检, 包括检查体表、体表孔口、头部、胸腔、腹腔及内脏等。及时称量各主要脏器, 如:心脏、肝脏、脾脏、肺脏、肾脏、肾上腺、性腺、腦、胸腺、胃等脏器的湿重并记录各脏器的病理改变。并将器官组织置于10%中性福尔马林溶液中, 用于组织病理学检查。
1. 7 组织病理学 对试验组和对照组动物的器官和组织及全部大体损害进行组织病理学检查。
1. 8 统计学方法 采用SPSS22.0统计学软件进行数据统计分析。计量资料以均数±标准差( x-±s)表示, 采用t检验。P<0.05表示差异具有统计学意义。综合临床观察、临床病理、大体尸检和组织病理学检查结果, 分析评价受试物与异常反应产生的生物学相关性。
2 结果
2. 1 临床观察 试验组1和对照组1:试验组1雌性大鼠在皮下注射当天(第0天), 各植入位点未见异常(见图1-A);皮下注射第1天, 背部大面积红斑(见图1-B);皮下注射第3天, 背部红肿明显, 部分结痂(见图1-C);皮下注射第7天, 背部红肿减轻(见图1-D);皮下注射第14天, 背部结痂逐步恢复;皮下注射第
28天, 背部被毛长出。试验组1雄性大鼠症状较轻。对照组1动物未见异常。
试验组2和对照组2:试验组2雌性大鼠在皮下注射当天(第0天), 各植入位点未见异常;皮下注射第7天, 部分动物植入位点皮肤可见轻度红斑, 个别结痂(见图2-A);皮下注射第14天, 植入位点皮肤基本痊愈(见图2-B)。试验组2雄性大鼠未见异常。对照组2动物未见异常。
2. 2 动物体重 统计分析结果表明, 各试验组动物体重与同期对照组动物体重比较差异均无统计学意义(P>0.05)。值得注意的是, 试验组1动物在皮下注射第3天, 2只动物体重下降>20 g, 16只动物体重降幅<10 g
(试验数据未给出), 但皮下注射第7天, 体重均回升。见图3。
2. 3 血液学指标 试验组1大鼠LPR低于对照组1, 差异具有统计学意义(P<0.05);试验组2大鼠LPR与对照组2比较差异无统计学意义(P>0.05);试验组1与对照组1、试验组2与对照组2大鼠WBC、MPR、GPR、RBC、HGB、HCT、MCV、MCH、MCHC、PLT比较差异无统计学意义(P>0.05)。见表2。
2. 4 临床生化指标 试验组1大鼠ALT、ALP、Ca高于对照组1, AST/ALT、TP、ALB、GLB、CREA、TBIL、
Cl低于对照组1, 差异具有统计学意义(P<0.05);试验组2大鼠Cl高于对照组2, 差异具有统计学意义(P<0.05)。试验组1大鼠AST、A/G、TG、GLU、TC、UREA、UA、K、Na与对照组1比较差异无统计学意义(P>0.05);试验组2大鼠ALT、AST、ALP、AST/ALT、TP、ALB、GLB、A/G、CREA、TG、GLU、TC、TBIL、UREA、UA、K、Na、Ca与对照组2比较差异无统计学意义(P>0.05)。见表3。
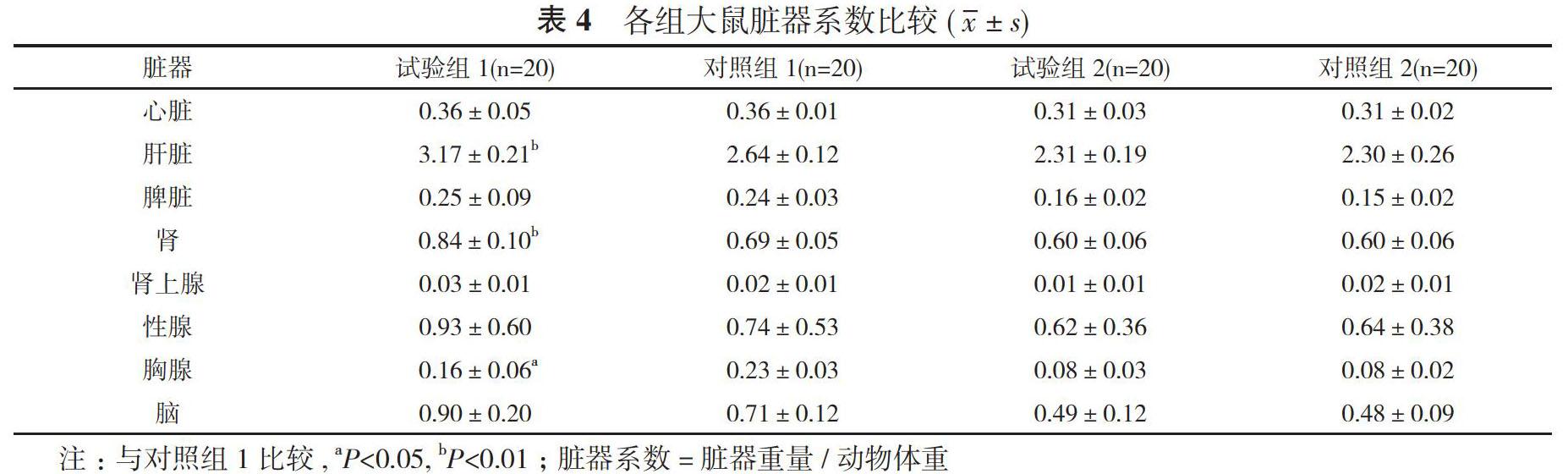
2. 5 大体病理 大体解剖中各组实验动物均未观察到明显肉眼可见的损伤。试验组1大鼠肝脏、肾的脏器系数高于对照组1, 胸腺的脏器系数低于对照组1, 差异具有统计学意义, (P<0.05);试验组1大鼠心脏、脾脏、肾上腺、性腺、脑的脏器系数与对照组1比较差异无统计学意义(P>0.05);试验组2大鼠心脏、肝脏、脾脏、肾、肾上腺、性腺、胸腺、脑的脏器系数与对照组2比较差异无统计学意义(P>0.05)。见表4。
2. 6 组织病理 试验组1多数雌性动物局部可见肝细胞肿胀, 部分雄性动物局部可见肝细胞肿胀, 其他脏器未见异常。见图4。
3 讨论
亚慢性全身毒性是反复或持续接触试验样品后在动物寿命期的某一阶段发生的不良作用, 可提供预期临床途径反复或持续接触所产生的健康危害方面的信息, 以及毒性作用、靶器官、可逆性或其他作用方面的詳细信息[15]。作为一项生物学评价试验, 可作为重复或持续接触人体医疗器械安全评估的重要依据。目前我国生物材料器械的亚慢性全身毒性评价主要依据国标GB/T16886.11[16](等同转化ISO10993-11)进行, 但标准中仅给出了重复接触全身毒性试验的总则、试验设计、评价指标和最终报告的要求, 对于具体接触途径, 特别是以植入为接触途径的接触剂量未做详细规定。
人用药品注册技术要求国际协调会(ICH)发布的《药物进行人体临床试验和上市许可申请的非临床安全性研究指导原则》中认为, 对于任何物种的急性和重复接触毒性试验, 50倍的临床接触剂量都是可以接受的最大剂量[17]。国内《药物重复给药毒性试验技术指导原则》中关于剂量设计给出了注释:剂量设计应考虑之前进行的各项试验所评价的终点、受试物的理化性质和生物利用度等。高剂量应出现明显毒性反应, 或达到最大给药量(Maximum Feasible Dose, MFD), 或系统暴露量达到临床系统暴露量的50倍(基于AUC)[18, 19]。
国家药品监督管理局医疗器械技术审评中心在技术审评中提出, 对于通过植入方式接触受试品的亚慢性毒性试验, 需提供植入剂量的确定依据, 如在动物可耐受的情况下, 推荐样本植入剂量为拟用人体临床剂量的50~100倍, 但是对于人与动物间剂量的换算未做明确要求。
本研究以化学交联法制备的CMC水凝胶为研究对象, CMC的含量为40 mg/ml, 预期用于术后粘连, 临床最大使用剂量为10 ml。结合受试物的临床使用及产品特性, 实验设置5 ml/kg和50 ml/kg的注射剂量, 采用植入方式对其亚慢性全身毒性进行了评价。试验结果表明, 植入剂量为50 ml/kg时, 实验动物初期皮肤刺激损伤明显, 虽后期逐渐恢复, 但试验终期临床生化指标及组织病理指标提示实验动物肝脏损伤, 表明受试物在该剂量条件下有潜在的亚慢性全身毒性。而植入剂量为5 ml/kg时, 实验动物初期仅在注射位点处发红, 且试验终期动物脏器无损伤, 受试样品在该剂量条件下未见明显的亚慢性全身毒性。同一受试物, 在不同植入剂量条件下, 亚慢性毒性试验结果完全不同。
药理学家研究药物在体内的作用时习惯于以mg/kg或g/kg等方式来计算药物的剂量。这种办法适用于同种动物的不同个体间剂量的换算。1958年Pinkle氏报告6-MP等抗肿瘤药物在小鼠、大鼠、狗和人身上的治疗剂量, 改为按mg/m2体表面积计算, 此方法被认为适用于不同动物之间剂量的换算[20]。对于已知有潜在毒性的物质, 相关毒代动力学资料信息可用于种属间的毒性比较, 其优于简单以剂量/体重或剂量/体表面积进行的比较[21]。本研究基于受试物的临床最大使用剂量, 分别按照剂量/体重和剂量/体表面积换算方式设置不同的植入剂量来评价产品的长期毒性, 得到了不同的评价结果。这就提示对于生物材料器械的毒性评价, 特别是针对长期接触医疗器械材料可沥滤物、降解产物等有潜在毒性的产品, 要充分论证接触剂量的选择。ISO10993-1:2018[22]中正式给出了生物相容性的定义, 即某一医疗器械或材料在特定应用中具有适应宿主反应的能力。这一定义一方面强调了产品预期用途的重要性, 另一方面指出产品对于宿主的反应要适宜, 需结合器械或材料的总体设计, 兼顾安全性和有效性。随着我国医疗器械生物学安全评价体系的日益完善, 生物学评价更多是强调利用已有毒理学数据进行文献评审。但医疗器械不同于化合物药物, 其可沥滤物中毒性物质的含量相对较低且多为混合物, 通常缺乏完整的毒性数据, 刘成虎等[23]提出了毒理学关注阈值(TTC)在医疗器械生物学评价应用中的可能性, 这为企业提交产品风险分析提供了一个新思路。
对于植入医疗器械, 其原材料的可沥滤物/浸提物、生产过程中的残留物以及植入人体后的降解产物, 都将影响其终产品的安全性。在对生物材料器械进行全身毒性评价时, 应尽可能与实际临床应用相结合, 在动物可耐受的条件下, 综合考虑产品材料表征、实际应用方式、接触周期、临床用量以及产品在临床应用中的潜在风险, 选择合适的剂量进行评价。企业在提交审评资料时, 应结合检测机构出具的生物相容性评价结果, 按照YY/T 0316《医疗器械风险管理对医疗器械的应用》标准的要求[24], 对产品的受益-风险进行全面的分析, 确保产品受益大于风险。
参考文献
[1] 郑译, 曹穗兰, 向健, 等. 壳聚糖-明胶止血材料亚慢性全身毒性检测方案的探讨. 中国医疗器械信息, 2018, 24(9):63-64.
[2] Hanh NT, Bich PTN, Thao HTT. Acute and subchronic oral toxicity assessment of calcium hydroxyapatite-alginate in animals. Vietnam Journal of Chemistry, 2019, 57(1):16-20.
[3] 王涵, 赵丹妹, 许建霞, 等. 3D打印骨科钛合金的亚慢性全身毒性研究. 组织工程与重建外科杂志, 2020, 16(1):6-10.
[4] 屈媛媛, 张蔓, 李文, 等. 无源医疗器械材料生物相容性研究进展. 医疗装备, 2016, 29(3):46-50.
[5] 侯丽, 施燕平. 医疗器械重复接触全身毒性试验方法研究. 中国医疗器械信息, 2013, 19(2):35-38.
[6] Nishimura S, Kohgo O, Kurita K, et al. Chemospecific manipulations of a rigid polysaccharide: syntheses of novel chitosan derivatives with excellent solubility in common organic solvents by regioselective chemical modifications. Macromolecules, 1991, 24(17):4745-4748.
[7] 高萍, 程琳, 陈斌, 等. 医用可注射羧甲基葡糖胺聚糖防粘连凝胶的生物安全性评价. 中国组织工程研究, 2019, 23(10): 1570-1574.
[8] 林友文, 庄小慧, 李光文, 等. 壳聚糖-羧甲基壳聚糖凝胶的温敏性及体外药物缓释试验. 中国现代应用药学, 2010, 27(7): 626-630.
[9] 张尚文, 韩丹丹, 汪鑫, 等. 聚乙烯醇-羧甲基壳聚糖复合水凝胶药物缓释体系的制备及评价. 化工新型材料, 2020, 48(6): 273-277.
[10] Zhao Y, Li J, Leng F, et al. Degradable porous carboxymethyl chitin hemostatic microspheres. Journal of Biomaterials ence, Polymer Edition, 2020, 31(11):1369-1384.
[11] 林放, 周谋, 李艳辉, 等. 一种富含PRP的羧甲基壳聚糖可溶性敷料止血作用的研究. 中国输血杂志, 2019, 32(11):1109-1112.
[12] 崔军. 壳聚糖/β-甘油磷酸钠复合GBR屏障膜的制备及其性能研究. 山东大学, 2011.
[13] Fu D, Han B, Dong W, et al. Effects of carboxymethyl chitosan on the blood system of rats. Biochemical & Biophysical Research Communications, 2011, 408(1):110-114.
[14] Molinaro G, Leroux JC, Damas J, et al. Biocompatibility of thermosensitive chitosan-based hydrogels: An in vivo experimental approach to injectable biomaterials. Biomaterials, 2002, 23(13): 2717-2722.
[15] ISO 10993-11: 2017. (2017) Biological evaluation of medical devices-Part 11: Tests for systemic toxicity. Geneva, Switzerland: International Organization for Standardization. www. iso. org.
[16] 中华人民共和国国家质量监督检验检疫总局, 中国国家标准化管理委员会. GB/T 16886. 11-2011. 医疗器械生物学评价 第
11部分:全身毒性试验. 北京: 中国标准出版社, 2011.
[17] Guidance on nonclinical safety studies for the conduct of human clinical trials and marketing authorization for pharmaceuticals, ICH /M3(R2)2009. 6.
[18] 國家食品药品监督管理总局. 药物重复给药毒性试验技术指导原则. 北京, 2014.
[19] 于敏, 李佐刚. 药物毒代动力学的研究现状与展望. 中国新药杂志, 2017, 26(7):742-748.
[20] 章元沛. 药理学实验. 北京: 人民卫生出版社, 1985:240.
[21] 王海学, 彭健. 化药药物评价-ICH毒代动力学指导原则: 毒性研究中全身暴露量的评价. 国家食品药品监督管理总局药品审评中心, 2016.
[22] ISO 10993-1:2018. (2018) Biological evaluation of medical devices -Part 1: Evaluation and testing within a risk management process. Geneva, Switzerland: International Organization for Standardization. www. iso. org.
[23] 刘成虎, 施燕平, 杜晓丹, 等. 毒理学关注阈值(TTC)在医疗器械生物学评价中的应用. 中国医疗器械杂志, 2019, 43(4):282-285.
[24] 国家食品药品监督管理总局. YY/T 0316-2016. 《医疗器械风险管理对医疗器械的应用》. 北京: 中国标准出版社, 2016.
[收稿日期:2020-08-20]
