谷子MDH基因非生物逆境响应特性研究
2020-12-02赵晋锋杜艳伟余爱丽
赵晋锋 杜艳伟 余爱丽
(山西农业大学/山西省农业科学院谷子研究所/特色杂粮种质资源发掘与育种山西省重点实验室, 山西 长治 046011)
苹果酸脱氢酶(malate dehydrogenase,MDH)是光合作用以及生命活动中的关键酶,主要功能是催化苹果酸和草酰乙酸之间的可逆转化,是动植物生命活动中的重要中间产物[1]。MDH广泛存在于动物、植物和微生物中,参与植物生长发育过程中的生理生化活动,如三羧酸循环(tricarboxylic acid cycle,TCA)、C4循环、脂肪酸的氧化、呼吸作用、氮同化等[2]。相关研究揭示MDH与植物种子萌发、叶绿体含量及结构、花粉发育、淀粉合成、糖积累、果实发育和成熟、果实酸度以及抗逆等生理过程密切相关[3-6]。
研究表明,MDH在植物细胞中以多种形式的亚型存在,不同亚型的MDH具有其特定的辅酶NAD(NADP)。不同亚型MDH通常存在于不同的细胞器中,根据其辅酶及亚细胞位置的不同,MDH分为线粒体NAD-MDH、微体NAD-MDH、叶绿体NAD-MDH、叶绿体NADP-MDH及细胞质NAD-MDH[7]。Eubel等[8]报道拟南芥中存在多种NAD-MDH亚型,不同亚型NAD-MDH所在细胞器以及参与代谢途径不同,具有不同的生理生化功能。目前国内外研究者已经从多种植物中克隆得到了MDH基因并开展了广泛研究,主要包括水稻、玉米、大豆、苹果、棉花、甘蔗、绿豆、番茄、香蕉、木薯、苜蓿等[9-10]。目前,MDH与抗逆相关性方面研究较少。张觅等[11]从香橙根中克隆了MDH基因,发现在烟草中超量表达MDH可以提高植株对铝毒的耐受能力。MDH基因在苜蓿中超量表达后,可以显著增强苜蓿对酸性土壤的适应力并提高铝毒耐受性[12]。张建斌等[13]从香蕉果实中克隆得到MDH基因,发现在乙烯利处理下香蕉苗中MDH基因上调表达,在铝离子盐胁迫及香蕉枯萎病菌侵染幼苗时MDH表达呈先上升后下降趋势,在冷害胁迫下呈先下降后上升趋势,推测香蕉MDH基因可能在抵抗衰老、重金属铝、低温胁迫及枯萎病菌侵染等逆境中发挥重要作用。水稻OsMDH1在叶片、叶鞘、圆锥花序等不同组织中均有表达;盐胁迫下,在颖片、芽、根和茎等组织中OsMDH1均被诱导表达;进一步研究表明OsMDH1通过影响水稻组织维生素B6含量来负调控盐胁迫应答[14]。
谷子(Setariaitalica)是起源于我国的C4禾本科重要粮食作物和饲草作物,具有抗旱、耐瘠、适应性广等特点[15-17]。在生长发育过程中谷子经常遭遇干旱、盐渍、低温、高温、洪涝以及病虫害侵染,严重影响了谷子的生长发育[18]。谷子基因组测序工作在2012年完成并公布,这为开展谷子抗逆分子生物学研究提供了极为便利的条件[19-20]。目前,有关MDH研究主要聚集在细胞的多种生理活动以及在医学中的应用,在植物上主要涉及番茄、大豆、苜蓿、香蕉等作物,但MDH基因在抗逆方面的表达调控研究鲜有报道,且MDH与逆境关系还缺乏系统深入的研究,尤其是在典型C4抗逆作物谷子中MDH的表达及功能还有待研究。因此,本研究通过序列比对得到2个谷子MDH基因(SiMDH1和SiMDH2),通过网站在线工具和软件对其氨基酸序列、蛋白特征、功能、信号途径、顺势应答元件等参数特征进行分析和预测,随后分析了它们在幼苗期逆境胁迫下的动态表达模式,以及在拔节、抽穗、灌浆3个主要生育时期干旱胁迫和不同光照处理下的表达情况,旨在进一步分析MDH基因在谷子逆境应答信号途径中的功能和机制,为利用基因工程方法改善作物光合速率和提高产量提供数据支持。
1 材料与方法
1.1 材料与试剂
试验材料为谷子品种豫谷1号,由山西省农业科学院谷子研究所生物技术课题提供。
TRIzol试剂,购自生工生物工程(上海)有限公司;逆转录酶、LATaqDNA 聚合酶和RNA 酶抑制剂,购自宝生物工程有限公司;其他试剂均购自生工生物工程(上海)有限公司。
1.2 胁迫处理试验
在组培室中培养谷子幼苗,温度为42~24℃,相对湿度为60%, 光照周期为16 h光照/8 h黑暗。待组培室幼苗长至三叶一心期时分别对其进行20% 模拟干旱[20%聚乙二醇(polyethylene glycol, PEG)6000]、盐 (250 mmol·L-1NaCl)、脱落酸(abscisic acid,ABA)(100 μmol·L-1) 和低温(cold)(4℃) 胁迫处理,逆境表达谱分析取样时间点为处理后0、1、3、6、12、24 h,整株取样[21]。对照(CK)生育期内正常浇水;干旱处理只浇3次关键水。光照处理为当植株出苗后用黑色遮阳网分别遮挡一层(光照Ⅰ中等光照,拔节期、抽穗期、灌浆期测量光照强度分别为1.32×104、2.45×104、0.98×104lx),两层(光照Ⅱ弱光照,拔节期、抽穗期、灌浆期测量光照强度分别为0.31×104、0.57×104、0.35×104lx) 至成熟收获。使用GM1040标智光强测定仪(上海双旭电子有限公司)于晴天上午9:00-10:00测量光照强度,测量10次,取平均值。其他农田管理措施相同。旱棚材料分别在拔节、抽穗、灌浆期时取对照和处理旗叶叶片,所有样品叶片取样后立即在-80℃冰箱中速冻备用。试验均设3次生物学重复。
1.3 谷子MDH基因的鉴定及基因结构、蛋白序列分析
在Phytozome数据库中以拟南芥MDH为递交序列, 进行BLASTP比对,搜索具有完整阅读框的谷子同源序列,获得谷子候选MDH基因。蛋白分子量和等电点利用ExPASy网站在线工具预测。基因启动子区域顺式元件利用PLACE在线软件分析,基因结构图采用GSDS软件绘制,亚细胞定位预测使用Psort在线工具,使用BLAST工具在NCBI上查找不同物种氨基酸同源性序列,采用ClustalX1.83软件[22]分析基因序列;利用Mega6.0软件采用邻接法构建不同物种系统进化树[23]。
1.4 植物总RNA提取、cDNA 合成及引物设计
植物总RNA提取使用TRIzol试剂盒[生工生物工程(上海)股份有限公司];cDNA合成使用生工第一链cDNA合成试剂盒[生工生物工程(上海)股份有限公司],上述试验均按照试剂盒说明书进行。所用引物均采用Primer Primer 5.0设计,由生工生物工程(上海)有限公司合成。试验所需其他试剂参照《分子克隆》[24]配制。
1.5 qPCR分析
样品cDNA均一化后作为实时定量PCR(quantitative PCR, qPCR)模板,以谷子SiGAPB基因作为内参基因。标准反应体系为20 μL:10 μL 2×荧光染料混合液、0.4 μL正向引物(10 μmol·L-1)、0.4 μL反向引物(10 μmol·L-1)、2 μL cDNA模板,7.2 μL无菌水。qPCR反应程序:95℃预变性3 min;95℃变性7 s,57℃退火10 s,72℃延伸15 s,45个循环。每个处理3次重复。采用2-ΔΔCt法计算基因在逆境处理下各时间点相对于CK的转录水平变化[25]。采用SPSS 19.0软件对qPCR分析结果进行显著性分析。苗期不同逆境下表达分析结果利用百迈克云平台在线工具聚类热图绘制(pretty heatmaps)进行热图绘制,参数默认。
2 结果与分析
2.1 MDH基因鉴定与参数分析
通过序列比对和分析, 从谷子中得到2个SiMDH基因,根据在基因组上相应位置分别命名为SiMDH1和SiMDH2。其中SiMDH1位于2号染色体上15714933~15719067区间,SiMDH2位于6号染色体上35757958~35761505区间(表1)。进一步检索发现SiMDH1只有1种转录,编码452个氨基酸,而SiMDH2有2个转录本SiMDH2-1和SiMDH2-2,分别编码438和333个氨基酸,由于SiMDH2-2 N端少105个氨基酸,因此其序列较短。后续表达分析时仅将SiMDH2原始转录变异体SiMDH2-1对应的序列作为该基因的代表。功能域分析发现,SiMDH1和SiMDH2都含有MDH基因特征功能域Ldh_1_N (苹果酸酶NAD结合功能域)和 Ldh_1_C(苹果酸酶C端功能域)。在相关网站对SiMDH蛋白的等电点、分子量、分子式、不稳定系数、脂肪指数和平均疏水性等进行预测,详见表1。GSDS 在线软件分析基因结构发现,SiMDH1和SiMDH2-1均含13个内含子,而SiMDH2-2含11个内含子(图1)。

表1 预测谷子MDH基因参数Table 1 Parameters of predicted foxtail millet MDH genes
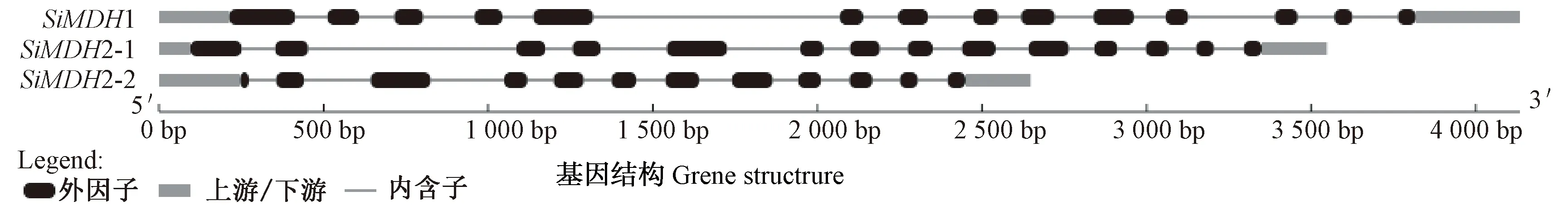
图1 SiMDH 成员基因结构Fig.1 Gene structure of SiMDH genes
2.2 MDH基因氨基酸序列比对与进化分析
ClustalX1.83软件比对氨基酸序列发现,SiMDH1、SiMDH2-1和SiMDH2-2之间序列比较保守,相似性较高,其序列相似性为72.34%。为进一步了解谷子SiMDH进化关系,推测其生物功能,在NCBI数据库中检索了不同物种(拟南芥、高粱、水稻、玉米)已知MDH基因,包括拟南芥AtMDH1、AtMDH2,高粱SbMDH1、SbMDH2,水稻OsMDH1、OsMDH12,玉米ZmMDH1、ZmMDH2,对应GeneBank蛋白序列号分别为AT3G47520.1、AAK00366.1, KXG26853.1、KXG24112.1,BAD09842.1、 BAG97452.1,ACG34976.1、AAB64290.1。序列比对发现,OsMDH2序列与SiMDH1、SiMDH2-1和SiMDH2-2 同源性较高,序列相似性分别为67.86%、75.42%和65.97%,但所有MDH序列整体相似性较低,仅为41.62%,图2揭示MDH基因在进化过程中序列变化较大,保守性较差。发育树中(图3)所有MDH成员相互嵌合在一起,表明 MDH基因在单、双子叶植物分化前就已经存在。此外,一些同源基因对的存在,如SiMDH2和OSMDH2、ZmMDH2和SbMDH1、SbMDH2和AtMDH2、ZmMDH1和OsMDH1,揭示它们可能由共同祖先进化而来,且在功能上可能具有类似的生物功能。
2.3 亚细胞定位预测和启动子区域顺式元件分析
采用Psort在线工具对谷子SiMDH1和SiMDH2的亚细胞位置进行预测,结果表明,SiMDH1和SiMDH2都主要被定位在叶绿体、细胞质和线粒体中,其中SiMDH1预测置信度分别为3.332、0.837和0.321,而SiMDH2预测置信度分别为3.382、0.820和0.366。利用PLACE在线软件对SiMDH成员启动子顺式元件进行分析,由表2可知,SiMDH1和SiMDH2成员启动子区域主要包括大量的光应答元件、激素类应答元件以及其他生长调控相关顺式元件,包括厌氧诱导、分生组织特异性激活、昼夜节律控制、胚乳表达、玉米醇溶蛋白代谢调控、种子特异性调控、昼夜节律调控等元件。SiMDH2不同剪切体启动子区域存在不同顺式元件揭示他们在功能上有所差异。

注:黑色背景氨基酸表示相同氨基酸残基,灰色背景氨基酸表示相似氨基酸残基(≥60% 相似性);序列中苹果酸酶特征功能域Ldh_1_N (NAD结合功能域) 和 Ldh_1_C (C端功能域) 分别用“-”和“·”连字符标出。Note:The black background amino acids represent the same amino acid residues, and the gray background amino acids represent similar amino acid residues (≥60% similarity). The Ldh_1_N (NAD-binding) and Ldh_1_C (C-terminal) domains of malate dehydrogenase in the sequence were marked with ‘-’ and ‘·’ hyphens.图2 SiMDH1和SiMDH2 与其他已知MDH氨基酸序列比对Fig.2 Sequences alignment of SiMDH1 and SiMDH2 with other known MDHs
2.4 非生物逆境胁迫下谷子SiMDH基因的表达分析
由图4可知,在4种胁迫处理下,谷子幼苗SiMDH1和SiMDH2诱导表达程度不同,在不同时间点表达水平变化趋势不完全相同,SiMDH1表达量上调趋势明显高于SiMDH2。在ABA-6 h、Cold-24 h、PEG-3 h、NaCl-6 h时,SiMDH1基因相对表达量达最高,分别为各胁迫处理CK的119.16、20.26、30.54和11.64倍;在ABA-6 h、Cold-24 h、PEG-3 h、NaCl-24 h时,SiMDH2基因相对表达量最高,分别为各胁迫处理CK的3.79、3.93、2.92和2.18倍。上述试验结果表明,SiMDH1和SiMDH2参与了谷子苗期干旱、盐、低温和ABA等逆境胁迫响应,尤其是SiMDH1可能在谷子苗期逆境应答信号系统中具有更重要的作用。

表2 启动子区域顺式元件预测Table 2 Prediction of cis-elements in promoter region
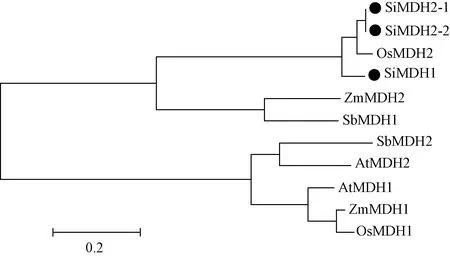
图3 MDH氨基酸序列进化树分析Fig.3 Phylogenetic tree of MDH amino acid sequences
2.5 正常生长、干旱胁迫及不同光照强度下不同生育期谷子SiMDH表达分析
由图5可知,在正常生长条件下,与拔节期相比,抽穗期、灌浆期的SiMDH1相对表达量均有明显提升,分别为拔节期的1.73和12.07倍;在干旱胁迫下,与拔节期相比,抽穗期、灌浆期的SiMDH1相对表达量也均有明显提升,分别为拔节期的2.02和1.84倍。在正常生长条件下,与拔节期相比,抽穗期的SiMDH2相对表达量变化不大,而灌浆期SiMDH2表达量下降;在干旱胁迫下,与拔节期相比,抽穗期、灌浆期的SiMDH2相对表达量均有明显提升,分别为拔节期的2.84和1.27倍。

注:浅绿、深绿、黑色、浅红、深红代表基因表达水平,其中绿色表示基因表达弱,红色表示基因表达强。Note:Light green,dark green, black, light red and dark red are used to represent gene expression levels. Green indicates weak gene expression, red indicates strong gene expression.图4 谷子苗期SiMDH基因在不同胁迫下的表达分析Fig.4 Expression analysis of SiMDH under different stressesing at seedling stage
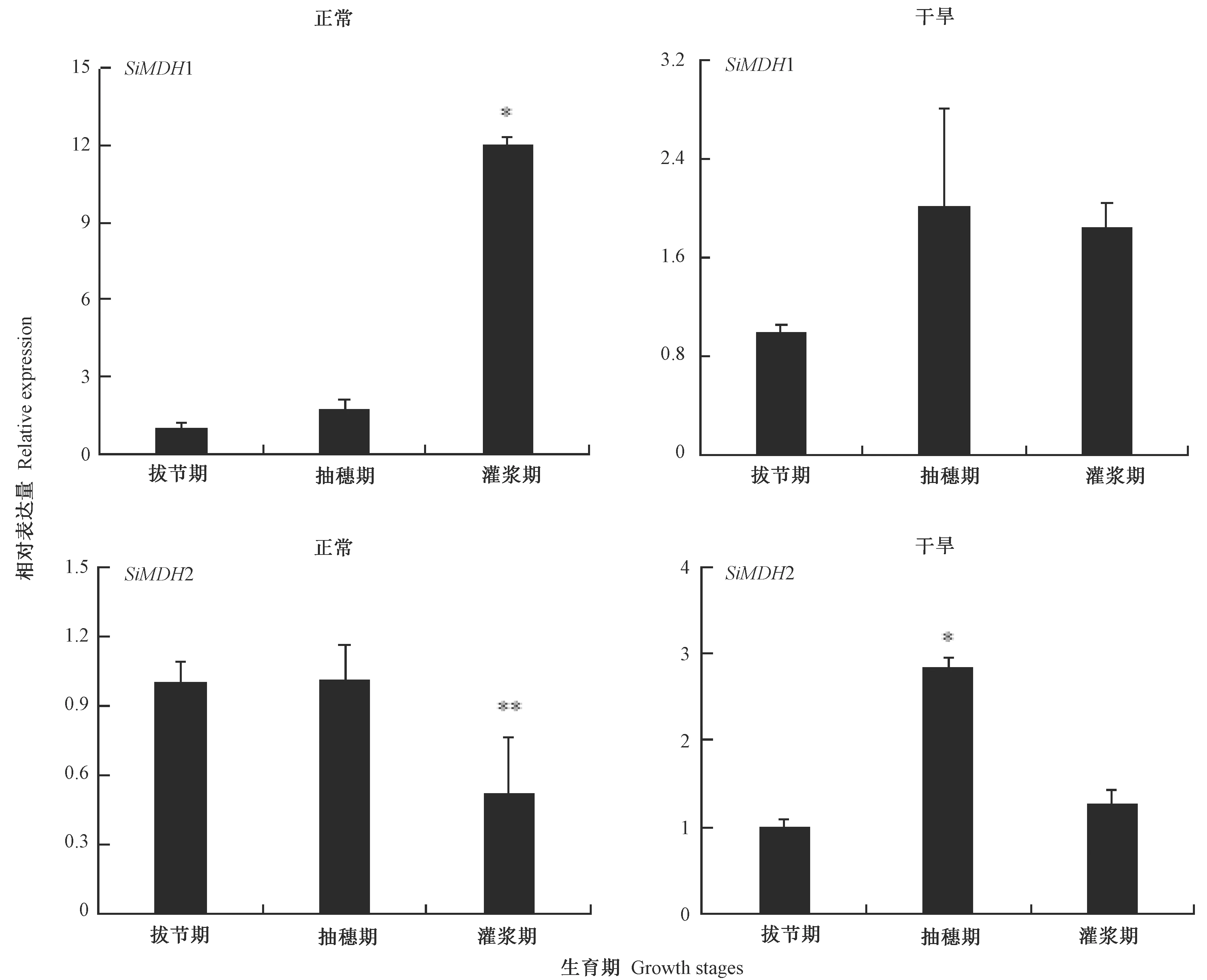
注:*和**分别表示在0.05和0.01水平上差异显著。下同。Note: * and ** indicate significant difference at 0.05 and 0.01 level, respectively. The same as following.图5 正常和干旱条件下不同生育期谷子SiMDH1 和SiMDH2 的相对表达量Fig.5 Relative expression of SiMDH1 and SiMDH2 under normal and drought conditions during different growth stages
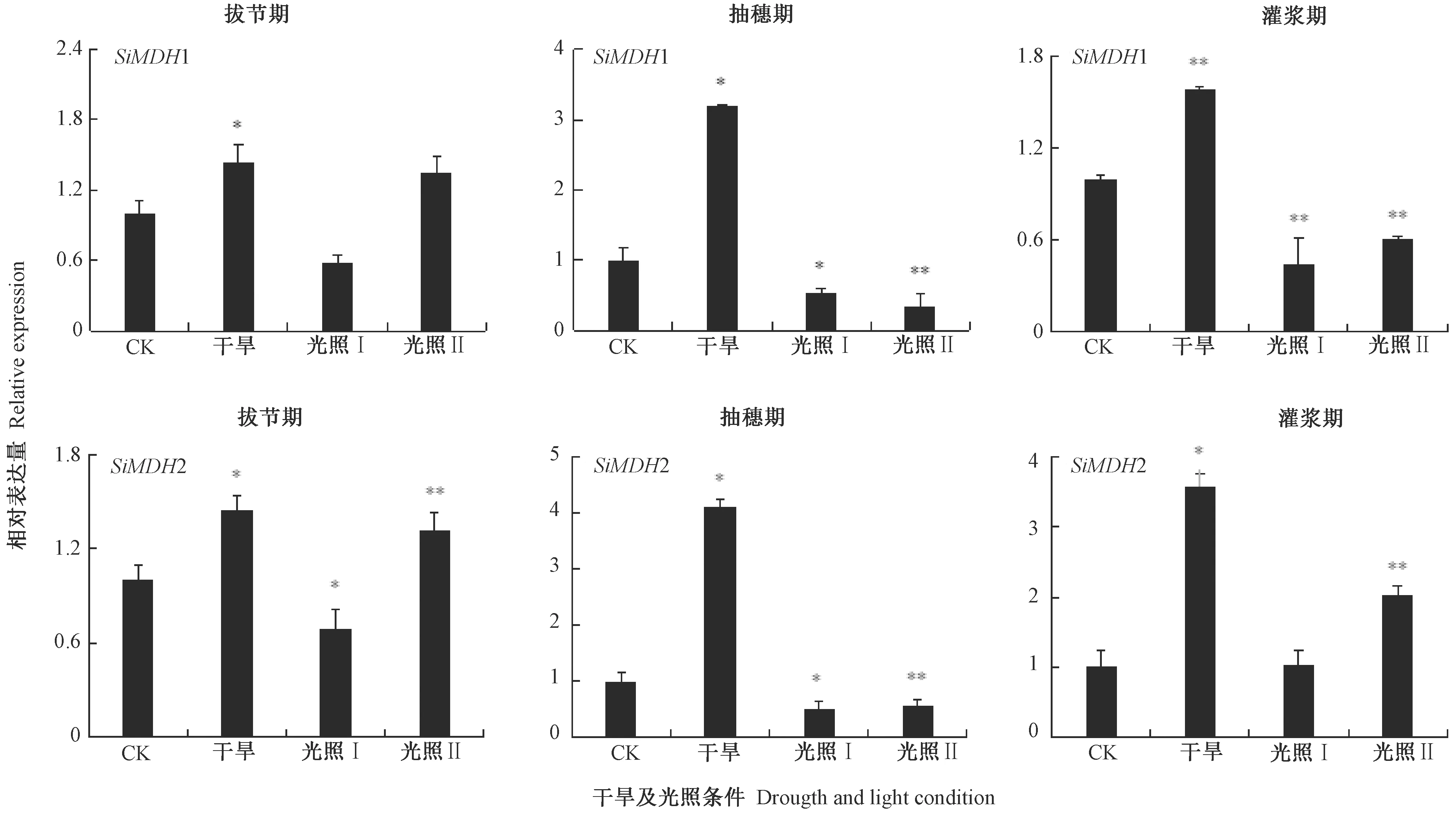
图6 光照和干旱条件下谷子SiMDH1和SiMDH2的相对表达量Fig.6 Relative expression of SiMDH1 and SiMDH2 under light and drought conditions
由图6可知,在干旱条件下,拔节期、抽穗期和灌浆期SiMDH1相对表达量均有上升,分别为相应CK(正常生长)的1.43、3.18和1.58倍;在拔节期中等光照(光照Ⅰ)下SiMDH1相对表达量下降,但在弱光(光照Ⅱ)条件下SiMDH1相对表达量明显提高,分别为CK的0.58和1.35倍;在抽穗期和灌浆期的中等和弱光照下SiMDH1相对表达量均下降,抽穗期中等和弱光照下SiMDH1相对表达量为CK的0.54和0.35倍,灌浆期中等和弱光照下SiMDH1相对表达量为CK的0.45和0.61倍。在干旱条件下,拔节期、抽穗期和灌浆期SiMDH2相对表达量均明显上升,分别为CK的1.46、4.10和3.58倍;在拔节期中等光照下SiMDH2相对表达量下降,而在弱光条件下SiMDH2相对表达量明显提高,分别为CK的0.69和1.32倍;在抽穗期的中等和弱光照下SiMDH2相对表达量都下降,分别为CK的0.52和0.57倍,灌浆期中等光照下SiMDH2相对表达量略有上升,弱光照下上升明显,分别为CK的1.03和2.02倍。
不同生育期干旱胁迫表达谱分析表明,SiMDH1和SiMDH2均参与了谷子拔节期、抽穗期和灌浆期的干旱胁迫应答。不同光照强度下表达谱分析结果表明,2个MDH基因在不同生育期不同光照强度下表达水平不同,SiMDH1和SiMDH2在谷子拔节期、抽穗期和灌浆期表达受光照强度影响严重。
3 讨论
研究结果表明,SiMDH1、SiMDH2与其他物种MDH蛋白序列具有较高同源性,它们都含有MDH基因的特征功能域,苹果酸酶NAD结合域和苹果酸酶C端功能域,揭示它们在进化上比较保守。亚细胞定位预测分析发现,SiMDH1和SiMDH2主要被定位在叶绿体、细胞质和线粒体中,这些位置都是植物光合作用的关键位置,印证了MDH是光合作用以及生命活动中的关键酶,在植物光合作用信号途径中起重要作用的观点。顺式元件分析发现在SiMDH启动子区域含有大量光应答、激素类和其他类应答元件。若基因启动子区域存在某种顺式元件则该基因很可能参与相应的信号途径[26]。研究表明在非生物逆境,如干旱、盐、低温、高温以及伤害等胁迫下会导致植物细胞内的ABA水平升高,众所周知ABA是在非生物逆境应答中起重要作用的激素[27]。因此推测谷子SiMDH基因很可能参与了植物对非生物逆境胁迫的响应。
本研究发现SiMDH1和SiMDH2参与了谷子苗期等逆境胁迫响应,尤其是SiMDH1可能在谷子苗期逆境应答信号系统中起更重要的作用。后续不同生育期干旱胁迫及不同光照强度下表达谱分析也表明SiMDH1和SiMDH2均参与了拔节期、抽穗期和灌浆期的干旱胁迫应答。而且不同光照强度会显著影响SiMDH1和SiMDH2在不同生育期的表达情况。研究表明,在光代谢途径中,NADP-MDH 催化苹果酸代谢,促进草酰乙酸(oxaloacetic acid, OAA)转化为苹果酸,生成光合作用电子受体 NADP+,参与光合作用。Hebbelmann等[28]对拟南芥中NADP-MDH进行了研究,推测在高光和低光条件下植物体通过膜转运蛋白转运苹果酸来维持苹果酸含量的稳定,使植物处于氧化还原的平衡状态。Heyno等[29]将拟南芥缺失性NADPH-MDH突变体中的过氧化氢酶基因敲除,导致拟南芥H2O2含量增加,突变体相比野生型NADPH含量增加,但生长无显著变化,表明MDH在调控过氧化氢酶活性和清除H2O2起着重要的作用。谷子中的MDH基因是否也在光反应中的不同光照强度下参与调控过氧化氢酶活性和清除H2O2还需进一步验证。但本试验结果表明弱光可诱导拔节期SiMDH1以及拔节期和灌浆期SiMDH2基因的表达,揭示了光照强度会显著影响SiMDH1和SiMDH2基因的表达。顺式元件分析还显示在SiMDH基因启动子区域存在茉莉酸甲酯、水杨酸、赤霉素等顺式原件[30]。研究表明病原体感染通常导致细胞中茉莉酸甲酯、水杨酸、乙烯等激素水平增加[31],因此推断SiMDH基因可能在生物应激反应中起一定作用。此外,研究表明缺氧特异性诱导(GC-motif)、分生组织表达(CAT-box)、厌氧诱导必需(ARE)、玉米醇溶蛋白代谢调控(O2-site)、种子特异性调控(RY-element)、昼夜节律(circadian)等核心元件的存在,暗示SiMDH可能参与相应的生理生化过程。在启动子区域还发现了大量的光应答元件,谷子是光温敏感性作物,而且MDH是光合作用中的关键酶,预示SiMDH可能参与调控谷子的光温应答调控并在其中起重要作用。
4 结论
本研究从谷子中鉴定出2个SiMDH基因成员SiMDH1和SiMDH2。序列分析和功能域分析表明它们都含有MDH基因典型特征功能域,与其他物种MDH基因序列具有较高的同源性。亚细胞定位预测2个SiMDH基因被主要定位于细胞的叶绿体、细胞质和线粒体,揭示它们是谷子光合作用过程中的重要基因。qPCR逆境表达分析表明,SiMDH1和SiMDH2广泛参与了谷子苗期非生物逆境胁迫应答。进一步分析表明,SiMDH1和SiMDH2成员参与了谷子在拔节、抽穗、灌浆期的干旱应答,而光照强度会影响SiMDH1和SiMDH2基因在不同生育期的表达。但是这2个基因在非生物逆境胁迫下的分子应答机制还需通过转基因的方法进一步详细验证。本研究为进一步揭示MDH基因在谷子非生物逆境应答信号途径中的机制提供了试验依据。
