荧光PCR法检测结直肠癌组织及外周血KRAS基因突变率
2020-11-24朱静潘志文陈勇毅徐笑红
朱静 潘志文 陈勇毅 徐笑红
近年来,结直肠癌的发病率呈明显上升趋势[1]。2018年全球肿瘤流行病统计数据(LOBOCAN2018)表明,全球结直肠癌每年新发病例数约185万,发病率居第3位,占比10.2%;年死亡人数超过88万,死亡率居第2位,占比9.2%[2]。在我国,结直肠癌的发病率和死亡率分别居第3位和第5位[3]。随着靶向治疗药物表皮生长因子受体(epidermal growth factor receptor,EGFR)抑制剂西妥昔单抗(Cetuximab)的问世,结直肠癌的治疗进入了靶向治疗时代[4]。KRAS基因是人体肿瘤中常见的致癌基因。据报道,结直肠癌患者中KRAS基因的突变率约为27%~43%[5],常见突变位点位于2号外显子的12号和13号密码子,突变类型主要为G13D、G12D、G12A、G12V、G12S、G12R、G12C[6]。抗 EGFR 治疗只有对野生型KRAS基因的患者才有效,对于突变型的患者则无效[7]。因此,KRAS基因突变状态检测在结直肠癌的个体化治疗中具有重要意义。
手术和肠镜活检获得的结直肠癌组织是检测突变的最佳样本,但部分中晚期患者难以取材,检测外周血中的游离肿瘤DNA是否突变成为新趋势[8]。本研究选取357例结直肠癌住院患者的肿瘤组织及外周血样本,配对检测KRAS基因突变情况,以基因测序作为金标准,验证两种标本检测结果的符合率,以期为结直肠癌外周血标本检测KRAS基因突变提供理论依据。
1 对象和方法
1.1 研究对象 选取2015年2月至2018年10月于浙江省肿瘤医院就诊的357例结直肠癌患者,均经病理学检查确诊,其中男204例,女153例,年龄20~91(65.62±12.61)岁;包括结肠癌82例,直肠癌275例;无淋巴结转移的177例,有淋巴结转移的180例。收集患者术中组织样本,经石蜡包埋,置于-80℃保存;配对收集EDTA-K2抗凝的外周血样本,3 000 r/min离心5 min,分离血浆1 ml,置于4℃保存。
1.2 仪器和试剂 人KRAS基因突变检测试剂盒购于为真生物医药科技有限公司(批号:3400362);组织样本DNA提取试剂盒和血液样本DNA提取试剂盒均购于QIAGEN 公司(批号:56404、51104);BigDye®Terminator测序试剂盒购于ABI公司(批号:4336697)。LightCyclerTM480实时荧光定量 PCR仪为Roche公司产品;ABI 3730测序仪为苏州金唯智生物科技有限公司产品。
1.3 方法 以突变扩增阻滞系统(amplification refractory mutation system,ARMS)为主,融合了熔解曲线分析,利用ARMS突变特异性引物对突变靶序列进行高精准PCR扩增。
1.3.1 DNA提取 按QIAGEN公司组织或血液DNA提取试剂盒说明书的操作进行。
1.3.2 PCR检测 按照人KRAS基因突变检测试剂盒所述方法,将 2×MicroDiag Mutation Detection Mix、阳性质控品、纯化水以及稀释成同一浓度的待测组织样本基因组DNA或外周血游离DNA插入冰盒中,恢复至室温。将DNA聚合酶快速离心后置于冰上。其中MicroDiag Mutation Detection Mix(30人份)的组成为 0.5~1 μmol/L 引物、0.2~0.5 μmol/L 阻滞剂、0.5~1 mmol/L dNTP、5 mmol/L MgCl2、36 μl EvaGreen、100 mmol/L KCl及纯化水。针对7个突变位点,使用Oligo软件设计的引物见表1,由Invitrogen公司合成。反应体系中各种成分见表2,每个总反应体积为20 μl。PCR反应条件为:95℃预变性5 min,94℃变性30 s,60℃退火30 s,72℃延伸60 s,共35个循环,最后72℃延伸10 min,4℃结束反应。
1.3.3 金标准的确立 本研究以基因测序为金标准。组织样本提取的DNA进行PCR扩增后,对扩增产物进行测序,检测KRAS基因突变情况。测序引物使用Oligo软件设计,由Invitrogen公司合成。引物序列如下:上游5′-ATAAACTTGTGGTAGTTGGAGC-3′; 下 游 5′-CAGTAATATGCATATTAAAACAAGA-3′。

表1 KRAS基因引物序列

表2 反应体系的各成分
1.4 统计学处理 应用SPSS 20.0统计软件。采用四格表统计法,分别统计肿瘤组织与外周血标本的阴、阳性样本数,列成2×2列联表,计算两种方法的符合率,并以测序结果作为金标准,计算Kappa值,见表3。

表3 肿瘤组织样本与外周血样本PCR检测结果比较
2 结果
2.1 PCR检测结果与基因测序结果的符合情况
2.1.1 肿瘤组织PCR检测结果与基因测序结果符合情况 肿瘤组织PCR检测结果与基因测序结果的阳性符合率为 96.13%(95%CI:91.76%~98.57%);阴性符合率93.56%(95%CI:89.25%~96.53%);总符合率 94.68%(95%CI:91.81%~96.77%)。Kappa 值为 0.8922(95%CI:0.8451~0.9394),说明两种方法存在高度一致性。肿瘤组织PCR检测结果与基因测序结果的符合情况见表4。
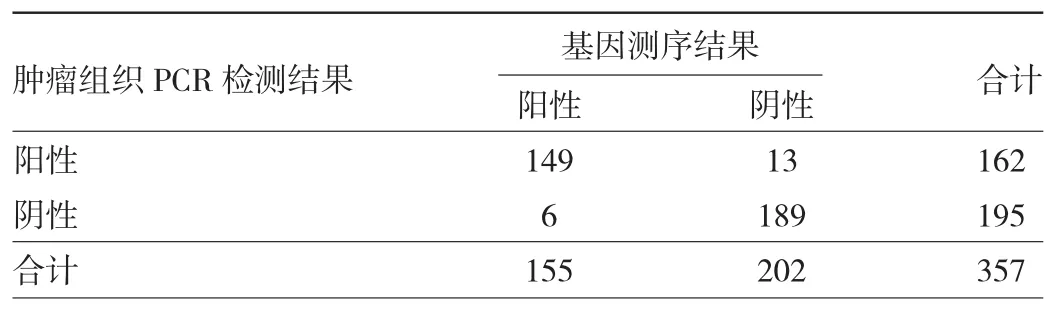
表4 肿瘤组织PCR检测与基因测序结果的符合情况(例)
2.1.2 外周血PCR检测结果与基因测序结果的符合情况 外周血检测结果与基因测序结果的阳性符合率63.23%(95%CI:55.12%~70.82%);阴性符合率 84.16%(95%CI:78.38%~88.91%);总符合率 75.07%(95%CI:70.25%~79.47%)。Kappa 值为 0.4829(95%CI:0.3914~0.5744),说明两种方法存在高度一致性。外周血PCR检测结果与基因测序结果比较见表5。

表5 外周血PCR检测结果与基因测序结果的符合情况(例)
2.1.3 肿瘤组织与外周血PCR检测结果的符合情况肿瘤组织与外周血PCR检测阳性符合率为62.35%(95%CI:54.40%~69.83%),阴性符合率85.13%(95%CI:79.34%~89.81%),总符合率 74.79%(95%CI:69.95%~79.21%)。Kappa 值为 0.4828(95%CI:0.3923~0.5733),说明两种方法存在一致性,且一致性较高。肿瘤组织与外周血PCR检测结果比较见表6。
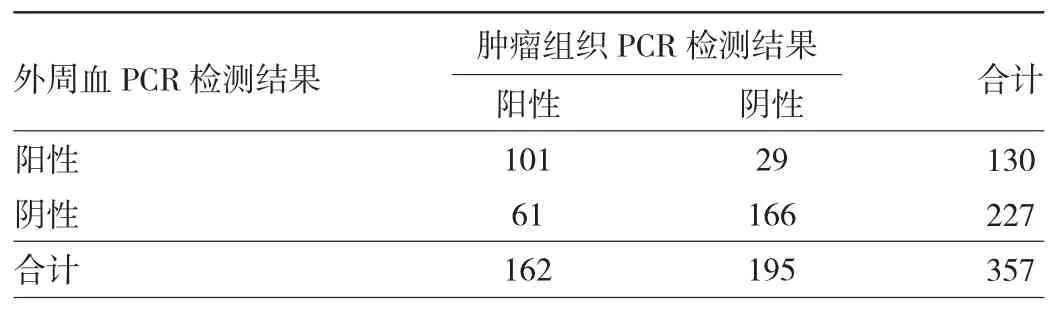
表6 肿瘤组织与外周血PCR检测结果的符合情况(例)
2.2 各基因突变位点PCR检测结果与基因测序结果的符合情况 基因测序阳性位点数为157(155例患者),肿瘤组织PCR检测阳性位点数147,与基因测序符合率93.63%;外周血检测阳性位点数85,与基因测序符合率为54.14%,见表7。
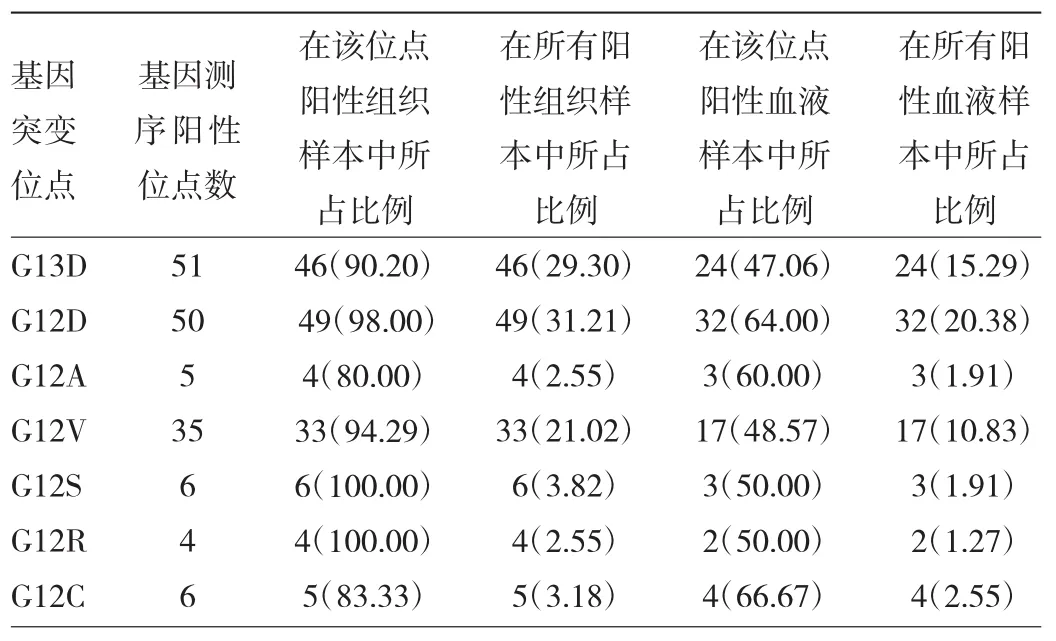
表7 各基因突变位点检测结果与基因测序结果的符合情况[例(%)]
2.3 各基因突变位点阳性结果数量比较 基因测序结果 G13D(32.48%)、G12D(31.85%)突变比例最高,G12R(2.55%)突变比例最低;肿瘤组织PCR检测结果G12D(31.21%)突变比例最高,与基因测序符合率为98.00%,G12R(2.55%)突变比例最低,与基因测序符合率为100%。外周血检测结果G12D(20.38%)突变比例最高,与基因测序符合率为64.00%,G12R(1.27%)突变比例最低,与基因测序符合率为50%。各基因突变位点阳性结果数量见表8。
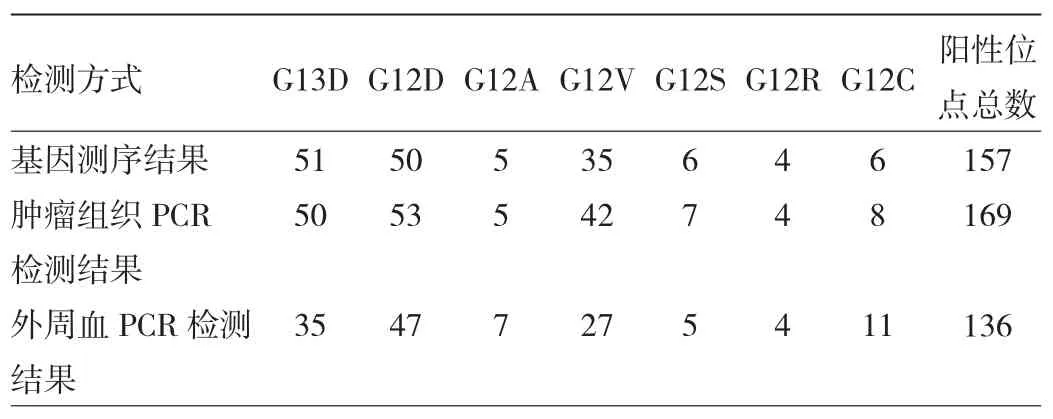
表8 各基因突变类型阳性结果数量(例)
3 讨论
肿瘤细胞内信号转导是一个非常复杂的网络,KRAS基因是EGFR依赖的下游信号转导通路Ras-Raf-MAPK途径的重要基因[9]。美国国家癌症综合治疗联盟(National Comprehensive Cancer Network,NCCN)颁布的《结直肠癌临床实践指南》明确指出:所有转移性结直肠癌患者都应检测KRAS基因状态,只有KRAS野生型患者才建议接受EGFR抑制剂(如爱必妥和帕尼单抗)治疗[10]。
研究发现KRAS基因突变为肿瘤特异性的体细胞遗传改变,目前未在正常细胞中发现,而且肿瘤在发生、发展过程中,常有少量肿瘤细胞从原发或转移灶脱落进入外周血[11]。肿瘤细胞发生凋亡并释放出遗传物质,导致血中存在游离肿瘤DNA,与原发肿瘤遗传信息相同[12]。所以,若原发或转移灶肿瘤细胞存在KRAS基因突变,即可从外周血游离DNA中检测出来。而且,外周血采集方便,创伤较小,患者容易接受。因此,突变检测的样本选择除了结直肠癌组织外,外周血循环肿瘤DNA(circulating tumor DNA,ctDNA)已逐渐成为替代样本来源。ctDNA主要来自肿瘤细胞自主分泌、坏死和凋亡后DNA片段,其片段上往往携带突变信息。对于难以获得结直肠癌组织或耐药突变人群,ctDNA片段上KRAS突变检测有重要的临床意义[13]。
本研究采用突变扩增阻滞系统结合熔解曲线分析,利用阻滞剂与特异性引物竞争性结合野生型模板,使野生型背景DNA不被扩增;通过EvaGreen染料收集突变扩增信号和熔解信号;利用熔解曲线分析区分非特异性扩增片段,从而进一步提高荧光PCR检测的灵敏度和特异度。实验以基因测序为金标准,该技术是WHO推出的基因检测国际标准,对所检测基因区段的每个核苷酸进行检测,准确率高达99.99%。为本次实验的客观性提供了保障。
组织检测结果与基因测序结果比较,两种方法存在一致性,且一致性较高。本研究共计19例不符,其中6例基因测序结果为阳性,组织检测结果为阴性,可能由于PCR反应过程中样本与引物结合受到干扰,导致与测序结果不符;13例测序结果为阴性,组织检测结果为阳性,考虑试剂盒所采用的PCR检测方法学灵敏度优于测序方法学所致,此点与文献报道一致[14]。
外周血检测结果与基因测序结果比较,两种方法也存在一致性。本研究共计89例不符,其中有57例基因测序结果为阳性,外周血检测结果为阴性,可能与外周血中循环肿瘤细胞DNA含量较低有关,血液中游离DNA少,突变的游离DNA更少,当KRAS基因突变量低于试剂盒的最低检测限,会出现假阴性结果,导致阳性检出率降低;另外32例基因测序结果为阴性,外周血检测结果为阳性,由于肿瘤病灶非均质化,用于受检部分的组织样本可能不携带KRAS基因突变,而肿瘤其它部分组织块含有KRAS基因突变,外周血循环DNA来自肿瘤原发灶,因此导致外周血检测结果为阳性。
肿瘤组织与外周血的检测结果比较,两种方法存在一致性,且一致性较高。本研究共计90例不符,其中有61例组织检测结果为阳性,外周血检测结果为阴性,同样可能由于外周血中的KRAS基因突变量低于试剂盒的最低检测限所致;另有29例组织检测结果为阴性,外周血检测结果为阳性,同样可能与肿瘤病灶非均质化有关。
对各突变类别检测结果统计分析,无论采用何种检测方法,基因突变率较高的是G13D、G12D、G12V;较低的是G12A、G12S、G12R、G12C,各方法学的检测结果一致性较高。
根据以上研究结果,该KRAS基因突变检测试剂盒可较好地反应结直肠癌患者组织及外周血样本中KRAS基因突变情况。为静脉血代替肿瘤组织检测KRAS基因突变提供了有力依据。
