癌症治疗的新兴免疫靶点及相关研究进展
2020-11-23高峰洪亚珍陈晨李智丛晓凤综述刘子玲审校
高峰 洪亚珍 陈晨 李智 丛晓凤 综述 刘子玲 审校
免疫检查点阻断(immune checkpoint blockade,ICB)疗法在肿瘤治疗领域取得了突破性成果,其中尤以针对程序性死亡受体-1(programmed death-1,PD-1)及其配体PD-L1(programmed death-ligand 1,PD-L1)和细胞毒性T 淋巴细胞相关抗原-4(cytotoxic T lymphocyte associated antigen-4,CTLA-4)的抑制剂最为突出。CTLA-4与共刺激受体CD28高度同源,竞争性地与共同配体B7-1(CD80)/B7-2(CD86)结合,中断了CD28刺激T细胞的活化反应并传递免疫抑制信号[1]。PD-1与PD-L1结合后促进SHP2磷酸酶的募集,再通过下游信号通路抑制T细胞受体(T cell receptor,TCR)介导的T细胞增殖和细胞因子分泌[2]。这是维持机体免疫稳态的重要环节,但有利于肿瘤的发生、进展和免疫逃逸[2-3]。目前,已被批准用于临床治疗的免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)均以CTLA-4或PD-1/PD-L1为靶点,广泛应用于多种实体肿瘤的治疗。但由于肿瘤的异质性、免疫信号通路及肿瘤微环境(tumor microenvironment,TME)的复杂性,总体应答率有限,尤其是TME中的效应T细胞少、肿瘤突变负荷低的“冷性肿瘤”[4],且部分患者也面临着对ICIs的原发性或获得性耐药。随着免疫治疗进入更为精准、广谱、优化的2.0时代,为进一步扩大受益人群,需要拓宽免疫治疗的思路。免疫联合治疗是行之有效的手段,研究抗肿瘤免疫过程中的不同靶点、不同机制对于提高免疫治疗的临床效益具有重要意义。CTLA-4和PD-1/PD-L1仅为肿瘤免疫治疗靶点的部分,许多其他免疫靶点已经显现出应用前景和临床价值。本文将对部分新兴的特异性免疫靶点及相关研究进展进行综述。
1 免疫检查点概述
众所周知,T细胞是抗肿瘤免疫反应过程中的核心参与者。T细胞活化由抗原肽-主要组织相容性复合体(peptide-major histocompatibility complex,pMHC)分子与TCR的相互作用开始,但是有效的T细胞活化还需要其表面的CD28分子与抗原呈递细胞(antigen-presenting cell,APC)上的CD80/CD86 结合而介导的共刺激信号[5]。正常情况下T 细胞的活化受到刺激性和抑制性信号严格的共同调控[6]。免疫检查点(immune checkpoints,ICs)则是传递抑制性信号的配/受体对(如PD-1/PD-L1、CTLA-4/B7),在维持免疫耐受和机体免疫稳态方面具有重要作用,并负向调控T 细胞的抗肿瘤免疫反应[7]。研究表明,ICs 及其配体在TME 中通常被上调[2]。TME 中的免疫抑制成分、肿瘤特异性T 细胞被“耗竭”或被抑制,均与肿瘤免疫逃逸、免疫治疗疗效受限和ICIs继发性耐药存在密切联系[8],而T细胞“耗竭”除了与长时间的肿瘤抗原暴露有关[9],也与多种ICs 的表达上调密切相关[8,10]。抑制途径的配/受体对发挥免疫抑制作用的主要机制为诱导T 细胞衰竭,同时抑制多种ICs 可以部分逆转T细胞衰竭[11]。
2 免疫检查点的特点及作用机制
类似于PD-1和CTLA-4,B和T淋巴细胞弱化子(B and T lymphocyte attenuator,BTLA)的结构包括细胞外结构域、跨膜区和胞质结构域。其中胞质区包含生长因子受体结合蛋白2(growth factor receptor bound protein 2,Grb2)、基于免疫受体酪氨酸的抑制性基序(immunoreceptor tyrosine-based inhibitory motif,ITIM)和基于免疫受体酪氨酸的开关基序(immunoreceptor tyrosinebased switch motif,ITSM)[12-13]。BTLA与配体结合后,引起ITIM发生磷酸化并募集下游酪氨酸磷酸酶SHP1/2,进而抑制T细胞活化。而Grb2募集PI3K亚基p85,通过PI3K信号通路促进T细胞活化与增殖[14]。因此,BTLA分子被认为拥有双向调节功能,同时具备类似于PD-1的免疫抑制作用和CD28的免疫促进作用[15]。
NKG2A 和TIGIT(T cell immunoglobulin and ITIM domain protein)胞质内尾部也包含ITIM基序。与BTLA 相似,NKG2A 与CD94 形成异二聚体并与配体结合,引起ITIM 磷酸化后通过募集SHP1/2 从而抑制T细胞和NK 细胞的活性[16-17];但是TIGIT 转导抑制性信号的关键参与者是Ig 尾部酪氨酸(immunoglobulin tail tyrosine,ITT)样基序[18]。脊髓灰质炎病毒受体(CD155/PVR)和单纯疱疹病毒受体(CD112/PVRL2)为TIGIT 与CD226 的共同配体。与CTLA-4/CD28 类似,TIGIT和CD226竞争性地与APC或肿瘤抗原表面的CD155/CD112 结合,分别传递共抑制信号和共刺激信号[19]。TIGIT 与其配体连接后,ITT 样基序被磷酸化,并与胞质衔接蛋白Grb2 结合,后者通过募集SHIP1 抑制PI3K 和MAPK 信号级联反应以下调NK细胞活性。相比之下,经典的ITIM基序在TIGIT抑制信号中的作用较小[18]。
VISTA、TIM-3、LAG-3的胞质结构域中均不含经典的ITIM或ITSM基序。VISTA仅具有1个富含脯氨酸的基序和2个潜在的蛋白激酶C结合位点。因此,可能同时充当受体和配体[20]。作为关键的髓样细胞内靶点,VISTA可以调节髓样细胞中Toll样受体(tolllike receptors,TLR)信号和控制髓样细胞介导的免疫抑制作用[21]。TIM-3 由细胞外可变结构域IgV、含有糖基化位点的黏蛋白茎结构以及具有保守酪氨酸残基的细胞内尾部组成。TIM-3 的主要配体有galectin-9、ceacam1、HMGB1 和PtdSer[3]。正常状态下,细胞内Bat3(HLA-B associated transcript 3)与TIM-3 结合促进T 细胞增殖,并抑制TIM-3 的免疫负向作用[22]。TIM-3 与配体结合后触发细胞内2 个关键酪氨酸残基(Y256 和Y263)发生磷酸化,使得TIM-3 的细胞质尾部释放Bat3[22-23],并使含有SH2结构域的蛋白激酶募集到TIM-3尾部转导抑制性信号[3,24]。
相较于其他ICs而言,LAG-3具有独特的分子特征,其具有丝氨酸磷酸化位点、KIEELE 基序、谷氨酸脯氨酸重复序列3 个保守结构域。LAG-3 内在信号传导通过细胞质KIEELE 基序传递,可阻止T 细胞进入细胞周期的S 期,从而抑制T 细胞扩增[24]。但KIEELE 基序的细胞内结合伴侣是未知的,LAG-3确切的信号转导机制也尚未明确[25]。在人体中B7-H3的胞外结构域由两对相同的免疫球蛋白恒定域IgC和IgV 组成,而胞质内尾部较短,信号基序未知[26],B7-H3的受体亦不明确[26],见表1。
2.1 TIGIT
TIGIT 在抗肿瘤免疫的多个环节发挥免疫抑制效应:首先可以抑制NK 细胞的功能,阻止免疫初始阶段的肿瘤抗原释放和肿瘤细胞死亡[27],Zhang等[28]在几种荷瘤小鼠模型中证实了阻断TIGIT 通路可防止NK细胞衰竭,促进NK细胞依赖性抗肿瘤免疫[28];其次T细胞上的TIGIT 与DC 表面的配体结合产生共抑制信号,减少肿瘤抗原呈递,还可通过诱导免疫抑制因子IL-10 表达升高来参与调节T 细胞驱动的免疫反应[27],并抑制T 细胞增殖和细胞因子的产生[27]。TIGIT 在多种实体瘤的CD8+T 细胞中高表达,且表达TIGIT的CD8+T细胞也表达较高水平的PD-1[8]。Manieri 等[27]研究显示,PD-1 阻断会重新激活淋巴结中的肿瘤特异性T 细胞,而与抗TIGIT 联合使用可能会增加IFN-γ的产生并杀死肿瘤细胞;将抗TIGIT和抗PD-1结合使用可使“耗竭”的T细胞在肿瘤部位再活化。Chauvin 等[12]研究也发现同时阻断TIGIT 与PD-1/PD-L1 途径可以增强CD8+T 细胞对黑色素瘤的免疫效应,改善PD-1抑制剂治疗晚期黑色素瘤患者的临床疗效[12]。
2.2 LAG-3
LAG-3为继CTLA-4/PD-1/PD-L1之后最具前景的免疫检查点,其在结构上类似于CD4受体,并以高于CD4的亲和力与Ⅱ型MHC结合[29]。在小鼠瘤模型的研究中发现,LAG-3 直接参与T 细胞稳态的调节,其负调控功能依赖于与MHCⅡ类分子的结合以及其细胞质区中KIEELE 基序的信号传导[30]。此外,galectin-3和肝窦内皮细胞凝集素(liver sinusoidal endothelial cell lectin,LSECtin)也 被 认 为 是LAG-3 配体[31],与LAG-3 结合均可以影响T 细胞的功能。Wang 等[32]研究发现,纤维蛋白原样蛋白1(fibrinogen like protein 1,FGL1)为另一种主要的LAG-3 功能配体。FGL1 能够抑制肿瘤抗原特异性T 细胞的活化,通常由肝脏低水平产生,但在一些实体瘤中高表达。肿瘤患者血浆中FGL1 水平升高与预后不良和对PD-1抑制剂的抵抗有关。因此,阻断FGL1-LAG-3相互作用以增强机体的抗肿瘤免疫效应,将为癌症的免疫治疗提供新的方向[32]。Woo 等[33]通过小鼠瘤模型证实了LAG-3 和PD-1 在肿瘤浸润淋巴细胞上的共表达,发现LAG-3/PD-1协同阻断限制了小鼠结肠癌细胞的生长,并消除80%的肿瘤[33]。
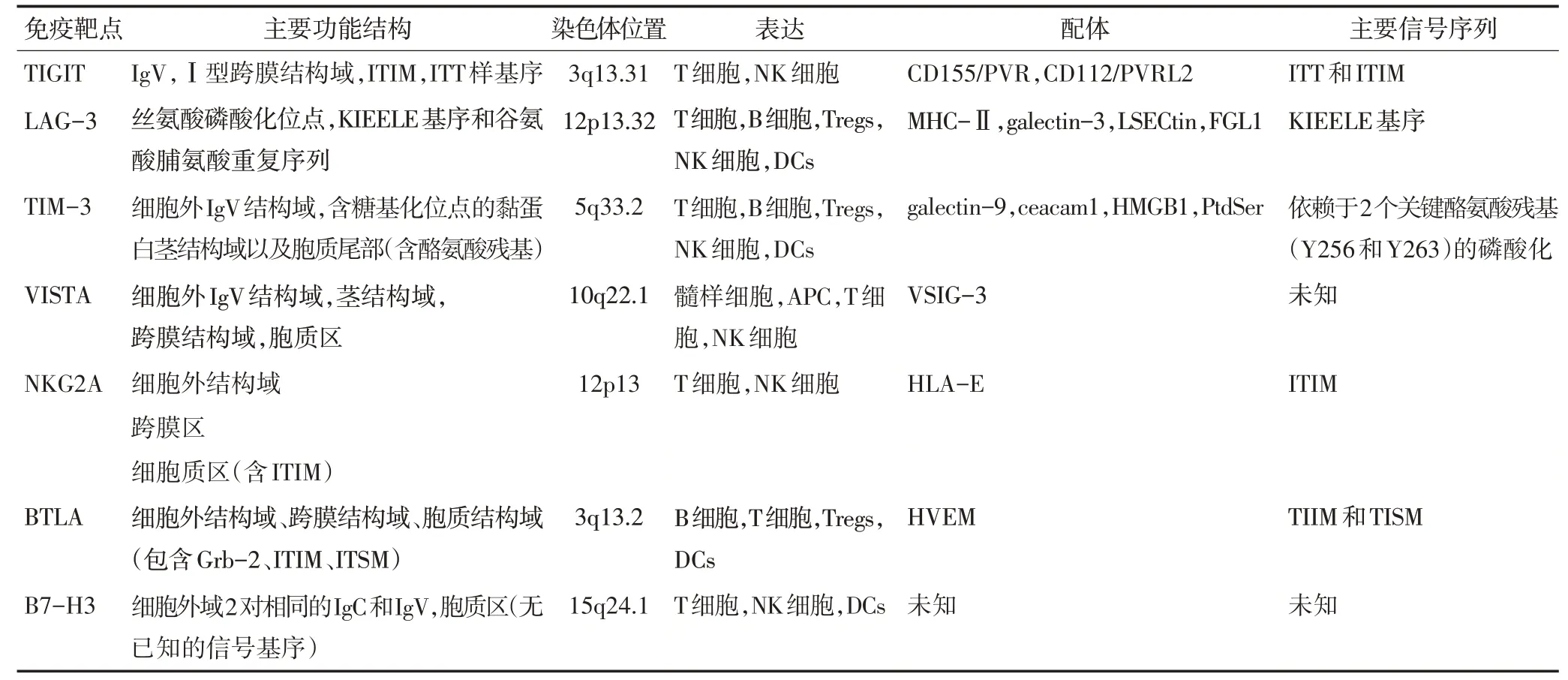
表1 抑制性免疫检查点比较
2.3 TIM-3
TIM-3是癌症免疫疗法的另一个候选靶点,首先被发现在慢性人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者“耗竭”的T 细胞高水平表达,后来被证实是T细胞衰竭的重要参与者[3]。需要注意的是,虽然TIM-3被认为是共抑制受体,但有研究发现TIM-3 也可以发挥激活T 细胞的作用[34]。Sakuishi 等[35]在实体瘤小鼠中的研究显示,TIM-3 与PD-1 在大部分肿瘤浸润性淋巴细胞(tumor infiltrating lymphocytes,TILs)上共表达,抗TIM-3 联合抗PD-L1 治疗后肿瘤生长速度显着减慢,其中50%的小鼠表现出完全的肿瘤消退,证实了TIM-3 和PD-1信号通路双重阻断的联合治疗在控制肿瘤生长方面的有效性[35]。Koyama等[36]在小鼠肺腺癌模型中证明了单独使用抗PD-1单抗治疗失败或PD-1单抗获得性耐药与TIM-3的上调有关[36]。
2.4 VISTA
VISTA 主要在APC(尤其是髓样细胞)上高表达[21]。Wang 等[37]的研究明确了VSIG-3 为VISTA 的配体,并通过VSIG-3/VISTA 途径抑制T 细胞增殖和细胞因子的产生,阻断VISTA 能减弱VSIG-3 诱导的T 细胞抑制[37]。在VISTA 单抗体处理的小鼠中也观察到肿瘤浸润性T 细胞的增殖、活化和免疫功能上调[38]。黑色素瘤鼠模型的研究显示,VISTA在任何实体瘤类型的TME 中均具有较高的水平,提示VISTA阻断疗法可能具有较为广泛的适用性[38]。另外,VISTA在酸性条件(如TME)中选择性抑制T细胞,VISTA胞外结构域的多个组氨酸残基可介导其与黏附和共抑制受体(adhesion and co-inhibitory receptor)P 选择素糖蛋白配体-1(P-selectin glycoprotein ligand-1,PSGL-1)结合,阻断这种相互作用可以逆转VISTA介导的免疫抑制作用[39]。
2.5 其他免疫靶点
2.5.1 c-Rel和NKG2A 髓源性抑制性细胞(myeloidderived suppressor cells,MDSCs)为公认的负性免疫调节物质,近期一项研究[40]提出了新的癌症免疫调节模式-转录因子c-Rel是不同于其他ICs的髓系免疫检查点,在促进MDSCs发育、功能和代谢中具有重要作用:c-Rel可增强某些特定的MDSCs标记基因的表达,MDSCs中c-Rel的缺失使肿瘤的生长和发展显著减退。向小鼠注射c-Rel抑制剂R96A显著减弱了黑色素瘤和淋巴瘤的生长,并且抗PD-1和c-Rel抑制剂的联合应用可增强抗肿瘤功能。该研究团队又通过体外培养途径进一步证实了抑制人类c-Rel可通过阻断MDSCs以达到抗肿瘤作用。c-Rel阻滞剂的相关药物临床试验目前尚未展开。NKG2A表达于NK细胞和T细胞表面,属于凝集素的NKG2家族,其胞内结构中包含2个ITIM抑制性序列。NKG2A与CD94形成异二聚体后与配体HLA-E结合导致ITIM磷酸化,再通过一系列下游信号通路抑制免疫反应[14-15]。
2.5.2 B7-H3 和BTLA B7-H3 在活化的免疫细胞中,如APC、NK和T细胞广泛表达并在多种肿瘤组织中过表达,对T 细胞活化、增殖和细胞因子产生具有抑制作用[26]。但其胞质区的主要信号通路及主要分子机制均未明确。B7-H3 的受体尚未确定,但由于B7-H3 复杂的免疫调节活性,推断其可能存在多个具有独特功能的结合伴侣[41]。BTLA 是属于CD28超家族的另一抑制性受体,与配体疱疹病毒入侵介质(herpes virus entry mediator,HVEM)结合后抑制T 细胞活性[26]。HVEM 除了与BTLA 结合以外,还可与LIGHT/LIGHT-α 和CD160 结合,分别对T 细胞活化产生刺激和抑制作用[13]。
3 ICIs相关研究进展
免疫学研究表明,在肿瘤或炎症环境中,T细胞可以共表达不同的ICs 受体,如LAG-3、TIGIT、TIM-3 及PD-1等[6],而肿瘤细胞表达多种抑制性配体,显示出双重乃至多重ICIs组合疗法的潜力,在临床前动物模型中也观察到PD-1和LAG-3、TIM-3、BTLA等的共同阻滞均可增强抗肿瘤免疫反应[33,35,42],证实同时阻断上述共表达的ICs受体可产生累加或协同作用[6]。
3.1 TIGIT抑制剂
目前,已研发出多种TIGIT抑制剂并投入到临床研究中,但均未获批上市。TIGIT 单抗tiragolumab 联合atezolizumab治疗非小细胞肺癌的CITYSCAPE研究已经取得了良好的结果,并在2020年美国临床肿瘤学会年会(ASCO)会议上进行了报道[43]。其Ⅱ期临床研究结果显示,联合组客观缓解率(objective response rate,ORR)为37.3%,明显优于对照组的20.6%,两组中位无进展生存期(median progression-free survival,mPFS)分别为5.6个月和3.9个月。另外,在PD-L1高表达(TPS≥50%)的患者中,联合组的ORR高达66%,而对照组仅为24%[43]。该研究结果有力地证明该免疫组合方案的安全性与有效性。BMS-986207也是靶向TIGIT的单克隆抗体药物,正在实体瘤患者中进行的临床试验(NCT02913313)旨在评估单药BMS-986207和BMS-986207/Nivolumab双靶点阻滞的安全性和有效性。
3.2 LAG-3抑制剂
作为备受瞩目的靶点之一,LAG-3的研究成果曾在2018年ASCO会议上被报道。在评估BMS-986016(relatlimab,LAG-3单抗)联合nivolumab治疗黑色素瘤(PD-1/PD-L1单抗治疗后进展)的研究中,观察到ORR为11.5%[44]。初步证明了此组合疗法一定程度上可以克服PD-1单抗耐药。并且TILs表达LAG-3(>1%)的患者ORR为18%,远远高于LAG-3阴性(<1%)患者的ORR为5%。提示TILs上的LAG-3表达或许可以作为临床疗效的预测生物标志物[44]。Saleh等[45]进行的一项荟萃分析探讨了LAG-3在几种癌症中的表达和预后的关系,发现LAG-3的高表达与良好的总体生存有关[45]。LAG-3单抗LAG525也于2015年启动了第一项临床试验(NCT02460224),评估了LAG525联合spartalizumab(PDR001)在晚期实体瘤中的疗效[46-47]。此外,还研发了一些双特异性抗LAG-3/PD-L1 单抗,如FS118 和MGD013[26],是否比单靶点阻滞剂效果更佳,研究结果值得期待。
3.3 TIM-3抑制剂
正在进行的TIM-3抑制剂的研究包括单靶点阻滞剂、联合疗法以及双特异性阻滞剂,TIM-3单抗SHR-1702单药或联合PD-1单抗camrelizumab治疗晚期实体瘤的研究(NCT03871855)、BGB-A425 联合PD-1 单抗tislelizumab用于晚期实体瘤(NCT03744468)的研究项目均已启动。进展较为迅速的TIM-3单抗还有TSR-022。TSR-022联合TSR-042,PD-1单抗(dostarlimab)治疗原发性肝癌(NCT03680508)以及用于黑色素瘤的新辅助治疗(NCT04139902)的试验也已展开。Sym023也是针对TIM-3的抗体,评估其安全性、耐受性和剂量限制毒性的Ⅰ期试验(NCT03489343)正在进行中[48]。
3.4 其他ICIs
enoblituzumab(MGA271)是针对B7-H3的人源化IgG1单克隆抗体,已在Ⅰ期临床试验(NCT01391143)中显现出良好的耐受性[49],评估enoblituzumab 与pembrolizumab 联合治疗难治性肿瘤的安全性研究(NCT02475213)已经启动。MGD009是针对T细胞上CD3和肿瘤细胞上B7-H3的双特异性抗体,MGD009/MGA012联合治疗复发/难治性癌症的研究(NCT03406949)目前正在进行中[16]。
目前,多种针对VISTA的单抗,如JNJ-61610588、CA-170和HMBD-002等已经研发上市并逐步进入临床研究。其中CA-170是选择性地靶向PD-L1和VISTA的口服小分子制剂,针对晚期实体瘤和淋巴瘤患者口服CA-170的Ⅰ期临床试验(NCT02812875)正在进行中[50]。抗NKG2A抗体monalizumab通过释放T细胞和NK细胞来促进抗肿瘤免疫能力[51],评估monalizumab与西妥昔单抗联合用于头颈部鳞状细胞癌(NCT02643550)、以及与durvalumab 联合用于微卫星稳定的结直肠癌(NCT02671435)的研究结果均显示出一定疗效[51],但仍处于初级阶段,需要进一步研究和探索。
4 结语
肿瘤的免疫治疗历经了漫长的发展过程,PD-1/PDL1及CTLA-4单抗的研发具有里程碑式意义,且临床应用日渐趋于成熟,但其局限性也逐渐显现,组合免疫疗法显现出一定的优势,同时也面临着诸多挑战,PD-1/PD-L1及CTLA-4单抗的研发具有重要意义且临床应用逐渐趋于成熟,但其局限性也逐渐显现,组合免疫疗法显示出一定的优势,同时也面临着诸多挑战。随着研究不断深入,许多新靶点仅新药物层出不穷。然而,上述新兴免疫治疗靶点相关的研究均处于早期阶段,并且新靶标的生物学基础较为复杂,尚未完全了解其生物学特性及相关信号通路,对新型药物的研究和临床治疗方案组合所起的作用。此外,肿瘤预测性生物标记物的重要性也需关注,这对于筛选受益人群具有重要意义。
