口蹄疫兔化弱毒疫苗ZBatt株与其亲本强毒株生物学特性的比较研究
2020-11-18朱明旺王继华高华峰刘绍阳彭正啓信爱国
朱明旺,王继华,高华峰,刘绍阳,彭正啓,信爱国
(1.云南省兽医生物制品研制中心,保山 678000;2.云南省畜牧兽医科学院 国家口蹄疫专业实验室(昆明),昆明650224;3.云南省畜牧兽医科学院 云南省热带亚热带动物病毒病重点实验室,昆明 650224)
口蹄疫(foot-and-mouth,FMD)是由口蹄疫病毒(Foot-and-mouth disease virus,FMDV)引起,侵袭猪、牛、羊等偶蹄动物的急性、热性、高度接触性传染病。该病传播速度快、流行范围广,病毒可通过接触易感动物和空气传播,易感动物接触病毒后2~3 d产生临床症状,并能够持续7~10 d,发病率为100%,幼畜经常不见症状而猝死,死亡率因病毒株而异,严重时可达100%。FMDV目前已知有7个不同的血清型(A、O、C、Asia 1和南非1、2、3型),在每个血清型内存在多种亚型,不同血清型间无交叉免疫性。FMD流行具有明显的地域性[1],Asia 1型FMD是第7个被确认的血清型[2],目前主要流行于南亚及东南亚地区[3-4]。
1958年4月云南省保山地区发生疑似FMD疫情,从病样中分离到1株FMDV,命名为中国保山型,简称“中保型(ZB型)”[5]。1980年代,采用来源于世界FMD参考实验室(WRLFMD,英国Pirbright实验室)的标准血清,确定云南分离ZB型FMDV为“Asia 1”型[5-6]。1958年底,研究者开始将ZB野生强毒株接种3~5日龄乳兔进行继代培育,研发FMD兔化弱毒疫苗。病毒传至第50代、64代,回归牛体致病明显;传至第109代,回归牛体毒力减弱,114代减毒株于健康牛舌面粘膜穿刺接种,进行牛体安全试验,证明只有极少数牛在舌面注射部位发生少量原发性小水疱,不产生二期水疱;同居牛不感染;回归牛体继代4~6代不增强其致病力(赖天才:口蹄疫Asia 1型兔化毒的研究,1981年,内部资料)。结果获得了ZB株(血毒系)致弱毒株,其致病力和免疫原性达到口蹄疫弱毒疫苗的标准。该弱毒疫苗是采集发病乳兔肌肉和脏器,研磨后用pH7.6的磷酸盐缓冲液稀释至1%,取1 mL接种牛体,可以产生良好的免疫保护效果,免疫持续期可达半年以上,1960-1980年曾用于云南省澜沧江以西地区Asia 1型口蹄疫的免疫防治(内部资料)。
由于FMD常规减毒活疫苗在使用过程中发现在假定宿主内致弱的毒株对别的易感宿主具有致病性,存在弱毒疫苗株毒力返祖风险[7-8]。减毒疫苗在使用过程中仍然具有潜在的回复突变可能性,因此该兔化弱毒疫苗株ZBatt现已停止使用。比较ZBatt与其亲本强毒株的生物学特性差异,可为深入研究ZBatt株减毒致弱机理提供毒力评价依据。本研究测定了ZBatt株和其亲本强毒株感染不同来源的细胞的病变效应,病毒对乳鼠、豚鼠的致病情况,比较了强毒株和弱毒株分别感染宿主细胞后几个宿主因子mRNA表达差异,分析ZB强毒株和弱毒株的部分生物学表型差异,为评价病毒毒力差异的替代模型提供依据。
1 材料与方法
1.1 病毒株、细胞株、实验动物口蹄疫亚洲1型细胞组织培养弱毒ZB/CHA/58(att)(简称ZBatt)(GenBank登录号:DQ533483)[5],由云南省畜牧兽医科学院保存,系本室保存的“ZB”型兔化弱毒ZBRF187代适应BHK-21细胞后保存备用;强毒株ZBCF222系牛舌皮组织毒适应BHK-21细胞3代备用,由云南省兽医生物制品研制中心(原口蹄疫保山疫苗厂)保存[9];BHK-21细胞为本实验室细胞库冻存;牛原代肾细胞和睾丸细胞由课题组制备;试验用乳鼠和豚鼠由云南省兽医生物制品研制中心提供。
1.2 病毒对不同细胞的敏感性比较将弱毒株ZBatt和强毒株ZBCF222分别接种3种传代细胞系(BHK-21、IBRS-2和PK)和牛原代肾(BK)细胞、牛原代睾丸(BT)细胞,观察病毒致细胞病变效应(cytopathic effect, CPE)。
1.3 病毒对不同细胞的蚀斑形态比较将弱毒株ZBatt和强毒株ZBCF222稀释成10-3、10-4、10-5,取0.2 mL分别接种于长满单层BHK-21和BK细胞的24孔培养基中,每个稀释度接种2孔,吸附1 h。将4×MEM与1.5%甲基纤维素以1:3的比例混合后加入2%血清和双抗,充分混合配制病毒蚀斑覆盖层,按照1 mL/孔加入到细胞板中。37℃、5% CO2恒温培养箱培养观察;48 h后,吸弃培养基中覆盖液后加入结晶紫染色液500 μL/孔染色,室温静置30 min,洗去培养基中染色液,室温干燥,观察蚀斑结果。
1.4 病毒生长曲线测定首先测定弱毒株ZBatt和强毒株ZBCF222的TCID50备用。分别将病毒稀释成100TCID50/0.1 mL,各取0.2 mL分别接种12孔板中长满单层BHK-21细胞和BK细胞,每个稀释度接种3孔。在接种后预定的时间点分别收获病毒,测定其TCID50,绘制病毒生长曲线。
1.5 病毒对乳鼠的生存曲线测定将ZBatt株和株ZBCF222分别稀释为1TCID50/0.1 mL、0.1TCID50/0.1 mL和0.01TCID50/0.1 mL。选用3日龄乳鼠,随机分为3组,每组8只,按200 μL/只依次接种3个稀释度的病毒,注射后连续观察7 d;记录每组乳鼠的死亡数量和死亡时间,绘制乳鼠生存曲线。
1.6 病毒对豚鼠致病性观察按照常规方法分别测定弱毒株ZBCF222和强毒ZBatt株的乳鼠LD50。分别用500LD50和1000LD50剂量,每只豚鼠在左后脚趾部皮内接种0.2 mL病毒液,逐日观察豚鼠发病情况,记录结果。
1.7 病毒感染BK细胞宿主因子mRNA相对表达量测定研究表明,野生型FMDV毒株和L蛋白缺失减毒株感染牛源宿主细胞后,诱导宿主天然免疫反应差异基因表达上调,主要与干扰素诱导基因、趋化因子和转录因子相关[10]。据此,ZB强毒株和弱毒株感染BK细胞后,选择测定与之相关的CCL2、IFN-β、ISG15、Mx1、OAS和PKR宿主因子相对定量表达水平,用于解析可能与ZB病毒致弱相关的宿主因子和信号通路。扩增ZB株3D基因片段的荧光定量引物[11]和6种宿主因子荧光定量引物[10]信息详见表1。引物由生工生物工程(上海)股份有限公司合成。分别取0.2 mL 100TCID50/0.1 mL的强毒株ZBCF222和弱毒株ZBatt接种12孔板中长满单层的牛原代肾(BK)细胞,每个稀释度接种2孔。在接种后第12 h和24 h分别收获病毒,测定病毒RNA的相对复制量和6种细胞宿主因子的mRNA相对表达量。试验独立重复2次。
1.8 实验数据处理分析实验数据以x±SD表示, 经统计软件Graphad Prism(Version 5.01)处理分析和图像呈现。采用方差分析进行统计分析,P<0.05表示差异显著,具有统计学意义。
2 结果
2.1 病毒感染不同细胞系的敏感性比较兔化弱毒株ZBatt和野生强毒株ZBCF222分别接种BHK-21细胞,经24 h培养观察,光镜下均可看到有点状细胞脱落、细胞变圆和核浓缩等现象,细胞产生典型的CPE。感染IBRS-2和PK细胞后,培养72 h均未见明显的CPE,只是有一些不规则、散在的圆形细胞浮在正常细胞的上面;盲传至第3代也没有出现CPE,表明IBRS-2和PK细胞对ZB病毒感染不敏感。ZBatt株和ZBCF222株分别感染牛原代BK细胞和牛原代BT细胞,72 h后观察到强毒株ZBCF222感染能够导致细胞产生CPE,而弱毒株ZBatt感染则不能产生CPE,表明ZBCF222对天然宿主来源细胞具有致病性,而ZBatt则呈现减毒表型。本研究在体外培养细胞上证实使用ZBatt减毒株制备弱毒疫苗的可靠性(图略)。
2.2 病毒感染不同细胞的蚀斑形态比较观察比较兔化弱毒株ZBatt和强毒株ZBCF222病毒在BHK-21细胞和BK细胞中的蚀斑形态,结果显示二者在BHK-21细胞上均可产生明显的CPE,形成大小相似的蚀斑;而在牛原代肾细胞上,强毒株ZBCF222病毒可以产生明显的蚀斑,而弱毒株ZBatt病毒则无明显的蚀斑形成(图1),表明ZBCF222病毒感染牛原代细胞,而减毒株ZBatt对牛源细胞不具有感染性。
2.3 病毒对乳鼠及豚鼠的致病性试验结果按照常规方法,分别将ZBCF222和ZBatt病毒接种3~5日龄乳鼠,测定的其半数致死量(median lethal dose,LD50)。结果ZBCF222和ZBatt的LD50分别为10-7.3/0.2 mL和10-9.0/0.2 mL。

表1 本研究使用的引物Table 1 Primers used in this study
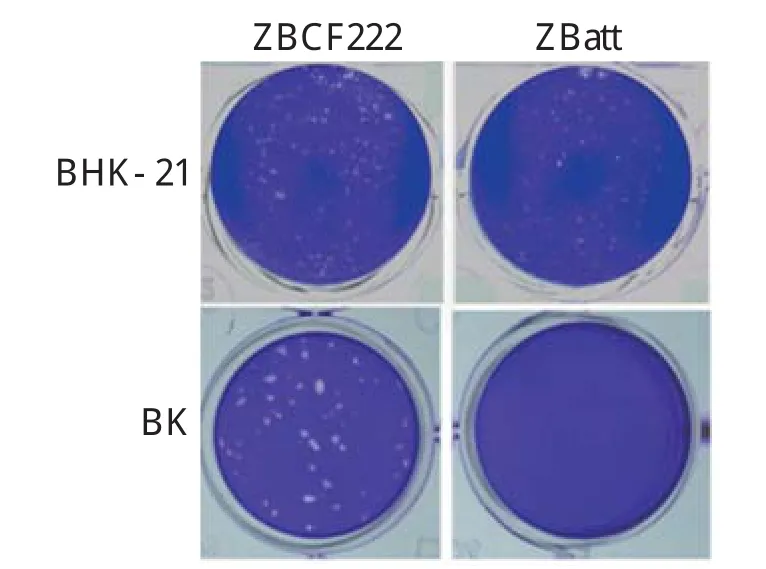
图1 ZBatt株和ZBCF222株感染BHK-21和牛原代肾细胞(BK)蚀斑形态比较Fig.1 Plaque morphology of the ZBatt and ZBCF222 strain in BHK-21 or BK cells
将ZBatt和ZBCF222分别接种乳鼠,测定病毒对乳鼠的生存曲线。结果显示,1TCID50/0.1 mL高剂量组接种乳鼠24 h后,乳鼠出现典型的呼吸困难、后肢麻痹等症状,开始出现死亡,ZBatt在接种36 h致乳鼠全部死亡,ZBCF222在接种48 h后致乳鼠全部死亡(图2A);ZBatt对乳鼠的致病性强于ZBCF222(P<0.05)。中剂量组(0.1TCID50/0.1 mL),ZBatt 36 h后乳鼠有死亡,48 h全部死亡;而ZBCF222至7 d观察结束时乳鼠的生存率为70%,ZBatt对乳鼠的致病力显著强于ZBCF222(P<0.001)(图2B);低剂量组(0.01TCID50/0.1 mL),7 d试验观察期内乳鼠全部健活,二者无差别(图略)。结果表明兔化弱毒株ZBatt对乳鼠的致病性高于野生型强毒株ZBCF222。
利用豚鼠作为小动物试验模型,比较ZBCF222和ZBatt的毒力差异。结果表明,低剂量500LD50/0.2 mL组,ZBCF222接种豚鼠后2~3 d发病,观察到豚鼠精神萎糜,不愿活动,食欲减少或废绝,口角污秽不洁,流涎,产生继发感染,趾部产生继发水疱,皮肤脱离(图3),发病率20%;ZBatt接种豚鼠均无明显临床症状出现。高剂量组(1000LD50/0.2 mL),接种ZBCF222后,豚鼠出现典型的临床症状,产生严重的继发感染,发病率为100%;接种ZBatt后豚鼠不表现临床症状(表2)。结果表明野生型强毒株ZBCF222对豚鼠具有强的致病性,兔化弱毒株ZBatt对豚鼠呈现减毒表型。结果与ZBCF222和ZBatt对牛体的致病表现具有一致性,判断豚鼠可作为ZB强毒株和弱毒株的毒力差异比较的试验动物。
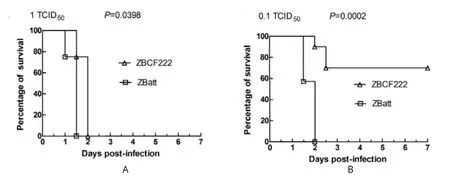
图2 强毒株ZBCF222和弱毒株ZBatt接种乳鼠存活率比较结果Fig.2 Survival rate of suckling mice after challenge of ZBCF222(A) and ZBatt(B)
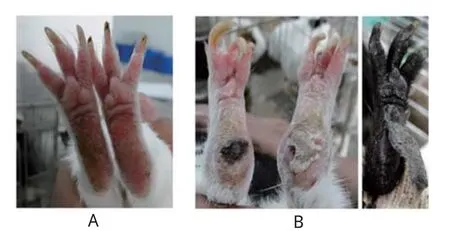
图3 弱毒株ZBatt(A)和强毒株ZBCF222(B)接种豚鼠发病图Fig.3 Pathological map of guinea pig inoculated with attenuated ZBatt(A) and virulent ZBCF222 strain(B)
2.4 病毒生长曲线测定结果ZBatt和ZBCF222的病毒效价分别为10-6.0TCID50/0.1 mL和10-5.8TCID50/0.1 mL。分别将病毒稀释成100TCID50/0.1 mL,接种BHK-21和BK细胞,在预定时间点收获病毒,测定其TCID50,绘制病毒生长曲线。结果显示ZBCF222和ZBatt在BHK-21细胞上具有相似的增殖特性(图4A)。ZBCF222感染BK细胞后,病毒能够增殖复制至36 h,效价为10-5.5TCID50/0.1 mL;而ZBatt感染BK细胞后,病毒不增殖,兔化弱毒株ZBatt和野生强毒株ZBCF222在BK细胞上的病毒增殖特性差异显著(P=0.008)(图4B)。
2.5 病毒感染BK细胞诱导宿主因子mRNA相对定量结果将ZBCF222和ZBatt感染BK细胞后,分别收获12 h和24 h病毒液,测定病毒RNA复制量及细胞中宿主因子mRNA相对表达量,结果见图5。ZBCF222和ZBatt感染BK细胞后,6种宿主因子CCL2、IFN-β、ISG15、Mx1、OAS和PKR的相对表达变化差异均不明显,表明ZB株强弱病毒与宿主相互作用对这6个宿主因子影响不显著。病毒感染BK细胞后,ZBCF222病毒RNA复制量(P=0.004)高于ZBatt病毒RNA复制量,差异显著,具有统计学意义。结果表明,ZBCF222能够在天然来源宿主细胞中复制,而ZBatt复制效率差,这种复制效率差异与选择测定的6种宿主因子mRNA相对定量表达水平不相关。

表2 ZB强弱毒株接种豚鼠试验结果Table 2 The results of injection virulent or attenuated ZB viruses in guinea pigs
3 讨论
本研究比较了亚洲1型FMD兔化弱毒疫苗株ZBatt和其亲本强毒株ZBCF222的部分生物学特性。结果显示,二者感染BHK-21后具有相似的致病性、病毒复制和RNA增殖特性,形成蚀斑形态大小相似,并且二者均对IBRS-2和PK细胞不敏感。但强毒和弱毒感染天然宿主来源的原代细胞则存在明显的致病性差异,强毒株能导致BK细胞产生典型细胞病变,形成明显可见蚀斑形态,病毒生长曲线和RNA复制效率测定也证明这一特性;而兔化弱毒株感染BK细胞不产生CPE,也不产生明显可见的蚀斑形态,病毒增殖效果不明显。结果表明,兔化弱毒株ZBatt对天然宿主细胞呈现减毒特征,在细胞水平上证明其作为减毒活疫苗使用的安全性。
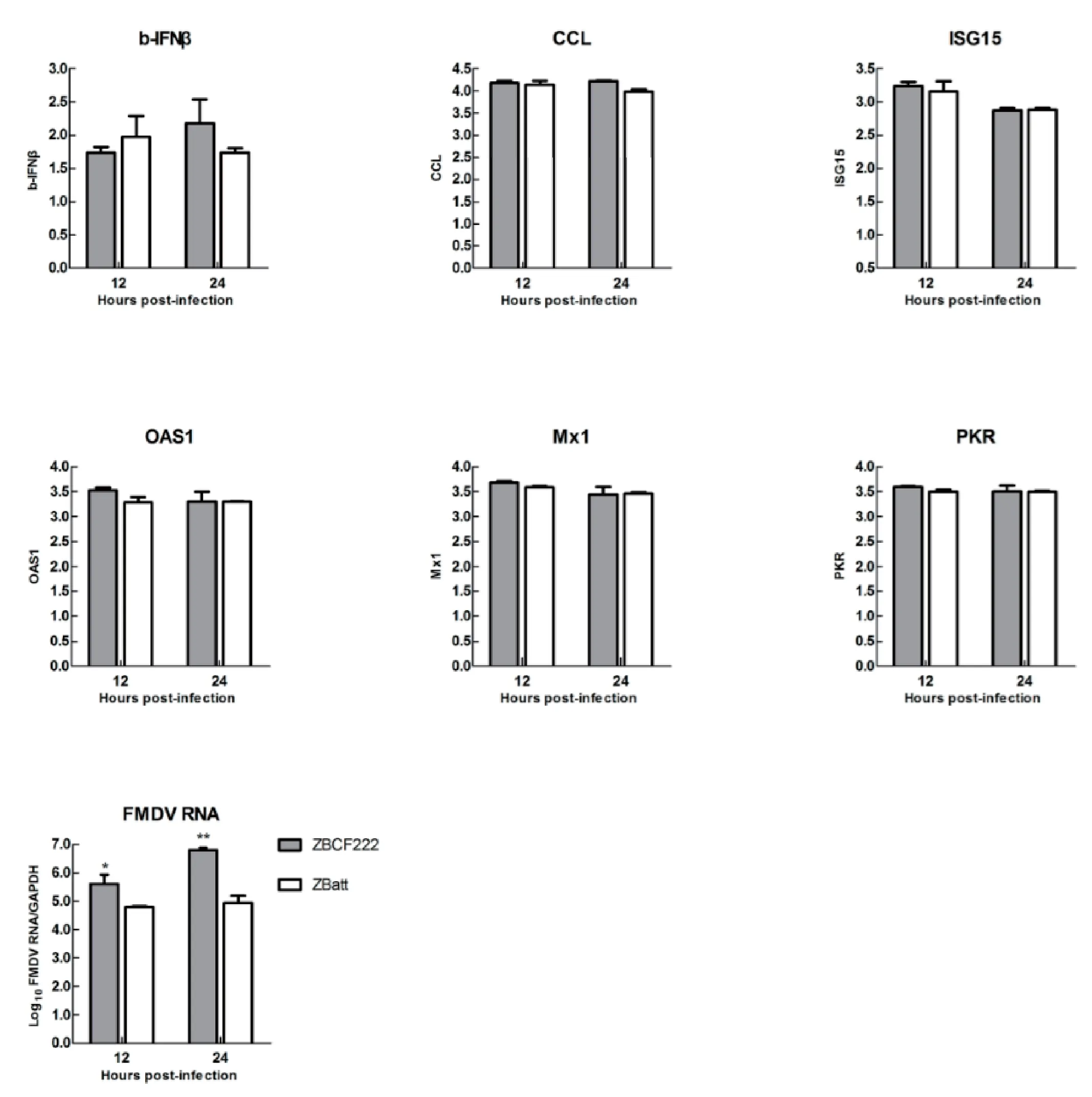
图5 ZBCF222和ZBatt株感染牛原代肾细胞后病毒RNA复制及宿主因子差异表达结果Fig.5 Viral RNA and host factors replication levels in BK cells at desired time points post-infection with ZBCF222 strain or ZBatt strain
在FMDV的研究中,乳鼠是敏感的试验动物,常用于FMDV病毒分离、毒力测定等实验[12]。本研究中ZB病毒对乳鼠致病性试验表明,兔化弱毒株ZBatt对乳鼠的致病性明显强于野生型亲本强毒株,结果与病毒在牛体试验结果截然相反。分析其原因,可能与病毒本身的特性有关,或者是弱毒株在乳鼠体内有继代适应情况,或许还与所使用的乳鼠品系有一定的关系[12]。回顾ZB病毒继代培育过程和疫苗生产记录,减毒后ZB病毒对温度的敏感性增强,温度对病毒的存活及致病性的影响大,减毒病毒对乳鼠的LD50虽然相对偏低,但其LD50明显高于其亲本强毒株(内部资料)。本研究采用相同剂量测定病毒对乳鼠的生存率,结果与之相同。因此,乳鼠不适合作为实验动物模型用来评价ZB株致病性差异。
豚鼠是口蹄疫研究中常用的实验动物。虽然新生乳鼠对FMDV高度敏感,成年鼠、仓鼠也对FMDV敏感,但发病似乎没有豚鼠规律[12]。试验表明,豚鼠感染FMDV可引起规律性、典型性发病,豚鼠可作为FMD抗体检测、临床症状及病理观察实验动物模型,用于口蹄疫疫苗免疫效力评价[13-14]。Asia 1型FMDV疫苗免疫豚鼠后,其抗体水平随免疫剂量的增加而升高,同源病毒攻毒时的抗体水平与保护力呈正相关,豚鼠可替代作为实验动物牛用于灭活疫苗效力检验[15]。本研究利用豚鼠作为实验动物比较ZB病毒强弱毒株毒力差异,结果提示ZB强弱毒株对豚鼠的致病性与病毒对天然宿主的致病性一致,证明可以用豚鼠作为实验动物模型比较不同ZB株的毒力差异。
FMDV Lpro缺失突变致弱毒株与野生型病毒感染牛源宿主细胞后,差异表达相关的宿主因子CCL2、IFN-β、ISG15、Mx1、OAS和PKR等,这些因子主要与干扰素诱导基因、趋化因子和转录因子相关[10]。本研究比较测定了这6种由FMDV Lpro缺失导致的表达差异基因,目的是从病毒-宿主相互作用关系角度,寻找与病毒致病性差异相关的宿主因子。结果表明,ZB病毒强弱毒株感染BK细胞后,这6种宿主因子mRNA相对定量表达差异不明显。之前我们比较了ZB病毒致弱前后病毒全基因组发现,在病毒Lpro编码区,仅存在3个氨基酸(N2D、M143L和E147G)差异[16],利用ZBatt株反向遗传操作系统构建的Lpro嵌合病毒证明这3个氨基酸突变与ZBatt减毒表型不相关[17]。因此,本研究中发现这6个宿主因子表达差异不显著,与FMD病毒Lpro突变对病毒毒力改变影响不显著相关。提示有必要进一步分析FMDV强弱毒株感染天然宿主细胞引起的mRNA复制和蛋白差异表达情况,寻找强弱毒株感染相关宿主因子变化情况。
综上所述,FMD兔化弱毒株ZBatt与其亲本强毒株对天然来源宿主细胞存在致病性差异,豚鼠可作为替代牛实验动物用于ZB病毒毒力差异评价。
