NOX4在结肠癌组织中的表达及与预后的关系
2020-11-16刘恒昌魏然李春香刘正陈海鹏关旭赵志勋邹霜梅王锡山姜争
刘恒昌 魏然 李春香 刘正 陈海鹏 关旭 赵志勋 邹霜梅 王锡山 姜争
结肠癌是常见的消化道恶性肿瘤,其发病率为13.82/10万,其发病率和死亡率均位于所有恶性肿瘤前列[1-2]。结肠癌的预后与TNM分期密切相关,我国结肠癌患者在就诊时多处于局部进展期,尽管目前放疗、化疗、免疫治疗等治疗手段多样,但总体预后仍较差[3]。因此,研究肿瘤发展机制,并寻找有效的治疗靶点,仍是目前研究的重点。NADPH氧化酶4(NOX4)作为NOX家族表达最频繁的亚型,是产生活性氧(ROS)的主要来源,而高水平的ROS具有诱导细胞恶变的能力[4-6]。NOX4已经在前列腺癌、肝癌等多种实体瘤中被发现呈高表达[7]。但在结肠癌中的表达情况与对预后的影响尚不清楚。本研究旨在观察结肠癌组织中NOX4的表达情况,并探讨其与结肠癌预后的关系。所有患者均在随访时获得口头同意或签署知情同意书。
1 材料与方法
1.1 一般资料
收集2015年1月—12月就诊于中国医学科学院肿瘤医院结直肠外科,行手术治疗的80例患者的结肠癌组织及对应的距肿瘤边缘2 cm以上的正常肠粘膜上皮组织石蜡标本。男性47例,女性33例,平均年龄(67.4±11.4)岁。纳入标准:(1)术前活检病理检查确诊为结肠癌;(2)原发性结肠癌;(3)围术期未发生影响术后化疗的严重并发症;(4)临床、病理资料完整。排除标准:(1)术前行新辅助化疗、免疫治疗等;(2)曾患其它恶性肿瘤;(3)根据病理结果应行辅助化疗,但患者本人拒绝;(4)随访信息不完整。本研究经过本院伦理委员会审查通过(NCC2016JZ-06)。
1.2 生物信息学分析方法
在癌症和肿瘤基因图谱(TCGA)数据库中获取结肠癌COAD数据集,共521例组织学样本的基因转录组数据(截至2019年11月15日),其中结肠癌组织480例,癌旁正常组织41例。下载HT-Seq文件(具有与每个蛋白质编码基因对齐读数的文件)和FPKM-UQ文件(具有每千碱基对齐的片段数的文件)。本研究使用GEPIA2交互式WEB服务器分析TCGA项目的RNA测序表达数据,用于批量数据处理和可视化。
通过基因集富集分析(GSEA)探索NOX4在结肠癌中的潜在机制。根据基因表达情况,将样本分为NOX4高表达组和低表达组。用致癌特征基因组(v6.2)和KEGG基因集(http://software.broadinstitute.org/gsea/msigdb/collections.jsp)作为参考,分析表达谱并找出一组基因在NOX4高表达组(或低表达组)中是否大部分上调(或下调)。结果中的基因组P<0.05以及FDR<0.25被认为有统计学差异。
1.3 免疫组织化学法
应用免疫组织化学法(S-P法)观察组织中NOX4的表达。标本进行常规福尔马林固定、石蜡包埋,切成5 μm厚切片,铺片。将切片置于60℃烤箱中过夜,用二甲苯进行3次脱蜡,每次15 min。依此用100%、100%、95%和95%的酒精浸泡,每次15 min,后用流水冲洗5~10 min。室温下置于10%双氧水中10 min,取出后用PBS冲洗2次,每次1~2 min。95℃微波抗原修复30 min,取出后恢复至室温,PBS冲洗2次,每次5 min。室温下用血清封盖标本30 min,将血清甩去后,将NOX4一抗(工作浓度1∶300)均匀涂在载玻片上,4℃孵育过夜。用PBS冲洗3次,每次3~5 min,浸入相应的生物素化二抗孵育30 min,再次用PBS冲洗3次,每次3~5 min。使用3,3′-二氨基联苯胺(DAB)室温孵育15 min,用PBS冲洗3次,每次3~5 min,DAB显色,封片。
结果判读:NOX4主要在细胞质中表达,呈棕黄色,用0~3分分别表示染色强度:无染色,淡黄色,棕黄色和黄褐色。200×倍镜下选择3个互不重叠视野,计数视野内染色阳性细胞数占比,用0~4分分别表示阳性细胞数:无阳性细胞,≤10%,11~50%,51%~74%,≥75%。将两项得分相乘,≤3分为低表达,>3分为高表达。
1.4 随访方法
所有患者均采用电话或门诊随访。随访内容包括肿瘤复发日期、死亡日期、死亡原因。肿瘤复发以2项以上影像学检查结果阳性或病理学结果阳性为主要依据。末次随访时间为2019年12月20日。总生存期(OS)定义为患者自接受手术次日至死亡或末次随访的时间。无病生存期(DFS)定义为患者自接受手术次日至首次确诊肿瘤复发/转移或末次随访的时间。
1.5 统计学方法
用SPSS 24.0软件和R 3.3.3进行统计分析,计量资料的比较使用独立样本t检验和单因素方差分析,并使用Tukey检验对数据进行多重比较。χ2检验或Fisher精确检验用于评估不同组之间比率的差异。使用Kaplan-Meier法绘制生存曲线,并通过Log-rank检验比较DFS和OS曲线。将单因素分析结果有统计学意义的变量纳入多因素Cox比例风险回归中,用于确定结肠癌患者的预后因素。建立了诺模图模型用于预测结肠癌患者的OS。此外,在验证队列中对预测模型的性能进行验证。P<0.05为差异具有统计学意义。
2 结果
2.1 NOX4在结肠癌组织中的表达
NOX4主要表达在结肠癌细胞质中,呈棕黄色染色,在正常肠粘膜上皮组织中表达较低(图1)。80例结肠癌组织中,69例(86.25%)高表达;80例正常肠粘膜上皮组织中,6例(7.50%)高表达,其中4例在结肠癌组织中也呈高表达。NOX4在结肠癌中的高表达率显著高于正常肠粘膜组织(P<0.01)。将所有患者根据免疫组化结果分为NOX4高表达组和低表达组,NOX4高表达组患者淋巴结阳性(N+)所占比例显著高于NOX4低表达组(P<0.001)(表1)。
对TCGA数据库中COAD数据集的转录组数据进行分析,发现NOX4在结肠癌组织中显著高于正常组织(P<0.05);在病例配对比较中,NOX4在结肠癌组织中的表达结果也远高于配对的41例癌旁正常组织(P<0.05);NOX4的表达随着分期的升高而增加(P<0.05)。根据NOX4表达的中位数,将所有病例分为NOX4高表达组和低表达组,Kaplan-Meier生存曲线结果提示,NOX4高表达组的DFS以及OS均显著低于NOX4低表达组(P<0.05)(图2)。
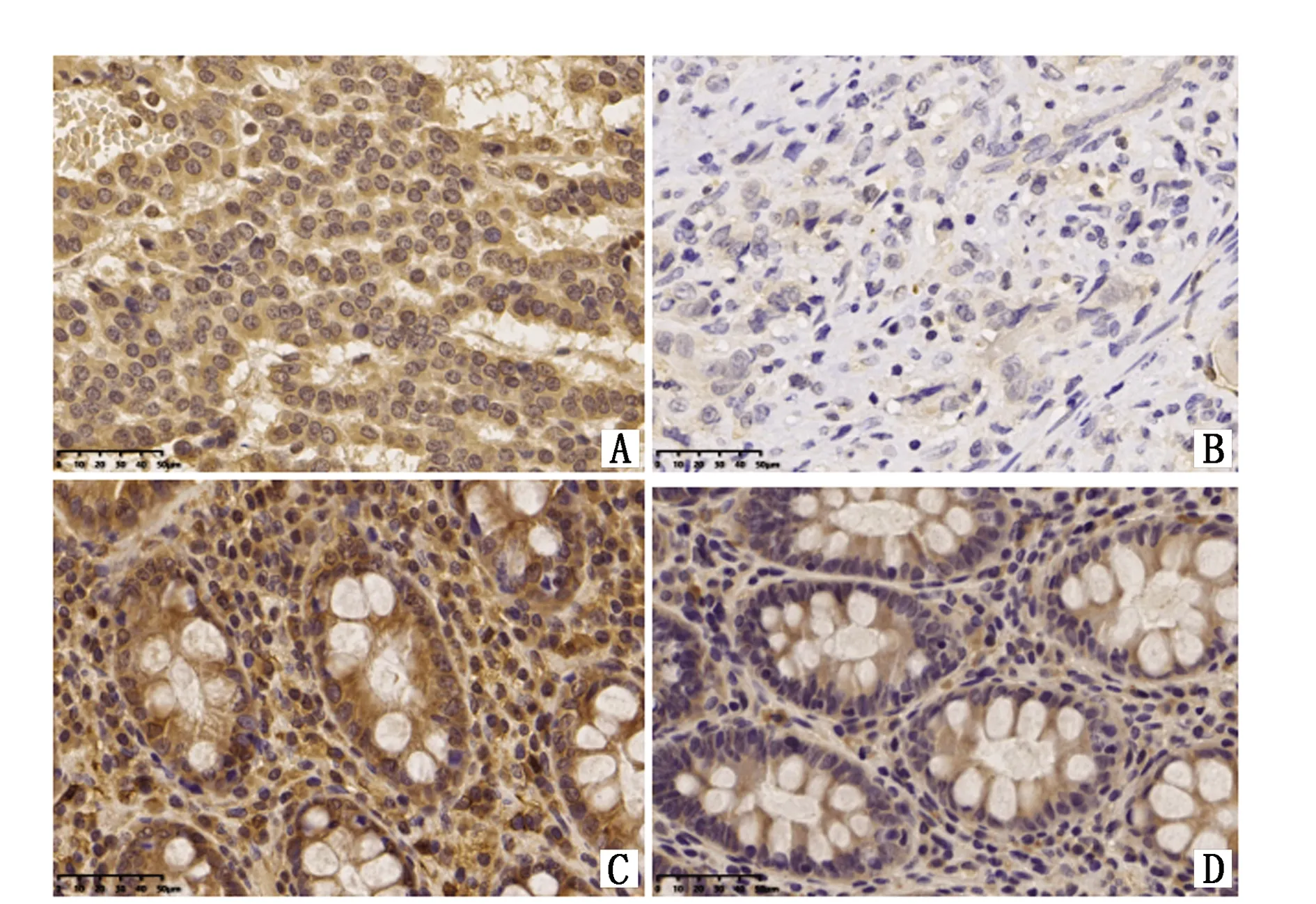
图1 NOX4在结肠癌组织和正常肠粘膜上皮组织中的表达(200×)Figure 1 Expression of NOX4 in colon cancer tissues and normal intestinal mucosa tissues(200×)Note:High expression(A)and low expression(B)in colorectal cancer tissues;High expression(C)and low expression(D)in normal intestinal mucosa tissues.

表1 NOX4的在结肠癌组织中的表达与临床资料的关系

图2 TCGA数据库中NOX4的表达Figure 2 Expression of NOX4 in TCGA databaseNote:A.Cancer tissues and normal tissues;B.Matched cancer tissues and normal tissues;C.Expression of NOX4 in different stages;D.Disease free survival(DFS)in high and low NOX4 expression groups;E.Overall survival(OS)in high and low NOX4 expression groups.
2.2 NOX4基因的功能富集分析
KEGG信号通路分析结果表明,NOX4可能参与T细胞以及B细胞激活相关信号通路调控,并且参与JAK-STAT、MAPK、TGFβ和WNT等肿瘤相关信号通路的调控。通过GO富集分析表明,NOX4和白介素-1和白介素-6的产生以及分泌有关,并且参与趋化因子-趋化因子受体相互作用,提示NOX4可能与肿瘤侵袭、迁移以及免疫调控有关(图3)。

图3 NOX4基因功能富集分析Figure 3 Functional enrichment analysis of NOX4Note:A.The results of Kyoto Encyclopedia of Genes and Genomes(KEGG);B.The results of Gene Ontology(GO).
2.3 基于NOX4的预后预测模型的建立
将TCGA数据集定义为训练队列,我院病例定义为验证队列。在训练队列中进行单因素Cox回归分析发现,年龄、N分期、M分期、术后化疗以及NOX4的表达情况可能是影响结肠癌患者OS的危险因素;将上述因素纳入多因素Cox回归分析中,发现年龄、N分期、M分期、术后化疗以及NOX4的表达是影响结肠癌患者OS的独立危险因素(表2)。应用这些独立变量建立预测3年和5年OS的列线图(图4)。该列线图在训练队列的C指数为0.735,在验证队列的C指数为0.708。校正曲线表明该列线图具有较好的预测效能。ROC曲线下面积(AUC)分别为0.769(3年)和0.742(5年)(图5)。
根据列线图,中位风险评分为165名,训练队列和验证队列的患者,高于165分归为高危组,低于165分归为低危组,Kaplan-Meier曲线显示两组患者的OS有统计学差异(图6)。

图4 预测结肠癌患者OS的列线图Figure 4 The nomogram for predicting OS in patients with colon cancer

表2 影响结肠癌OS的单因素及多因素分析

图5 列线图校准曲线及ROC曲线Figure 5 The calibration curve and ROC curveNote:Three years(A)and five years(B)OS calibration curve of training cohort;Three years(C)and five years(D)ROC curve of training cohort.

图6 不同预后风险得分对OS的影响Figure 6 Effect of different prognostic risk scores on OSNote:A.Training cohort;B.Verifying cohort.
3 讨论
氧化应激在肿瘤的发生和发展过程中起到十分重要的作用。NOX4作为NADPH的底物,研究发现其可以产生H2O2,进而产生大量的活性氧,这些活性氧对DNA转录以及蛋白质氧化方面起到破坏作用,从而使细胞发生恶变[8]。近期研究结果提示,NOX4可以促进胃癌细胞生长并抑制其凋亡[9]。但在结肠癌中尚无相关研究。
本研究通过在TCGA数据库和我院结肠癌术后病理标本中分别验证了NOX4在结肠癌中的表达情况,两个队列的结果类似,均发现NOX4在结肠癌组织中的表达显著高于正常肠粘膜组织。在TCGA队列中,我们还发现其表达量随着TNM分期的升高而升高。这与NOX4在多种实体肿瘤中的表达趋势类似[10-12]。进一步分析其表达与预后的关系发现,NOX4高表达的患者预后更差。而对影响结肠癌患者预后进行多因素分析结果也提示NOX4是预后较差的独立危险因素。上述结果均提示NOX4在结肠癌中可能具有促进肿瘤发展的作用。
关于NOX4在结肠癌中的生物学功能,目前相关研究较少。我们利用生物信息学方法分析了与NOX4相关的信号通路以及蛋白、趋化因子等,发现NOX4可能参与了多种肿瘤相关的信号通路的调控,除此之外,NOX4还与T细胞及B细胞激活相关信号通路调控有关,并且参与了IL-1和IL-6的合成和分泌。这与Lin等[13]的研究结果类似。这提示NOX4在肿瘤免疫微环境中可能起到一定作用。Jin等[14]研究发现高水平的NOX4可以降低NK细胞活性和对肿瘤的敏感性,从而促进乳腺癌细胞发生肺转移。非小细胞肺癌(NSCLC)中,NOX4可以通过ROS/PI3K信号通路募集M2型肿瘤相关巨噬细胞,从而促进NSCLC的生长[15]。但NOX4在结肠癌中对免疫微环境的影响,还有待进一步研究。
在本研究中,发现NOX4是影响结肠癌预后的独立危险因素,为了进一步完善其对预后的预测价值,我们构建了包含NOX4在内的,评价结肠癌预后的预测模型。该模型量化了各种影响预后的独立因素的比重,使其可以个体化的应用在特定的病人。该模型预测能力较好,无论是在TCGA队列还是本院队列中,其C指数均在0.7以上,校准曲线也显示该模型预测能力与实际情况的一致性较好。在此基础上,我们根据每例病人的预后风险得分的中位数,将患者分为高风险组和低风险组,Kaplan-Meier曲线显示,两组患者的预后存在显著差异,也证实了该模型的预测效能。
综上所述,我们在TCGA和我院病理标本中均发现并验证了NOX4在结肠癌中表达显著升高,且其高表达与结肠癌晚期事件(N分期)相关,这说明NOX4可能影响了结肠癌的发展,可能作为治疗结肠癌的新靶点。而且NOX4的表达还是影响结肠癌患者预后的独立危险因素,我们构建的基于NOX4的预后模型具有较好的预测效能,这也为临床上评价患者的预后提供了一种新的参考工具。
