不同母岩发育马尾松土壤固氮菌群落结构和丰度特征
2020-11-13周运超
赵 辉,周运超
1 贵州大学贵州省森林资源与环境研究中心/贵州省高原山地林木培育重点实验室/林学院,贵阳 550025 2 铜仁学院,铜仁 554300
氮(N)在植物生长发育过程中具有不可替代的作用,它是合成植物体内蛋白质和核酸的必需元素,同时其自身也参与植物信号的传递[1]。生物固氮是指将大气中的N2转化为可被植物吸收利用的含氮化合物的过程,每年大约有50%的大气氮通过该途径进入生态系统[2]。生物固氮与具有生理功能的需氧和厌氧微生物密切相关[3]。目前,已经发现60多个属的固氮微生物,主要包括固氮菌属(Aztobacer)、固氮螺菌属(Azospirillum)、假单孢菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)和脱硫弧菌属(Desulfovibrio)等[4]。固氮菌数量和群落结构对土壤固氮速率和氮循环有直接的影响,可作为衡量土壤质量的重要指标[5]。生物固氮是由固氮酶催化,而固氮酶是一种能够将分子氮还原成氨的酶,有两个多亚基的金属蛋白酶组成,分别为nifD,nifK基因编码的钼铁蛋白和nifH基因编码的铁蛋白[6]。其中,nifH基因是系统进化过程最古老的功能基因之一,在进化过程中与16SrDNA保持一致[7]。因此nifH作为生物标记基因被广泛用于研究固氮微生物群落结构[8]。
马尾松(PinusmassonianaLamb.)是我国特有的针叶树种之一,由于其适应性强和耐干旱瘠薄等特点,广泛分布于我国南方地区,在我国生态环境建设和林业产业发展中发挥着重要作用[9]。因马尾松属于速生林,在生长过程中对土壤氮素的需求量较大。而目前在马尾松生长的土壤环境中,有限的氮素利用率成为限制其林木速成丰产的关键因素[10]。对于很少有氮素施入的马尾松林而言,生物固氮是维持马尾松林生长的主要氮源,对马尾松人工林速生丰产及地力维持具有重要作用。然而,由于马尾松人工林主产区土壤母岩类型多样,并且在造林过程中没有做到因地经营,因而导致大量低产林存在。因此,通过对不同母岩发育马尾松土壤固氮菌群落结构和丰度及其影响因素进行研究,对了解母岩发育马尾松土壤生物固氮及调节土壤氮素供应具有极其重要的意义。
土壤母质(岩)是岩石及矿物的风化产物,决定着土壤的形成及发育,而不同母岩发育土壤自身养分的差异会引起土壤微生物群落结构的变化[11],并对植物生长发育有重要影响。相关研究认为,土壤固氮微生物群落受到非生物和生物因素影响,非生物因子有土壤pH[12]、有效性氮[13]、土壤质地[14]和土壤类型等[15];生物因子有植被类型等[16],这些因素造成固氮微生物群落结构和多样性在不同母岩和植被下差异较大。目前,不同母岩发育土壤马尾松人工林的研究主要集中在林木生长[17]、酶活性[18]和土壤养分[19]等方面。关于亚热带地区不同母岩发育马尾松土壤固氮菌群落结构、多样性和丰度的研究未见报道。为此,本文运用Illumina MiSeq高通量测序技术和荧光定量PCR技术对亚热带地区主要母岩发育马尾松土壤固氮菌群落结构及丰度进行了研究,探讨土壤固氮菌群落结构和丰度在不同母岩发育土壤中的分布特征及其与土壤环境因子的关系,以揭示不同母岩发育土壤固氮能力及固氮菌生态功能,从固氮微生物角度来分析不同母岩土壤质量状况,为马尾松人工林适地造林及速生丰产提供科学依据。
1 材料与方法
1.1 研究区概况及试验设计
研究区位于贵州大学造林生态园(106°40′42″E,26°25′41″N),海拔1100 m,属于典型中亚热带季风气候,年相对湿度81%,年平均气温14.9℃,无霜期285 d左右,年平均日照总数为1274.2 h。
为尽量减少气候和群落植被等外界环境因子差异对试验造成的影响,采取了池栽试验。选取贵州省马尾松造林面积分布较广泛的土体为研究对象,主要发育于四类母岩,分别为变余砂岩(Blastopsammite)、长石石英砂岩(Feldspathic quartz sandstone)、石英砂岩(Quartz sandstone)和玄武岩(Basalt)。四类母岩发育形成的土壤过1 cm筛后,分别装入长×宽×深=5.0 m×1.2 m×0.5 m石框内作为1个试验小区,每类母岩土壤重复3次,共计12个试验小区,每小区面积为6 m2。土壤基本情况见表1。于2014年4月向小区内移栽生长发育良好且大小均一的1年生马尾松实生苗木,每小区36株。试验期间管理方式一致,均未施肥。

表1 不同土壤母岩土壤基本情况
1.2 样品采集
2017年7月进行土壤样品采集。在每个试验小区内沿S形样线用直径5 cm土钻均匀采取5个0—10 cm土壤样品,混合成1个土样,用低温冰盒保存并迅速带回实验室。土样在室内去除石块和植物根系等杂物并过2 mm筛后,最终分为三份,一份保存于-80℃冰箱,用于nifH基因群落结构和丰度分析;一份4℃冰箱保存,用于土壤微生物生物量碳和氮测定;一份用于土壤铵态氮和硝态氮测定,余下部分室内风干,过筛和研磨用于土壤化学指标测定。
1.3 测定方法
1.3.1马尾松株高和地径测定
2017年7月对马尾松株高和地径进行测定。株高采用钢卷尺测定,地径采用游标卡尺测定。
1.3.2土壤化学性质及微生物量碳氮测定
土壤化学性质采用鲁如坤方法测定[20]:土壤pH采用电位法;有机碳采用重铬酸钾氧化法;全氮采用凯氏定氮法;碱解氮采用碱解扩散法;铵态氮采用靛酚蓝比色法;硝态氮采用酚二磺酸比色法;速效磷采用碳酸氢钠浸提-钼锑抗比色法;速效钾采用乙酸铵提取-火焰光度法。土壤微生物量碳和氮采用吴金水方法测定[21]:微生物量碳采用氯仿熏蒸-容量分析法,微生物量氮采取氯仿熏蒸-茚三酮比色法。
1.3.3土壤DNA提取及高通量测定
称取0.5 g土壤,按照E.Z.N.A.® Soil DNAKit(Omega,GA,USA)试剂盒操作步骤提取土壤DNA。用1%的琼脂糖凝胶电泳检测DNA完整性,用核酸定量仪(Nanodrop-NC2000)检测DNA浓度和纯度。
采用引物nifH-F(5′-AAAGGYGGWATCGGYAARTCCACCAC- 3′)与nifH-R(5′-TTGTTSGCSGCRTACATS GCCATCAT- 3′)扩增固氮菌nifH基因[22]。PCR体系(25 μL):5×ExTaq缓冲液5.0 μL,dNPT(2.5 μmol/L)2.0 μL,上下游引物(10 μmol/L)各1.0 μL,DNA模板2.0 μL(1—10 ng),ExTaq(5 U/μL)0.25 μL,最后用超纯水(ddH2O)补至25 μL。PCR反应条件为:95℃ 3 min;94℃ 30 s,55℃ 30 s,72℃ 30 s,30个循环;72℃ 5 min。以2%琼脂糖凝胶电泳检测PCR产物。样品送至上海派森诺测序公司(Personalbio,China),运用Illumina MiSeq测序平台进行测序。
1.3.4nifH基因丰度测定
利用荧光定量PCR(Real-time PCR)技术检测nifH基因拷贝数,反应在ABI7500荧光定量PCR仪(ABI,CA,USA)上进行,反应引物同1.3.3所示。反应体系为:2×SYBR real-time PCR premixture(Bioteke,Beijing)10 μL,上下游引物(10 μmol/L)各0.4 μL,DNA模板1.0 μL(1—10 ng),最后用超纯水(ddH2O)补至20 μL。荧光定量PCR反应条件为:95℃ 5 min;95℃ 15 s,60℃ 30 s,40个循环。按照Poly方法[23],获得含有nifH基因的重组质粒,分别以10倍梯度稀释基因重组质粒得到标准曲线。并根据标准曲线计算基因丰度,nifH丰度最终被计算为每克干土的拷贝数。
1.4 数据分析
利用FLASH软件对通过质量初筛的双端序列根据重叠碱基进行配对连接,从而获得每个样本的有效序列。通过QIIME软件调用USEARCH检查并剔除嵌合体序列。将优质序列聚类成操作分类单元(Operational Taxonomic Unit,OTU),阈值设置为97%,并选取每个OTU中丰度最高的序列作为该OTU的代表序列。应用RDP-classifier在GenBank中对OTU进行分类注释,统计各样品门和属水平上群落组成;使用QIIME软件,对Chao1、ACE、Shannon和Simpson指数进行计算。
采用SPSS21.0统计软件,通过单因素方差分析(one-way ANOVA,n=3,P<0.05)和多重比较检验四类母岩发育土壤化学性质、马尾松株高、地径、固氮菌α多样性指数、丰度和群落组成相对丰度的差异显著性(P<0.05);相关性分析用SPSS21.0和R软件完成;固氮菌群落结构聚类分析、非度量多维尺度分析(Non-metric multidimensional scaling,NMDS)和冗余分析(Redundancy analysis,RDA)用R软件完成。
2 结果与分析
2.1 马尾松株高和地径
四类母岩马尾松株高和地径之间差异显著(P<0.05)(图1)。BL、FQS、QS和BA发育土壤下的马尾松株高(地径)分别为282.30 cm(2.78 cm)、292.93 cm(2.84 cm)、305.17 cm(3.05 cm)和340.83 cm(3.36 cm),其中BA土壤下马尾松株高和地径显著高于BL和FQS(P<0.05)。由此可知,BA发育的土壤有利于马尾松生长。
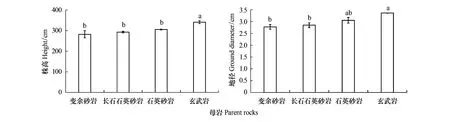
图1 不同母岩发育土壤马尾松株高和地径Fig.1 Height and ground diameter of Pinus massoniana soils developed from different parent rocksBL:变余砂岩 Blastopsammite;FQS:长石石英砂岩 Feldspathic quartz sandstone;QS:石英砂岩 Quartz sandstone;BA:玄武岩 Basalt
2.2 土壤化学性质和微生物量碳氮
不同母岩马尾松土壤化学性质如表2所示。四类母岩发育马尾松土壤均呈弱酸性(pH<6.5),QS土壤pH最低为4.71,显著低于其他母岩(P<0.05)。土壤有机碳、全氮和碱解氮含量均是BA最高,分别为28.34 g/kg、1.32 g/kg和168.54 mg/kg,并与其他母岩差异显著(P<0.05)。BA土壤铵态氮含量最低,硝态氮含量最高,分别与其他母岩差异不显著。BL土壤速效磷含量最高,速效钾含量最低。
不同母岩土壤微生物量碳和氮差异显著(P<0.05)(图2),且微生物量碳含量高于微生物量氮。BL土壤微生物量碳含量显著高于其他母岩(P<0.05),BA土壤微生物量碳含量最低,为147.13 mg/kg,但其土壤微生物量氮含量显著高于其他母岩(P<0.05)。由此可知,不同母岩发育马尾松土壤微生物量碳和氮呈现出不同的变化趋势。

表2 不同母岩发育马尾松土壤化学性质
2.3 固氮微生物nifH基因丰度
不同母岩马尾松土壤固氮微生物nifH基因丰度差异显著(P<0.05)。由图3可见,四类母岩土壤nifH基因丰度范围为0.19×105—1.5×105copies/g干土。BA土壤nifH基因丰度显著高于其他三类母岩(P<0.05),而BL、FQS和QS之间差异不显著(P>0.05),大小顺序为BA>BL>QS>FQS。

图2 不同母岩发育马尾松土壤微生物量碳和氮 Fig.2 Microbial biomass carbon and nitrogen of Pinus massoniana soils developed from different parent rocks不同小写字母表示不同处理间差异达到显著水平(P<0.05)

图3 不同母岩发育马尾松土壤样品nifH基因丰度 Fig.3 Abundance of nifH gene in Pinus massoniana soils developed from different parent rocks不同小写字母表示不同处理间差异达到显著水平(P<0.05)
为明确不同母岩土壤固氮微生物nifH基因丰度差异的影响因素,由nifH基因丰度与土壤化学性质、马尾松株高和地径进行相关性分析。结果表明(图4),nifH基因丰度分别与土壤有机碳、全氮、碱解氮、微生物量氮含量和株高之间呈极显著正相关关系(P<0.01),与地径呈显著正相关关系(P<0.05)。可知,固氮菌数量与土壤氮素供应和马尾松生长之间关系密切。

图4 群落多样性指数、nifH基因丰度与土壤化学性质、株高和地径相关性Fig.4 Correlation between community diversity index,nifH gene abundance and soil chemical properties,Height,ground diameter*和**分别表示相关性显著在P<0.05和P<0.01水平。SMBC:土壤微生物量碳 Soil microbial biomass carbon;SMBN:土壤微生物量氮 Soil microbial biomass nitrogen;H:株高 Height;Gd:地径 Ground diameter;nifH:nifH基因丰度 Abundance of nifH gene;Chao1:Chao1指数 Chao1 index;ACE:ACE指数 ACE index;Simpson:辛普森指数 Simpson index;Shannon:香农指数 Shannon index
2.4 固氮微生物测序结果和α多样性
利用Illumina MiSeq平台对固氮微生物nifH基因测序分析,BL、FQS、QS和BA土壤中获得质控后序列数分别为41338、34229、38223和45441条(表3)。把相似度水平≥97%的序列聚为一个操作分类单元(OTU),其中BA土壤含有的OTUs数最多(2206个),FQS土壤OTUs数最少(1471个)。由单因素方差分析可知(表3),不同母岩发育马尾松土壤α多样性指数差异显著(P<0.05)。四类母岩土壤α多样性指数变化趋势一致,大小顺序均为BA>BL>QS>FQS。说明BA发育马尾松土壤固氮菌多样性相对更为丰富。
相关性分析结果表明(图4),Chao1指数和ACE指数与土壤全氮呈显著正相关关系(P<0.05)。Simpson指数与土壤有机碳(r=0.651,P<0.05)和碱解氮(r=0.688,P<0.05)均呈显著正相关关系;与全氮(r=0.709,P<0.01)和微生物量氮(r=0.750,P<0.01)呈极显著正相关关系。Shannon指数与土壤有机碳(r=0.791,P<0.01)、全氮(r=0.864,P<0.01)、碱解氮(r=0.814,P<0.01)和微生物量氮(r=0.808,P<0.01)均呈极显著正相关关系,与株高(r=0.594,P<0.05)和地径(r=0.628,P<0.05)呈显著正相关关系。

表3 不同母岩发育马尾松土壤固氮菌α多样性
2.5 固氮微生物群落组成
通过对样品获得的OTUs进行归类,得到6个门、14个纲、41个目、69个科和122个属。在门水平上,分别为变形菌门(Proteobacteria)、蓝藻门(Cyanobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、疣微菌门(Verrucomicrobia)和浮霉菌门(Planctomycetes)(图5)。变形菌门和蓝藻门为主要优势类群,相对丰度分别为84.05%—94.71%和0.57%—3.94%。蓝藻门和疣微菌门在四类母岩发育马尾松土壤之间差异极显著(P<0.01),其中蓝藻门相对丰度在BL土壤最高。变形菌门、厚壁菌门和放线菌门在四类母岩土壤之间差异显著(P<0.05)。变形菌门相对丰度在BA土壤显著高于其他母岩(P<0.05);厚壁菌门相对丰度在FQS土壤最高(1.19%),QS土壤最低(0.02%);放线菌门相对丰度在QS土壤最高(0.17%),FQS土壤最低(0.04%);疣微菌门在QS土壤不存在;浮霉菌门仅在QS土壤存在,相对丰度为0.02%。

图5 不同母岩发育马尾松土壤固氮菌门和属水平组成Fig.5 The nitrogen-fixing microbial community composition at the phylum and genus levels in Pinus massoniana soils developed from different parent rocks*P<0.05,**P<0.01
在属水平上,将平均相对丰度<0.3%类群归类为其他,得到20个类群(图5)。其中,慢生根瘤菌属(Bradyrhizobium)、眉藻属(Calothrix)、根瘤菌属(Rhizobium)和固氮螺菌属(Azospirillum)为主要优势类群,相对丰度分别为65.13%—77.78%、0.26%—11.24%、1.14%—7.72%和1.71%—4.14%。慢生根瘤菌属在四类母岩发育土壤之间差异显著(P<0.05)。眉藻属、根瘤菌属和固氮螺菌属在四类母岩发育土壤之间差异极显著(P<0.01)。慢生根瘤菌属和固氮螺菌属相对丰度均在BA土壤最高;眉藻属相对丰度在QS土壤最高,BA土壤最低;根瘤菌属相对丰度在BL土壤最高,BA土壤最低。
2.6 固氮菌群落结构及其与土壤化学性质的关系
基于OTU层次聚类分析结果显示(图6),四类母岩发育马尾松土壤固氮菌群落结构差异明显,相同处理的3个重复都聚类在一起。NMDS分析进一步证实了四类母岩发育马尾松土壤固氮菌群落结构差异明显(图6)。四类母岩土壤固氮菌群落结构在NMDS1和NMDS2发生明显分离,分布在不同象限内。其中,BA与FQS、BL和QS距离较远,说明BA土壤固氮菌群落结构与其他母岩差异较大;FQS和QS相距较近,说明这二类母岩发育土壤固氮菌群落结构相似度较高。

图6 不同母岩土壤固氮菌群落结构的层次聚类树和NMDS分析Fig.6 Hierarchical clustering tree and nonmetric multidimensional scaling of the nitrogen-fixing microbial community structure in Pinus massoniana soils developed from different parent rocks
为进一步分析土壤化学性质对固氮菌群落结构的影响,对固氮菌群落结构与土壤化学性质进行冗余分析(图7)。结果表明,第1轴(A x i s 1)和第2轴(A x i s 2)分别解释了46.99%和30.56%的变异,两者累计解释变异量为77.55%。由此可知,前两轴能够很好地反映土壤固氮菌群落组成与土壤化学成分之间的关系。土壤有机碳、全氮、碱解氮和微生物量氮对固氮菌群落有极显著影响。
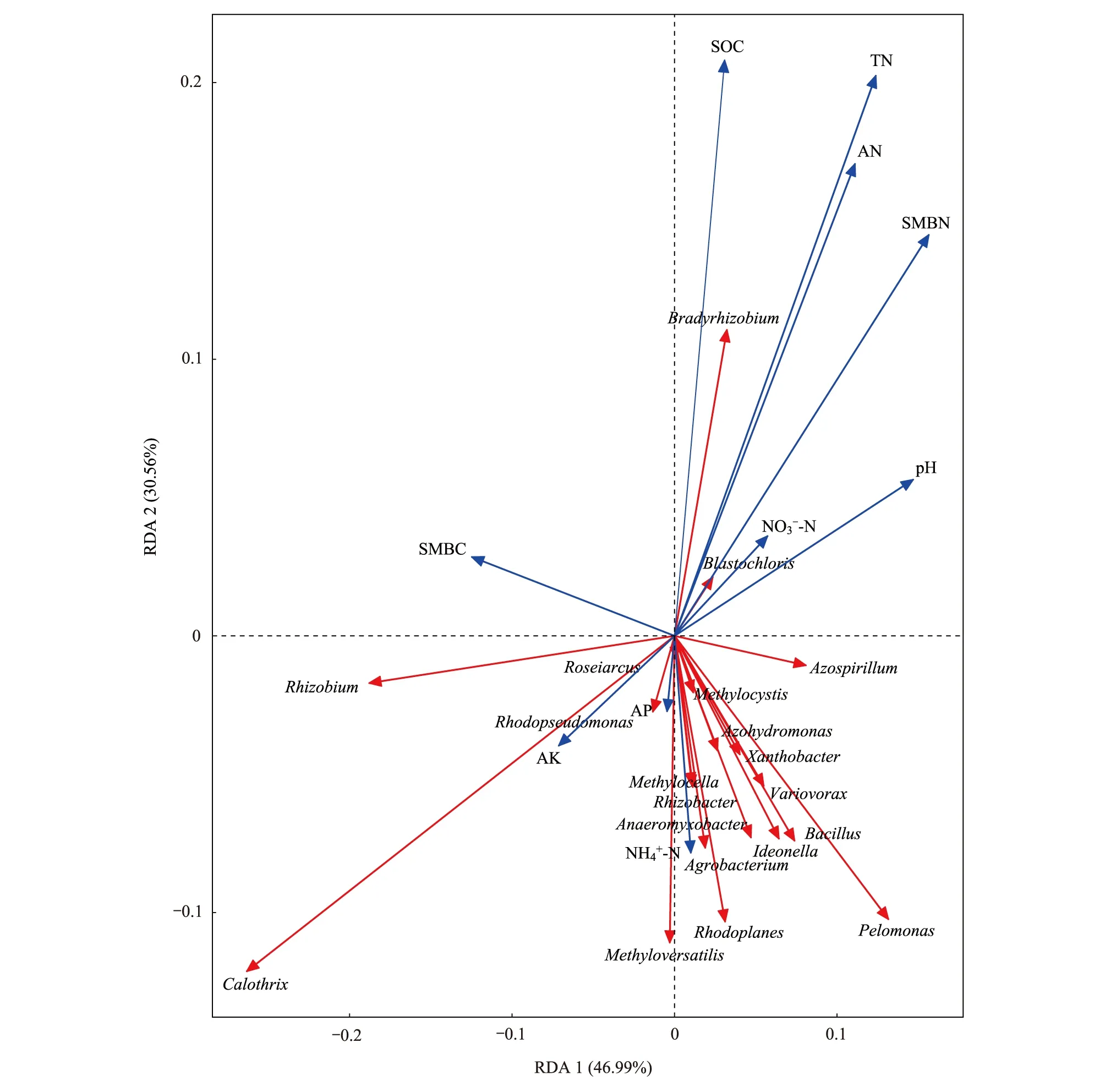
图7 属水平固氮菌群落和土壤化学性质的冗余分析Fig.7 Redundancy analysis between the nitrogen-fixing microbial community structureat the genus level and soil chemical properties
3 讨论
3.1 不同母岩发育马尾松土壤对固氮菌丰度和多样性的影响
土壤能够为微生物生长提供所需养分,土壤养分的差异直接导致微生物数量和群落结构发生变化[24]。闫小莉和王德炉[25]研究认为,土壤母岩对其发育土壤理化性质有显著影响。因此,母岩也将间接对土壤微生物种群数量和结构产生重要影响。本研究中四类母岩发育马尾松土壤固氮菌丰度与α多样性指数变化规律相同,均是玄武岩土壤显著高于其他母岩。大量研究表明,土壤有机碳[26]、氮[27- 28]和根系分泌物[29]是影响nifH基因丰度的主要因素。Herbert[30]研究认为,微生物固氮所需能量主要来源于土壤有机碳,每固定一分子氮将需要16个ATP。Coelho等[27]研究认为,土壤氮含量增加将导致nifH基因丰度降低;然而Juraeva等[28]研究认为,nifH基因丰度随土壤氮含量增加而增加。杨亚东等[29]研究认为,植物生长越旺盛,根系分泌物越多,越有利于固氮菌生长。Nelson和Mele[31]研究表明,土壤质地对固氮菌数量影响较大,黏质土壤比沙质土壤具有更多的nifH基因丰度,与本研究结果相似。本研究中玄武岩土壤nifH基因丰度显著高于其他母岩,这可能由于玄武岩土壤的有机碳和氮养分含量高,马尾松生长快,根系分泌物代谢物较多,为固氮菌生长提供较多的碳源和氮源;而变余砂岩、石英砂岩和长石石英砂岩土壤养分含量低,不能为固氮菌生长提供充足的碳源和养分,因此造成固氮微生物数量较少。Huang等[32]研究认为,植物会对土壤理化性质产生直接或间接的影响。与栽种前相比,本研究中四类母岩马尾松生长的土壤pH均有所下降,这可能由于马尾松生长过程中根系分泌物或针叶在分解过程中产生酸性物质所致。Silva等[33]研究认为,土壤pH与nifH基因丰度有显著相关性。然而,本研究中土壤pH与nifH基因丰度没有显著相关性,与杨亚东等[29]研究结果一致;但是土壤pH在不同母岩发育土壤之间差异显著,因此土壤pH可能通过改变土壤理化性质[34],间接对固氮菌数量产生一定影响。
微生物α多样性指数是评价土壤微生物群落多样性的重要指标,多样性指数越高表明微生物群落丰富度和多样性越高,土壤肥力越高,土壤生态环境越稳定[35]。Chao1或ACE指数越大,表明群落丰富度越高。Simpson和Shannon指数越高表明群落多样性越高。周燕等[36]研究认为,固氮微生物多样性与植物凋落物和根系分泌物关系密切。本研究表明,玄武岩土壤固氮菌α多样性指数均显著高于其他母岩,表明玄武岩土壤固氮菌的丰富度和多样性较高,可能由于马尾松生长较快,凋落物和根系分泌物增多,导致养分归还和转化速率加快[37],土壤可利用养分含量增加,有利于固氮微生物生长繁殖。本研究结果进一步佐证了土壤肥力(养分)增高可促进土壤微生物多样性升高的论点[38]。石英砂岩和长石石英砂岩马尾松由于生长缓慢,凋落物和根系分泌物较少,限制了固氮菌生长,因而导致固氮微生物丰富度和多样性指数较低。
本研究中土壤有机碳、全氮和碱解氮与nifH基因丰度和多样性指数之间呈显著正相关性关系,进一步表明不同母岩发育马尾松土壤有机碳、全氮和碱解氮含量差异是影响固氮菌数量和多样性的重要因素。有研究表明土壤氮素含量是微生物生长的限制因子,其与微生物数量和群落组成关系密切[39]。然而,本研究中土壤铵态氮和硝态氮含量与固氮菌丰度和多样性指数并无显著相关性,这和何冬华[40]等研究结果一致,说明土壤环境因子对固氮菌的影响较为复杂。
3.2 固氮菌群落与土壤质量之间的关系
固氮菌群落组成对土壤地力维持和植物生长有重要影响[41]。Poly等[23]研究表明,土壤类型和养分状况对固氮菌群落结构影响较大。本研究中四类母岩土壤优势门和属类群相似,但不同母岩中优势类群相对丰度存在显著差异(图5);层次聚类和NMDS分析也表明,四类母岩发育土壤固氮菌群落结构分离明显,因此母岩对土壤固氮菌群落结构有显著影响。本研究中变形菌门和蓝藻门是主要优势类群,且在不同母岩发育土壤中差异显著。相关研究认为,变形菌门广泛分布于土壤中且有较高的相对丰度,属于异养型微生物,具有嗜营养特点,与土壤有机碳含量关系紧密,可用来指示土壤肥力状况[42- 43]。Anderson等[44]研究表明,植物可以增强母岩土壤风化速率和促进养分释放。玄武岩土壤在有机碳含量高和马尾松生长旺盛共同作用下促进变形菌门菌群生长,导致变形菌门相对丰度显著高于其他母岩。其中,慢生根瘤菌属相对丰度在玄武岩土壤最高;然而眉藻属相对丰度在玄武岩土壤最低;可知变形菌门中不同属群对相同环境因子的响应存在差异,具有各自的生态位。蓝藻门为水生环境中优势固氮类群,在湿润环境下生长较好[45- 46]。目前,关于蓝藻门对氮固定的贡献大小一直未达成共识[47]。Beversdorf等[48]研究认为蓝藻门对氮固定的贡献较大,然而Ferber等[49]研究认为蓝藻门对氮的固氮在整个环境氮库中贡献较小。本研究中蓝藻门相对丰度在玄武岩土壤最低,变余砂岩土壤最高;可能是由于玄武岩土壤为砂质粘壤土[19],土壤透水好,抑制了蓝藻门固氮菌的生长;变余砂岩土壤为壤质粘土[19],土壤透水性差,且7月雨水较多,土壤易于板结和积水,有利于其生长繁殖;同时变余砂岩土壤蓝藻门相对丰度高导致铵态氮含量较高,然而铵态氮含量与其他母岩差异不显著,可见蓝藻门在变余砂岩土壤中可能对氮固定的贡献不大。厚壁菌门具有寡营养特点,同时分泌大量有害物质,干扰植物正常氮素代谢,不利于植物生长[13]。厚壁菌门相对丰度在长石石英砂岩土壤最高,因此推测长石石英砂岩马尾松生长缓慢可能与该菌群有关。疣微菌门极富生态多样性,对环境耐受能力强,具有降解烃类能力[50]。在马尾松生长过程中,疣微菌门固氮的同时所降解的烃类物质可能是马尾松所产生的次级代谢产物,次级代谢产物的积累将不利于其生长[51]。本研究中疣微菌门相对丰度在玄武岩和长石石英砂岩土壤较高,变余砂岩土壤较少,石英砂岩土壤未检测到。因此,不同母岩发育土壤中疣微菌门的减少或消失,可能也是抑制马尾松生长的一个重要因素。
本研究发现,土壤有机碳、全氮、碱解氮和微生物量氮是固氮菌群落结构的主要影响因素。Orr等[52]研究也认为土壤有机碳和氮对固氮菌群落结构有显著影响,同时有机碳、全氮和碱解氮相互之间有显著相关性;由此可知,固氮菌群落结构可能由几个关联性较强的化学指标共同进行调控。综上所述,玄武岩土壤有机碳、全氮、碱解氮和微生物量氮显著高于其他母岩,土壤肥力较高,有利于马尾松生长,对优化固氮菌群落结构和促进土壤氮固定具有重要作用。今后研究中需要开展相应的野外试验,与池栽试验进行相互印证;同时对参与马尾松凋落物分解和拮抗致害真菌等重要微生物功能类群进行深入的研究,有利于进一步解释不同母岩发育马尾松土壤质量差异的微生物机理,为马尾松适地造林提供充分的理论依据。
4 结论
四类母岩土壤固氮菌(nifH)基因丰度和群落α多样性指数差异显著,表现为玄武岩>变余砂岩>石英砂岩>长石石英砂岩。变形菌门和蓝藻门相对丰度占到固氮菌总量的87.99%—95.29%,是四类母岩土壤共有的优势群落,其中玄武岩土壤所占比例最高。厚壁菌门和疣微菌门通过自身代谢产物对马尾松生长具有重要影响。土壤有机碳、全氮和碱解氮是影响四类母岩土壤固氮菌丰度、群落结构和α多样性的主要因素。因此,马尾松在不同母岩发育土壤栽种时,应根据母岩特性采取有效措施,改善土壤养分状况,优化土壤固氮菌群落结构,提高土壤固氮能力,实现人工林速生丰产及可持续经营。
