红壤性水稻田土壤-水-植物系统中毒死蜱的迁移转化和分布特征
2020-11-11姚莹雷刘慧云程建华唐翔宇耿春女关卓
姚莹雷,刘慧云,程建华,唐翔宇,耿春女,关卓
(1.上海应用技术大学生态技术与工程学院,上海201418;2.中国科学院、水利部成都山地灾害与环境研究所,成都610041)
作为一种高效、广谱、中等毒性的有机磷杀虫剂,毒死蜱(Chlorpyrifos)被广泛应用于农业生产中。其在田间施用后,大部分将进入大气、土壤和水体中[1-4]。土壤是毒死蜱的主要受纳环境介质[5]。毒死蜱在土壤中可以发生吸附与降解(包括光解、水解、微生物降解等)。土壤中毒死蜱的半衰期为6.3 h 至100 d[5-6],其主要降解产物3,5,6-三氯-2-吡啶醇(TCP)的半衰期为65~360 d[7]。TCP 的迁移性比其母体化合物毒死蜱强很多,其土壤和水体环境污染风险大[8]。TCP在土壤中的毒性高于母体毒死蜱[9],能够通过抑制细菌的代谢活动来抑制毒死蜱的降解与矿化,从而使自身与毒死蜱在环境中积累[10]。
红壤在我国分布广泛,主要集中在长江以南丘陵地区,以江西省为例,红壤面积约占全省总面积的56%[11]。水稻是我国南方主要的粮食作物之一,红壤性水稻土是在地带性红壤的基础上经长期的水稻种植熟化而形成的。稻田常用的灌溉模式包括间歇灌溉[12]、持续灌溉、浅水灌溉、湿润灌溉等。施入的农药可能通过稻田排水、降雨径流及渗漏作用等过程输出到周边环境,从而导致地表水及浅层地下水中常有毒死蜱检出[13-14]。红壤与其他类型的土壤相比,具有酸、瘦、黏等特点,其分布区域的降水量大(>1000 mm·a-1)且极端暴雨事件频发[15]。然而,有关红壤性水稻田土壤-水-植株系统中毒死蜱的迁移转化规律和分布特征方面的研究却相当缺乏,鲜见系统的野外试验与动态观测研究。
本研究依托中国科学院红壤生态实验站,通过室内批量平衡实验、田间喷施试验与动态观测,比较水田持续淹水和间歇淹水条件下稻田田面水与土壤孔隙水中毒死蜱及其主要降解产物TCP 浓度的动态变化规律,辨识其主要影响因子,揭示毒死蜱在土壤-水-植物系统中的分布特征,以为该农药的地表水及地下水污染风险评估提供科学依据。
1 材料与方法
1.1 试验材料
毒死蜱标准品(纯度99.9%,Sigma-Aldrich,美国)和TCP 标准品(纯度99.9%,Sigma-Aldrich,美国)用于室内批量平衡吸附实验,毒死蜱乳油(有效成分45%,山东绿霸化工股份有限公司)用于野外喷施试验(图1)。供试水稻品种为荣优100(江西先农种业有限公司),供试土壤样品取自位于江西省鹰潭市余江区刘家站鲁王村(116°92′E,28°21′N)的水旱轮作稻田(试验小区均为长24 m、宽16 m),其耕作层(0~20 cm)和非耕作层(20~50 cm)土壤的有机质含量分别为21.3 g·kg-1和9.0 g·kg-1,pH 值分别为5.2 和5.9(水土比2.5∶1)。

图1 毒死蜱和3,5,6-三氯-2-吡啶醇结构式Figure 1 The structure of chlorpyrifos and TCP
1.2 试验方法
1.2.1 室内等温吸附实验
采用批量平衡法,测定毒死蜱和TCP在耕作层和非耕作层水稻土中的等温吸附线。实验方法如下:称取过2 mm筛的风干土壤2 g,置于30 mL离心管中,加入10 mL 一定初始浓度(0.5、1、2、5、10 mg·L-1)的毒死蜱或TCP溶液(含抑菌用NaN30.1 g·L-1及支持电解质)10 mmol·L-1CaCl2),在25 ℃、180 r·min-1条件下恒温避光振荡24 h 后,达到吸附平衡,4 000 r·min-1离心5 min,取部分上清液用聚四氟乙烯滤膜过滤后,直接测定TCP 含量,另取部分上清液经固相萃取处理后,测定毒死蜱含量。以上处理均设置3 次重复,并以不加土壤作为空白对照,以消除系统误差。
1.2.2 等温吸附模型拟合和自由能计算
采用Freundlich 方程和线性方程对批量平衡吸附实验数据进行拟合,以描述毒死蜱及TCP在土壤中的吸附量(qe,mg·kg-1)与平衡浓度(Ce,mg·L-1)之间的关系。
Freundlich非线性等温吸附模型:

式中:Kf为吸附容量常数;n为吸附亲和力值。
线性模型:
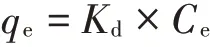
式中:Kd为吸附质在两相中的分配系数。
吸附作用的自由能变化(ΔG,kJ·mol-1)反映土壤吸附机理,其计算公式如下:

式中:R为摩尔气体常数,8.314 J·mol-1;T为绝对温度,K;Koc为以土壤有机碳含量表示的吸附常数,mL·g-1。
1.2.3 田间喷药试验及采样观测
试验水田设置持续淹水和间歇淹水两种处理,在水田中央安装土壤溶液采样器(陶土头深度为10 cm和50 cm),采用手动真空泵在-60 kPa 吸力下采集土壤孔隙水。持续淹水处理为施药后30 d 内田面持续保持淹水状态,间歇淹水处理为前15 d 为淹水期,后15 d 为落干期。于2018 年9 月30 日下午将杀虫剂毒死蜱一次性均匀喷施于上述试验水田(2.5 kg·hm-2,为4 倍的推荐施用量)。分别于施药后第0、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、17、19、21、24、27、30 d的上午8:00 采集田面水、10 cm 深处(耕作层)和50 cm 深处(非耕作层)土壤孔隙水,其中第0~8 d的下午5:00 增加一次采样以反映昼夜温差的影响。第0、10、20、30 d 和收获日(第35 d)采集水稻叶片。第10 d和收获日在0~5、5~10、10~15、25~30、45~50 cm深度分层采集土壤样品,均为上午8:00 采集的5 点混合样。施药后观测期内的平均日最低温度为14 ℃,平均日最高温度为24 ℃。
1.2.4 样品处理
水样:取200 mL 水样(体积不足的样品用去离子水稀释至200 mL,并记录原始体积),用Oasis HLB(30 mg,3 mL;Waters,美国)固相萃取柱萃取。将水样以约2 mL·min-1的速度流过预先经6 mL 甲醇和6 mL水活化的萃取柱。完成过柱后,抽气干燥萃取柱,用10 mL 甲醇洗脱并定容至10 mL。然后,将洗脱液分成两份,一份2 mL 用于毒死蜱分析,另一份8 mL用于TCP分析。用旋转蒸发仪将洗脱液浓缩至近干,用于毒死蜱分析的样品用色谱纯乙酸乙酯定容,用于TCP 分析的样品用色谱纯甲醇定容。两者的定容体积均为0.5 mL,保存于4 ℃冰箱待测。
毒死蜱的加标回收率为53%~71%,其校准曲线的线性范围为0.05~25 μg·L-1(相关系数为0.997),检出 限 为0.04 μg · L-1。 TCP 的 加 标 回 收 率 为90%~114%,其校准曲线的线性范围为0.125~25 μg·L-1(相关系数为0.998),检出限为0.12 μg·L-1。
土样:将采集的土壤样品冷冻干燥并研磨混匀,称取2 g,加入20 mL乙酸乙酯后涡旋10 s混匀,300 W超声处理20 min后4 000 r·min-1离心5 min,取出上清液,再次添加10 mL乙酸乙酯进行提取,而后将两次上清液混合,旋蒸浓缩至近干,用乙酸乙酯定容至1 mL,用0.22 μm聚四氟乙烯滤膜过滤于进样瓶中待测。该方法的加标回收率为91%~105%,线性范围为0.005~2.5 mg·kg-1(相关系数为1.000),检出限为0.002 5 mg·kg-1。
植物:将采集的植物样品冷冻干燥并均匀剪碎,称取2 g,加入20 mL 乙酸乙酯后300 W 超声处理20 min,取出上清液,再次添加10 mL 乙酸乙酯进行提取,而后将两次上清液混合,旋蒸浓缩至近干,用乙酸乙酯定容至1 mL,用0.22 μm 聚四氟乙烯滤膜过滤于进样瓶中待测。该方法的加标回收率为91%~105%,线性范围为0.005~2.5 mg·kg-1(相关系数为1.000),检出限为0.002 5 mg·kg-1。
1.2.5 仪器
气相色谱仪(GC 7890A,Agilent,美国)配有火焰光度检测器(FPD)、液相色谱仪(HPLC 1260,Agilent,美国)配有紫外检测器(UV)、土壤溶液采集器(1900L,Soilmoisture Equipment Corp,美国)、pH 计(Senslon+MM150,美国)、恒温振荡床(ZWF-200,上海智城分析仪器制造有限公司)等。
1.2.6 色谱条件
气相色谱分析:色谱柱为HP-5 柱(30 m×0.32 mm×0.25 μm);柱流量1 mL·min-1;柱温,初始温度50 ℃,保持1 min,以30 ℃·min-1升温至180 ℃,保持1 min,再以10 ℃·min-1升温至250 ℃,保持5 min。进样口温度250 ℃;检测器温度250 ℃;进样量1 μL。
高效液相色谱分析:色谱柱为Eclipse plus C18柱(4.6 mm×150 mm×5 μm);流动相为甲醇-水(体积比为80∶20),水相为0.02%(体积比)的乙酸溶液;等度洗脱,流量1 mL·min-1;柱温30 ℃,紫外检测波长293 nm;进样量10 μL。
2 结果与分析
2.1 毒死蜱及TCP在水稻土中的等温吸附特征
毒死蜱及TCP 在红壤性水稻田耕作层与非耕作层土壤中的等温吸附特征如图2 所示,毒死蜱为非离子型有机物,主要(90%~95%)被土壤固相所吸附,而TCP 吸附性较弱,主要(60%~75%)存在于水相中。在相同平衡浓度(Ce)下,有机质含量较高的耕作层土壤中毒死蜱的吸附量明显高于非耕作层土壤(图2a),而有机质含量的差异对TCP 吸附量的影响较小(图2b)。TCP 为弱酸性极性化合物(pKa 值为4.55),在平衡溶液(pH 5.6~6.3)中主要以阴离子存在,其吸附主要是发生在黏土矿物表面的快速吸附,与黏粒含量呈正相关。可以推断:相对于非耕作层土壤,耕作层土壤中农药吸附位点较多,且主要源于有机质的贡献,故而对分配作用较强的疏水性有机污染物毒死蜱的吸附容量较大。总体而言,与非耕作层土壤相比,耕作层土壤能够吸附更多的毒死蜱及TCP。在相同的吸附量(qe)水平下,非耕作层土壤中毒死蜱及TCP的水相平衡浓度均高于耕作层土壤,且两种土壤中的TCP水相平衡浓度远高于毒死蜱。

图2 稻田耕作层和非耕作层土壤中毒死蜱与TCP的等温吸附特征Figure 2 Sorption isotherms of chlorpyrifos and TCP in the soils of cultivated and uncultivated layer of paddy field
毒死蜱及TCP 等温吸附数据的Freundlich 方程和线性方程拟合结果如表1 所示。对于毒死蜱,两种方程拟合所得的相关系数(R2)均达到显著或极显著水平,且以Freundlich 方程的拟合效果更好,表明毒死蜱在红壤性水稻土中的吸附作用有多种方式,不仅包括线性分配作用,还有非线性、非均质的多层吸附。对于两种方程,耕作层土壤毒死蜱等温数据的拟合R2值均大于非耕作层土壤,说明有机质在非线性吸附中也起到了重要作用。 非耕作层土壤中毒死蜱的Freundlich吸附容量常数和线性分配系数均小于耕作层土壤。水田土壤对毒死蜱的吸附容量常数(Kf)和分配系数(Kd)均明显高于TCP,能够推断出毒死蜱的迁移性比TCP 差。两种方程对TCP 等温吸附数据的拟合结果均较好(R2均大于0.98),而非耕作层土壤中TCP的Freundlich吸附容量常数和线性分配系数均小于耕作层土壤。因此可以推断,毒死蜱及TCP在有机质含量较高的耕作层土壤中的迁移性弱于在有机质含量较低的非耕作层土壤,且以吸附性弱的TCP更易于向深层土壤迁移。
吸附自由能变化的大小,能够揭示土壤对吸附质的吸附机理。在耕作层和非耕作层土壤中,毒死蜱的吸附自由能变化量分别为-10.5 kJ·mol-1和-11.4 kJ·mol-1,TCP 的吸附自由能变化量分别为-2.3 kJ·mol-1和-3.1 kJ·mol-1,均小于发生化学吸附所需要的40 kJ·mol-1,表明毒死蜱及TCP 在呈弱酸性的耕作层和非耕作层红壤性水田土壤中的吸附均属于物理吸附,主要为分配机制,其次为范德华力,而对于TCP,还与相对贡献更小的静电引力作用有关。
2.2 田面水与土壤孔隙水中毒死蜱及TCP 浓度随时间的变化规律
水田传统采用淹水灌溉,但其耗水量大,在灌溉设施和水源相对受限的丘陵地区,经常还会采用包括间歇灌溉、湿润灌溉等在内的其他节水灌溉模式,其中以间歇灌溉最为普遍。施药后持续淹水与间歇淹水条件下田面水和不同深度土壤孔隙水中毒死蜱浓度随时间变化情况如图3 所示。田面水中毒死蜱浓度在施药1 d 后降低超过90%,并稳定保持在0.005 μmol·L-1的低水平,这与耕作层土壤对毒死蜱的强吸附能力相关。

表1 红壤性水稻土的毒死蜱及TCP等温吸附方程拟合结果Table 1 Fitted equations to sorption isotherms of chlorpyrifos and TCP in paddy field developed from red soil

图3 灌溉方式对田面水及土壤孔隙水中毒死蜱浓度的影响Figure 3 Effects of irrigation regime on chlorpyrifos dynamics in floodwater and soil pore water
土壤孔隙水中的毒死蜱浓度显著低于田面水,保持在较低水平。稻田排灌引起土壤氧化还原状况以及土壤水分运动特征发生显著改变,从而可能改变土壤中农药及其降解产物的吸附-解吸和淋溶迁移行为及其孔隙水中浓度随深度变化的特征。施药后随时间的推移,土壤孔隙水中毒死蜱浓度也快速下降,且前3 d 内10 cm 深处土壤孔隙水中的毒死蜱浓度总体高于50 cm 处,这可能是由于下渗水中的毒死蜱部分被耕作表层土壤所吸附。
特别是在间歇灌溉处理水田的排干期(施药后的16~30 d),降雨事件会促使雨水携带由表层土壤解吸的毒死蜱随大孔隙优先流向下层,商品农药所含表面活性剂等助剂的增溶作用导致其以一定的通量迅速到达50 cm 深层土壤,使其浓度略有升高。下午5:00采集的土壤孔隙水中的毒死蜱浓度总体小于上午8:00采集的土壤孔隙水,且10 cm 深度土壤中土壤孔隙水毒死蜱浓度变化范围显著大于50 cm 深处,这可能与表层土壤受环境温度变化的影响程度大于深层土壤有关,且白昼时段相对较高的温度有利于毒死蜱由土壤颗粒固相向孔隙水解吸释放。在施药后的第30 d,持续淹水处理水田的土壤孔隙水毒死蜱浓度明显升高,但其解吸释放机制尚不清楚;而在处于排干期的间歇淹水处理中,土壤孔隙水毒死蜱浓度仍保持低浓度水平。
田面水和土壤孔隙水中弱吸附性的TCP 的浓度动态变化规律与母体农药毒死蜱不同,具体见图4。两种处理水田施药后淹水期(第1~15 d)内上午时段的田面水毒死蜱浓度总体在0.002 5~0.003 μmol·L-1范围内变化,但从施药后的第4 d 开始,发生短时间(1~2 d)的升高后下降,特别是在两次降雨事件(第9~10 d 和第14~15 d)下TCP 浓度发生大幅升高,高达0.004 5 μmol·L-1,与初期毒死蜱浓度迅速下降的变化量(0.004~0.005 μmol·L-1)较为接近,推测为表层土壤固相所吸附的毒死蜱发生降解、持续生成TCP并释放到水相中所致。持续淹水处理水田在第1~15 d 上午8:00 10 cm 深处土壤孔隙水中的TCP 浓度呈现先升(第3~5 d)后降(第5~8 d)的趋势,而50 cm 深处TCP浓度则在第1~30 d 因降雨事件发生先下降后回升的较大波动,总体为上升趋势。这是因为表层土壤吸附的毒死蜱解吸并降解生成的TCP持续发生淋失,加之施药后的降雨事件能使TCP 向水相的释放及淋失强度显著增加,从而导致TCP 主要在50 cm 深度发生累积。
间歇淹水处理水田中10 cm 深处土壤孔隙水中TCP 浓度在淹水期(第1~15 d)的变化规律与持续淹水处理相似,而在排干期(第16~30 d)则有所不同。间歇淹水处理水田明显受到降雨事件(第20 d 和第24 d)下淋溶作用的强烈影响,呈现先下降后回升的大幅波动,而其50 cm 深处TCP 浓度基本保持在较低水平,略有波动。总之,不同灌溉方式对土壤孔隙水TCP 浓度的动态变化规律产生了不同的影响。受白昼相对高温的影响,第1~8 d 淹水期下午时段表层(10 cm)土壤孔隙水中TCP 浓度明显高于深层(50 cm)土壤,且总体高于上午土壤孔隙水中TCP 浓度。间歇淹水处理能有效降低深层渗漏水中TCP 浓度。与毒死蜱浓度的变化特征相比,TCP 浓度变化受环境因子(温度、降雨事件)与田间排灌管理的影响更大,表现出更为明显的昼夜差异,耕作层土壤孔隙水TCP浓度变化幅度尤为显著。
2.3 土壤剖面中毒死蜱含量的分布特征
如图5 所示,施药10 d 后水田土壤中毒死蜱的剖面分布特征总体表现为随着土壤深度的增加毒死蜱含量略有减少,以表层0~5 cm 最高,这是毒死蜱随下渗水垂直迁移过程中较多地被耕作表层土壤所吸附的结果。在水稻收获时,不同深度土壤中毒死蜱含量分布较为均匀,但是总体低于施药10 d的土壤毒死蜱含量。说明毒死蜱在酸性、质地黏重的红壤性水稻土中的淋溶强度较大,污染地下水的风险较高。
2.4 水稻植株各部位的毒死蜱含量
收获期水稻各部位及施药后叶片中毒死蜱含量的变化情况如图6a 所示。不同灌溉方式条件下,水稻各部位毒死蜱含量明显不同。持续淹水处理水田中水稻各部位毒死蜱含量大小依次为籽粒>茎秆>根>叶片;间歇淹水处理水田中水稻各部位毒死蜱含量大小依次为根>叶片>籽粒>茎秆。间歇淹水处理水田中水稻籽粒和茎秆中的毒死蜱含量分别为持续淹水处理水田中水稻对应部位的69%和84%,而叶片和根中毒死蜱含量则分别是持续淹水处理水田中水稻对应部位的1.78 倍和1.88 倍。推测以上现象的发生机制为:与持续淹水处理相比,间歇灌溉处理水田在田面水排干后表土开裂形成大量裂隙及大孔隙,氧化条件和迁移性增强,耕作层土壤毒死蜱含量及孔隙水毒死蜱浓度降低(图3),因而向地上部的转运量较少,且向茎秆和籽粒分配的分配量较少。施药后随着时间的推移,叶片中毒死蜱含量逐渐下降,可能是水稻叶片所吸附毒死蜱发生降解及生长稀释的综合结果(图6b)。

图4 灌溉方式对田面水及土壤孔隙水中TCP浓度的影响Figure 4 Effects of irrigation regime on TCP concentration in floodwater and soil pore water
3 讨论
3.1 红壤性稻田土壤中毒死蜱的消解与剖面分布规律

图5 施药10 d后及收获时稻田土壤中毒死蜱的剖面分布特征Figure 5 Depth distribution of chlorpyrifos in paddy soil at day 10 after application and at harvest
毒死蜱在土壤中的迁移转化行为主要受吸附[16-19]、降解(水解、光解和微生物分解)等过程的控制[1],其在水田土壤-水-植物系统中的归趋特征与分布规律主要受水体pH、土壤有机质含量、黏土矿物组成、孔隙结构、水力学性质及其剖面变化特征以及田间管理措施的影响[20-21]。水体pH 对毒死蜱环境行为的影响较为显著,在酸性条件下毒死蜱较为稳定,而在碱性条件下易发生降解[22]。土壤有机质含量与毒死蜱的吸附量呈正相关[5]。受光照条件的影响,光解一般只发生在表层水和土壤中,在深层水和土壤中毒死蜱光解速度则非常缓慢。微生物降解是土壤环境中毒死蜱消解的重要途径,78%~95% 的毒死蜱被微生物降解[23]。在本研究中,水稻土呈弱酸性,尽管在施药第10 d以表层(0~5 cm)土壤毒死蜱含量最高(持续淹水和间歇淹水处理分别为0.393 mg·kg-1和0.537 mg·kg-1),但有大量毒死蜱随下渗水迁移至深层(50 cm)土壤,其毒死蜱含量仅略低于表层土壤;收获时(第35 d),土壤中毒死蜱含量整体有所下降,但仍处在较高水平,仅耕作层土壤中毒死蜱含量大幅降低,而深层土壤中毒死蜱含量降幅小,其剖面分布总体较均匀(持续淹水和间歇淹水处理的0~50 cm剖面平均值分别为0.267 mg·kg-1和0.272 mg·kg-1)(图5)。然而,相同的施药量条件下,长江上游低山丘陵区紫色土发育的偏碱性水稻土中施药第10 d毒死蜱的最大分布深度仅为15 cm,且主要集中于表层0~5 cm土壤(持续淹水和间歇淹水处理中分别为1.14 mg·kg-1和0.09 mg·kg-1),且第40 d时仅在表层土壤中有低水平检出(持续淹水和间歇淹水处理中分别为0.11 mg · kg-1和0.07 mg ·kg-1)[24]。可以推测,毒死蜱在红壤性水稻土中的残留期较长、残留含量高,且淋溶迁移分布深度大。
3.2 灌溉方式与降雨事件对红壤性稻田中毒死蜱迁移与归趋特征的影响
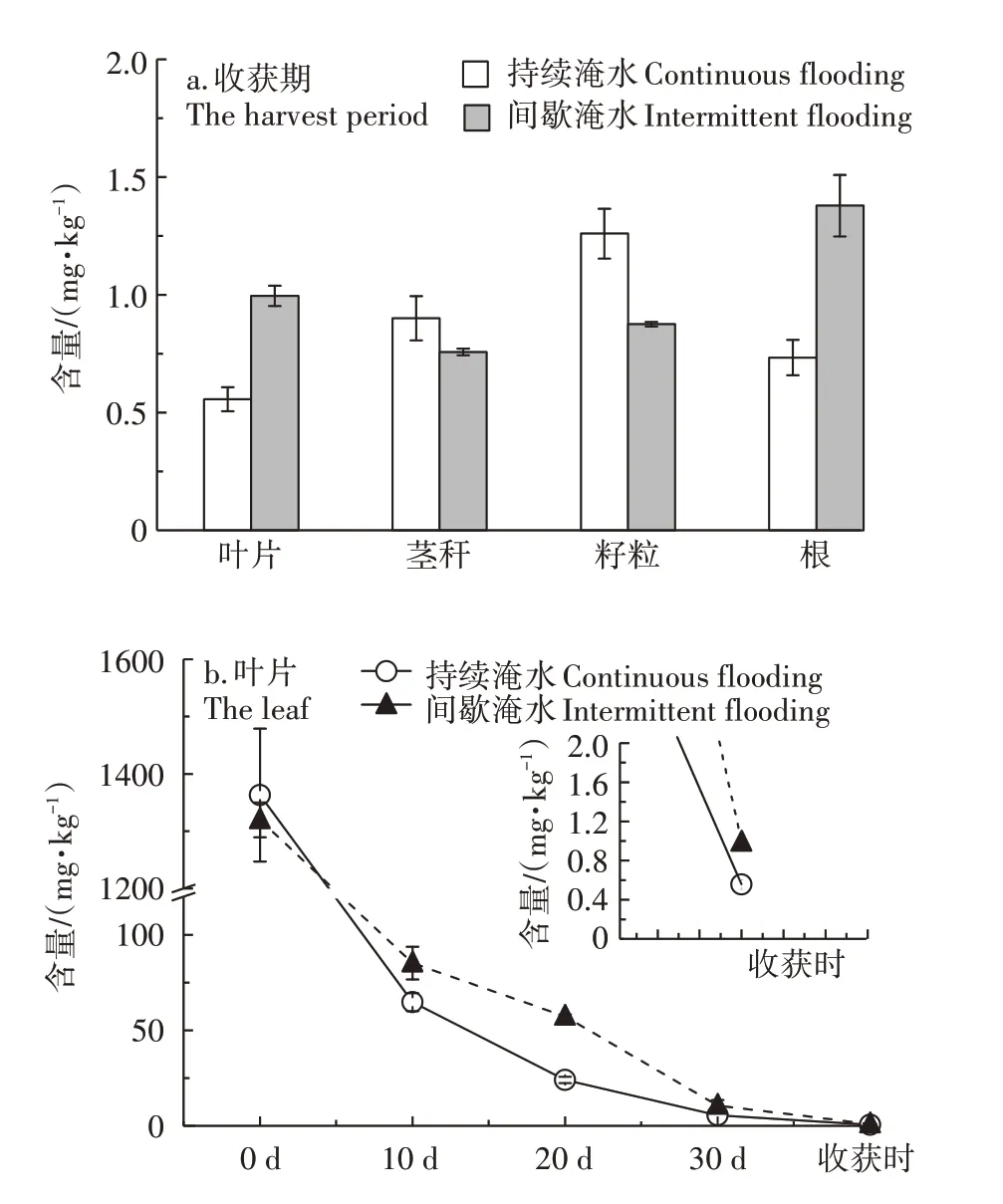
图6 收获期水稻各部位及施药后叶片中毒死蜱含量Figure 6 Dynamic changes of chlorpyrifos concentration in plant leaves during the test period
灌溉方式和降雨事件也都会对毒死蜱迁移转化和分配特征产生显著影响。田面水排干后可能促使表土开裂形成大量裂隙及大孔隙,从而利于毒死蜱向深层土壤迁移。有研究表明,对于强吸附性(高Koc)类农药(如毒死蜱、百菌清、硫丹等),农业流域河流在降雨径流过程中出现的高浓度输出现象主要是农药在所含表面活性剂等助剂的增溶作用下随地下优先流所致[25-27],而土壤大孔隙是农药优先运移的重要通道[28]。灌溉方式会对毒死蜱在水稻收获时植株各部位的分布产生影响,在本研究超量(为推荐施用量的4 倍)喷施的情况下,籽粒中所测得的毒死蜱含量已超过我国《食品安全国家标准》(GB 2763—2019)中规定的稻谷(整粒)中最大残留限量(0.5 mg·kg-1),在持续淹水与间歇淹水条件下分别达到限量标准的2.51倍和1.75倍。因此,尽管有报道表明籽粒的毒死蜱含量在稻壳和糠中的分配比例在90% 以上[29],但建议在红壤性水稻土中施用毒死蜱应严格执行推荐施用量。
4 结论
(1)在呈弱酸性的红壤性水稻土中毒死蜱淋溶作用较强,能够随下渗水快速迁移至深层土壤(达50 cm处)。
(2)气象环境因子(温度、降雨事件等)对田面水及土壤孔隙水中TCP 浓度变化的影响强于对毒死蜱的影响,土壤孔隙水中的毒死蜱浓度以及田面水与表层土壤孔隙水中的TCP浓度每日呈现明显的上午低、下午高的节律性变化。
(3)水稻收获时土壤中毒死蜱残留量较高,且剖面分布较为均匀。
(4)灌溉方式对收获时水稻各部位的毒死蜱含量有显著影响,间歇淹水处理可降低水稻籽粒和茎秆中的毒死蜱残留量。
