土壤中毒死蜱及主要代谢产物的降解与生态风险
2020-11-11刘寒冰王冬琦薛南冬邓艳玲袁雪红
刘寒冰,王冬琦,薛南冬*,邓艳玲,袁雪红
(1.生态环境部土壤与农业农村生态环境监管技术中心,北京100012;2.中国环境科学研究院,北京100012)
毒死蜱属杂环类有机磷农药,广泛应用于小麦、大豆等作物害虫防治[1-2]。毒死蜱在防治病虫害的同时可能导致对生态环境的污染[3]。研究表明,施用的毒死蜱只有不到1% 能作用于靶标生物[4],其余大部分将进入大气、水体和土壤环境中[1,5-7]。土壤中常见的 毒 死 蜱 降 解 产 物 是3,5,6 - 三 氯 吡 啶- 2 - 酚(TCP)[8-9]。TCP 比母体毒死蜱生物毒性更强,且与母体存在毒性协同效应[10-11],因此土壤中毒死蜱及TCP的环境污染及风险日益受到重视。近年来毒死蜱及其主要降解产物TCP 在农作物、土壤、底泥中的吸附[12-14]、残留分布[15-20]、迁移和降解[21-27]已有研究报道,而农田环境中毒死蜱及TCP 的环境风险分析仍然缺乏。本研究通过开展田间试验,研究在玉米、小麦和大豆3 种作物中喷施毒死蜱后土壤中毒死蜱及TCP的消解特征和污染分布特征,评估区域农田环境中毒死蜱及TCP的环境风险,为农药合理使用及农业环境保护提供科学依据。
1 材料与方法
1.1 主要仪器与试剂
高效液相色谱仪(LC-20AT,日本岛津公司);Syncronis C18 反相色谱柱(250 mm×4.6 mm×5 µm,美国Thermo Fisher Scientific 公司);TOC / TN 分析仪(MultiN/C 3100,德国耶拿分析仪器股份公司)。
标准品毒死蜱(99.6%)和标准品TCP(99.8%)均购自美国AccuStandard 公司;40% 毒死蜱乳油购自深圳诺普信农化股份有限公司;甲醇(色谱纯)和乙酸乙酯(色谱纯)购自上海安谱科学仪器有限公司;活性炭和过氧化氢(分析纯)购自国药集团化学试剂有限公司。
1.2 田间试验设计
田间试验位于北京市顺义区,该区域属暖温带大陆型半湿润季风气候。四季分明,光照充足,年平均气温11.5 ℃,年平均降水量622 mm。试验地块在中国环境科学研究院野外试验基地内,面积0.13 hm2,土壤类型为潮土。供试作物为玉米(品种为京单28)、大豆(品种为中黄38)和小麦(品种为春硕18)。
田间试验方法:采用随机区组设计,按照毒死蜱农药推荐高剂量(有效成分0.60 kg·hm-2)的1 倍(×1)、2 倍(×2)和5 倍(×5)3 个浓度水平施药,每个剂量3 个重复,小区面积30 m2(6 m2有效区面积),小区之间设有过道和保护行。
玉米采用人工点播,种植密度为每小区96 穴(12穴·行-1×8 行),播种深度4~6 cm,每穴定量播3 粒种子。大豆采用人工平播,种植密度为每小区200 穴(20 穴·行-1×10 行),播种深度3~5 cm,每穴定量播3粒种子。小麦采用人工条播,种植密度为每小区800株(80株·行-1×10行),播种深度3~4 cm。
用喷雾器对每个试验小区进行均匀喷施毒死蜱农药,并分别于施药后第0、1、3、5、10、15、21、30、45 d在每个试验小区随机采集土壤样品。随机选取5~10个点,用土钻采集0~20 cm 的土壤1~2 kg,去杂质、混匀后采用四分法留样500 g,第5、10、21、30 d 取土壤样品[30]时,分0~5、5~10、10~15、15~20 cm 4 个层次取样,土壤于-20 ℃保存备用。每个采样点都进行标记,以避免在之后的采样活动中从同一点取样。
1.3 样品前处理与检测
供试土壤为潮土,土壤采集并去除杂物后自然风干,过2 mm筛备用,供试土壤中毒死蜱未检出。土壤有机质和可溶性有机碳含量用MultiN/C 3100 总有机碳/氮分析仪测定;微生物量碳采用氯仿熏蒸提取法测定;土壤铵态氮采用2 mol·L-1KCl浸提靛酚蓝比色法测定;土壤硝态氮采用酚二磺酸比色法测定。供试土壤的主要理化性质见表1。
称取15 g 土壤样品于250 mL 锥形瓶中,加入50 mL乙酸乙酯-乙酸混合液(乙酸乙酯∶乙酸∶超纯水体积比为98∶1∶1)。在200 r·min-1条件下振荡1 h,收集上层清液,合并滤液于250 mL 锥形瓶中,加入20 mL 20% NaCl 溶液,在150 r·min-1条件下振荡10 min,静置20 min分液后除去水相,取上层有机相经无水硫酸钠脱水,浓缩至10 mL,将浓缩液转移至加入40 mg活性炭的50 mL 离心管中。振荡、过滤、浓缩、定容,过0.22 µm有机滤膜,测定毒死蜱和TCP浓度。

表1 供试土壤的主要理化性质Table 1 Physical and chemical properties of the soil samples
毒死蜱和TCP测定采用高效液相色谱法:流动相为甲醇/含有0.02% 乙酸的超纯水,体积比为90∶10,流速为1 mL·min-1,检测波长293 nm,柱温30 ℃,进样体积为10 µL。每次进行样品检测时都添加毒死蜱及TCP标样作为质控样。
在不同污染水平(0.2、0.5、1、5、10 mg·kg-1)下,分别用潮土(北京)和黑土(黑龙江)进行毒死蜱及TCP添加回收实验,毒死蜱和TCP 的加标回收率分别为80.38%~103.28% 和85.31%~102.56%,变异系数为2.52%~9.28% 和3.63%~9.76%,检出限分别为0.04 mg·kg-1和0.02 mg·kg-1。
1.4 土壤环境生态风险评估模型
利用模型预测毒死蜱施用后土壤环境中的残留浓度,基于预测浓度与毒性效应评估其对生态环境的短期与长期风险,同时根据农田土壤中毒死蜱实测值计算风险值,将二者进行比较。计算公式如下:
土壤中农药的短期生态风险通过土壤环境中农药预测浓度(PECS)来估算[28]:
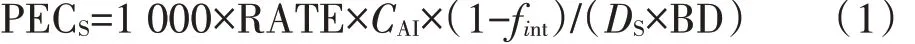
式中:PECS为土壤环境中农药的预测浓度,mg·kg-1;DS为短期风险下的表层土壤深度,m;CAI为农药中有效成分含量,mg·kg-1;fint为农药被作物截留的系数;RATE 为单位面积农药施用量,g·m-2;BD 为土壤容重,kg·m-3;1 000为单位换算系数。
土壤中农药的短期生态风险值(RVS):

式中:LCW为蚯蚓的急性半致死浓度,mg·kg-1;50 为安全系数,土壤中可能存在其他对该农药更敏感的生物。
土壤长期生态风险估算方法[29]如下所示。长期风险下土壤环境中农药的预测浓度(PECL)为:
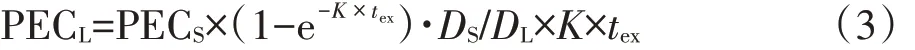
式中:PECL为农药长期风险下土壤环境中的预测浓度,mg·kg-1;DL为长期风险下的表层土壤深度,m;tex为慢性毒理实验暴露时间间隔,默认值为21 d;K 为土壤降解率常数,d-1。
农药的长期生态风险值(RVL)估算:

式中:NOECW为蚯蚓慢性无作用浓度值,mg·kg-1;100为安全系数,将这里的安全系数设定为短期风险时的两倍,是考虑到长期风险更大的不确定性,以及其他未知作用因素(如吸附、生物富集)可能造成土壤环境中该农药降解速度减缓或农药残留产生累积的情况。
比较RVS和RVL,取其中最大值代表土壤中农药的生态风险估算值,为了便于比较各RV 值,需要对该值进行标准化,对所有得到的风险值进行对数转换,使转换后得到的Rs 值绝大部分在0~100 之间(如果RS<0,则取RS=0),如下式:

以预测浓度与半致死浓度比值作为关注标准[15],依据公式(5)进行转换,得到风险值0~60、60~75、75~85 和>85,分别代表无风险、低风险、中等风险和高风险4个相对风险等级。
2 结果与讨论
2.1 表层土壤中毒死蜱及TCP的消解特征
土壤中毒死蜱浓度随时间的变化见图1。在种植小麦、大豆和玉米3 种作物土壤中,1 倍组与2 倍组毒死蜱残留量均无显著差异(P小麦=0.216、P大豆=0.165、P玉米=0.234),但5倍组与前两组相比毒死蜱残留量显著增加(P<0.05),3 组试验毒死蜱残留量都随着试验天数的增加而降低。土壤中不同剂量毒死蜱均在前期快速消解,随着时间延长,消解速率逐渐变缓。这可能主要由于前期土壤中毒死蜱浓度较高,使土壤吸附位点饱和,剩余部分溶解在土壤溶液相中被快速降解;随着时间延长其大部分被土壤吸附,导致毒死蜱消解趋于平缓。
毒死蜱在土壤中消解符合一级动力学方程,计算公式如下:
Ct=C0e-kt
式中:Ct为时间t(d)时土壤中毒死蜱的浓度,mg·kg-1;C0为土壤中毒死蜱的初始浓度,mg·kg-1;k 为消解速率常数,d-1。
毒死蜱的半衰期DT50(d)计算公式为:
DT50=ln2/k
不同试验条件下毒死蜱消解速率与半衰期计算结果见表2。毒死蜱在不同处理土壤中的半衰期为7.86~24.84 d,均小于30 d,3 种作物种植土壤中毒死蜱的消解速率常数为0.027 9~0.088 2 d-1。毒死蜱在不同作物种植土壤中的降解速率差异不显著(P=0.807>0.05)。从半衰期时间看,施用5 倍剂量毒死蜱的半衰期是施用1 倍剂量的2~3 倍,施用量越大毒死蜱半衰期越长。这可能是由于低剂量毒死蜱施用到土壤后,土壤表面残留的毒死蜱接受紫外线辐射发生光解,同时土壤溶液相中的毒死蜱被微生物利用降解导致半衰期较短;当高剂量毒死蜱施用到土壤后,除少量发生光解外,残留土壤中的高浓度农药抑制了土壤微生物活性,导致其消解速率变慢。
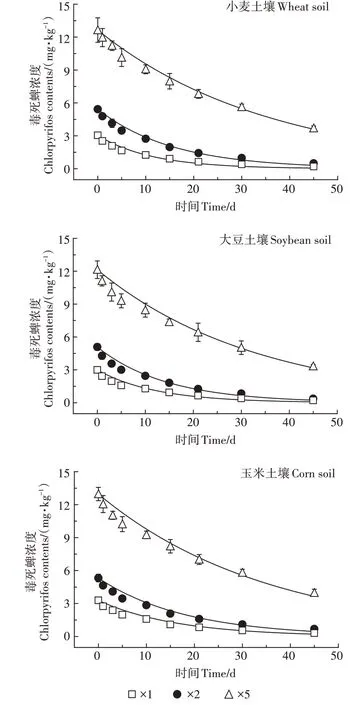
图1 毒死蜱在农田土壤中消解情况Figure 1 Dissipation of chlorpyrifos in farmland soil
TCP 是毒死蜱的主要消解产物,由于TCP 水溶性较大、抗降解能力较强、易迁移,因此有必要对其进行相应的分析。作物土壤中施用不同剂量毒死蜱后主要代谢产物TCP 变化见图2。从图2可以看出TCP 在0~20 d 时浓度呈上升趋势,20 d 后浓度下降。由图1可知,毒死蜱在20 d 后消解速率趋缓,浓度几乎不再发生变化。即TCP 的变化趋势与毒死蜱在土壤中消解趋势互补,这也表明在试验中TCP是毒死蜱的主要降解产物。种植3 种作物土壤中TCP 浓度变化趋势相似,浓度大小也基本相同。施加3 种剂量毒死蜱的土壤中,施用剂量越大其在土壤中消解后产物浓度越高。
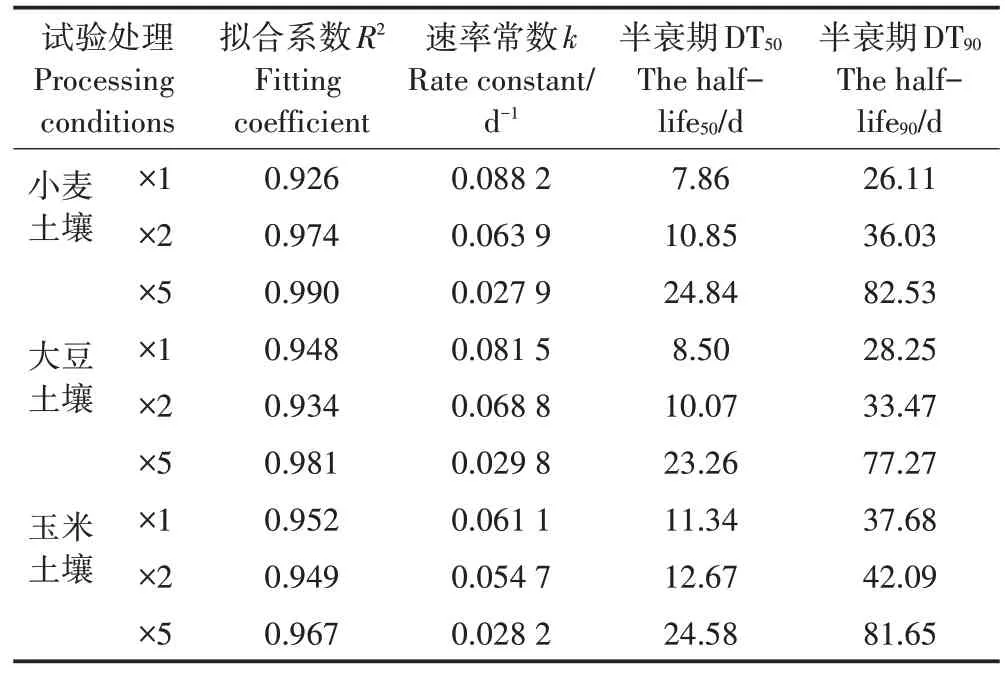
表2 不同浓度处理土壤中毒死蜱消解速率常数与半衰期Table 2 Dissipation rate constant and half-life of chlorpyrifos in soil treated with different concentrations
2.2 土壤中毒死蜱及TCP的残留垂向分布
不同施用剂量下毒死蜱浓度在土壤中垂向分布随时间的变化见图3。由图3可知,3种作物种植土壤前期均表现为0~5 cm 土壤中毒死蜱残留量最大,15~20 cm土壤中毒死蜱残留量最小,即随着深度的增加,土壤中毒死蜱的残留量逐渐降低。随着时间的延长,0~10 cm 土壤中毒死蜱残留量逐渐减少,10~20 cm 土壤中毒死蜱残留量逐渐增加,同时,3 种作物表层土壤中毒死蜱的残留分布均表现为随着剂量的增加,深层土壤中毒死蜱的量逐渐增加。实验后期可以在15~20 cm 土壤中检测到毒死蜱但含量较低,这说明毒死蜱大部分集中于0~15 cm 表层土壤。随着土壤深度增加土壤中毒死蜱残留量减少,这与种植作物根系微环境有关。作物根系及其微生物群穿透土壤团聚体提高土壤有机质含量,而水溶性低、辛醇-水分配系数较高的毒死蜱与土壤有机质的牢固结合,使得毒死蜱难以继续向下迁移。另外,我们观察到在实验中后期,尽管毒死蜱被表层土壤强烈吸附,但均可在15~20 cm 底层土壤中检测到。这主要由于在实验中期,实验区记录到一次20 mm 的自然降雨,有少量毒死蜱随降水或随溶解性有机物质迁移到了更深层土壤中。已有研究表明,一些水溶性低、在土壤中强烈吸附的农药,可在降雨后快速垂直运动至较深层土壤,这主要由于溶解的有机物质和其他颗粒介导的大孔隙中的胶体转运,导致其在土壤中迁移。此外,添加到农药喷洒配方中的表面活性剂可能有助于增加溶解度和浸出。有研究表明,不同的活性剂在一定条件下都能提高毒死蜱的水溶性,但有的活性剂能促进土壤对毒死蜱的吸附,有的会降低其吸附性能。本试验所用药剂为40% 的毒死蜱乳油,虽然毒死蜱本身水溶性较小,但乳油和水形成稳定的悬浮液可以通过土壤孔隙随水向下移动,这说明毒死蜱乳油中含有降低其吸附性能的表面活性剂,这也为底层15~20 cm土壤中毒死蜱的残留提供了证据。
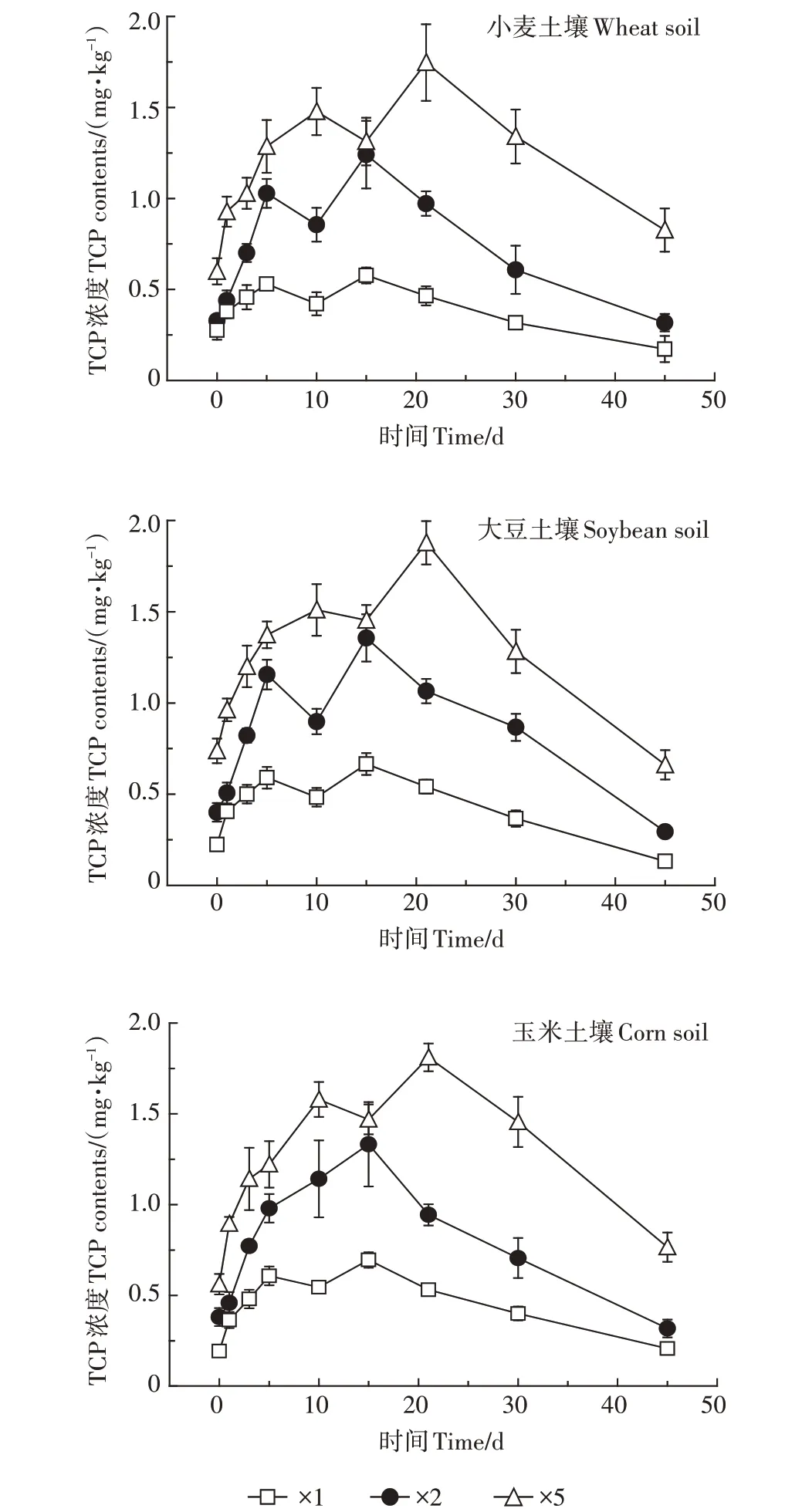
图2 农田土壤中TCP浓度随时间的变化Figure 2 Changes in the contents of TCP in soil under different water conditions
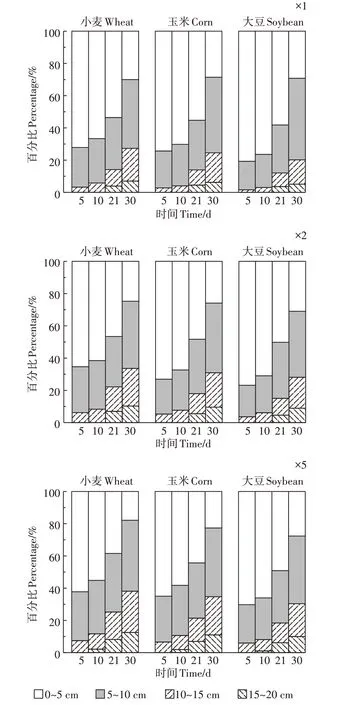
图3 不同浓度毒死蜱在农田土壤垂向分布情况Figure 3 Changes in the contents of TCP in soil under different water conditions
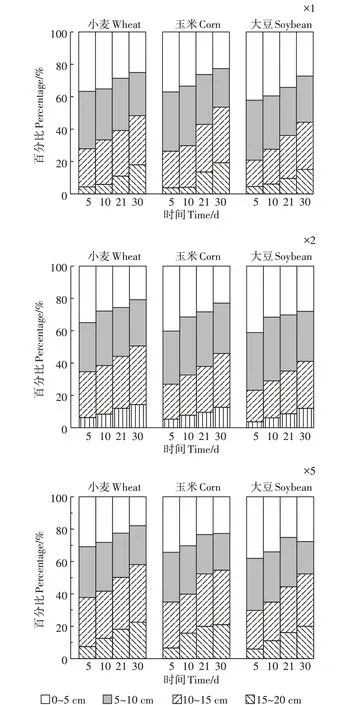
图4 不同浓度毒死蜱下TCP在农田土壤垂向分布情况Figure 4 The vertical distribution of TCP in soil under different concentrations of chlorpyrifos
图4 为不同浓度毒死蜱施用后土壤中TCP 的垂向分布情况。由图4 可知,3 种作物种植土壤前期均表现为随着深度的增加土壤中TCP 的残留量逐渐降低,随着时间的延长,0~10 cm 土壤中TCP 残留量逐渐减少,10~20 cm 土壤中TCP 残留量逐渐增加,同时,3 种作物表层土壤中TCP 的残留分布均表现为随着剂量的增加深层土壤中TCP 残留量逐渐增加。试验前期,15~20 cm土壤层中,均可检测到少量TCP,试验后期,由于自然降雨,15~20 cm 土壤层中TCP 残留量增加明显,这说明TCP 与毒死蜱相比更易迁移,这主要由于其水溶性较大,与土壤有机质等结合能力较弱。不同作物种植土壤中TCP残留差异不显著(P1倍=0.805、P2倍=0.834、P3倍=0.950)。TCP 降解与作物根系微环境有关,作物根系穿透土壤团聚体影响土壤有机质分解,从而影响TCP在土壤中的迁移。本研究结果进一步证明了TCP比母体毒死蜱更容易迁移,甚至通过径流作用进入水体,有较高的潜在环境污染风险。
2.3 不同毒死蜱施用剂量对土壤环境生态风险评估
本研究使用药剂为40% 的毒死蜱乳油,毒死蜱的特征参数主要参考PPDB 农药数据库的典型实验数据[30],毒死蜱对蚯蚓的急性半致死浓度(LC50)为129 mg·kg-1,慢性无作用浓度(NOECW)为12.7 mg·kg-1,毒死蜱在砂土中的半衰期(DT50)为50 d。对不同农作物及其生长时期对喷(撒)施在其上农药的截留试验数据,根据模型相关研究结果,玉米、大豆和小麦的截留系数分别为0.89、0.22和0.11[31]。
不同毒死蜱施用剂量下土壤环境预测生态风险与实测生态风险比较见图5。从图5 可以看出,随着毒死蜱施用剂量的增加,3 种作物种植土壤短期和长期生态风险均表现出增大的趋势。同时,相同浓度的毒死蜱施加到不同作物农田中,其短期和长期生态风险有明显差异。通过生态风险预测模型计算出的短期和长期生态风险结果显示,当毒死蜱以推荐剂量分别施用到玉米、大豆和小麦田中,其短期生态风险值分别为53.34、68.66 和69.69,长期生态风险值分别为59.42、74.74 和75.77,表明毒死蜱以1 倍推荐剂量施用于不同作物农田中,其生态风险有明显差异,玉米田处于无风险,大豆田处于低风险,小麦田则达到中等风险;当毒死蜱以2 倍推荐剂量分别施用到玉米、大豆和小麦田中,其短期生态风险值分别为58.76、74.08、75.11,长期生态风险值分别为64.84、80.15、81.19,表明毒死蜱以2倍推荐剂量施用于不同作物农田中,玉米田处于低风险,大豆田和小麦田均达到中等风险;当毒死蜱以5 倍推荐剂量分别施用到玉米、大豆和小麦田中,其短期生态风险值分别为65.93、81.24、82.27,长期生态风险值分别为72.00、87.32、88.35,风险值计算结果表明毒死蜱以5倍推荐剂量施用于不同作物农田中,玉米田处于低风险,大豆田和小麦田均达到高风险等级。
对施用毒死蜱后的农田土壤中残留浓度进行实测并计算其短期和长期生态风险值,从图5 可以看出,3 种作物土壤中毒死蜱残留浓度的短期和长期风险均随着剂量增加而增加。土壤中毒死蜱残留浓度的生态风险结果显示,当毒死蜱以1、2 倍和5 倍推荐剂量分别施用到3 种作物农田中,根据农田土壤中残留浓度实测值计算其短期和长期生态风险值,玉米、大豆和小麦农田土壤中短期生态风险值分别为81.13、86.22、97.81,79.10、84.40、97.14 和78.98、85.39、97.60,长期生态风险值分别为104.09、107.86、110.96,105.29、108.71、111.03和106.00、108.86、110.60。利用土壤中毒死蜱残留浓度计算生态风险值,结果表明,以1、2倍和5倍推荐剂量施用到3种作物农田中其生态风险均达到了高风险等级。从不同浓度毒死蜱对小麦、大豆和玉米作物种植土壤中TCP的土壤环境短期和长期生态风险值(预测值与实测值)可以看出,模型预测浓度计算的生态风险值较基于实测土壤中毒死蜱浓度计算的生态风险值均偏低,表明模型预测浓度结果过于保守,与实际情况有所偏差。实测浓度偏高主要由于试验期间的降雨对植株表面的农药冲刷增加了土壤中农药的残留量。此外,研究区内气候、土壤特性、灌溉等因素同样有可能影响预测结果的准确性。
TCP 是土壤中毒死蜱主要消解产物,其生物毒性高于毒死蜱,施用毒死蜱后的土壤中TCP的生态风险不容忽视。本研究中不同剂量毒死蜱施用到3 种作物农田后TCP的短期和长期生态风险值见图6。
从图6 可以看出,随着毒死蜱施用剂量的增加,3种作物种植土壤中TCP 的短期和长期生态风险值均表现出增大的趋势。当毒死蜱以1、2倍和5倍推荐剂量分别施用到3 种作物农田中,TCP 在玉米、大豆和小麦农田土壤中短期生态风险值分别为81.13、86.22、97.81,79.10、84.40、97.14 和78.98、85.39、97.60,长期生态风险值分别为104.09、107.86、110.96,105.29、108.71、111.03 和106.00、108.86、110.60。利用TCP 残留浓度计算生态风险值,结果表明,以1、2 倍和5 倍推荐剂量施用到3 种作物农田中,其生态风险均达到了高风险等级。观察到与毒死蜱相类似的情况,以不同浓度施用到不同作物农田时,TCP 具有相对较高的长期生态风险,这主要是由于TCP 在土壤中半衰期较长,且蚯蚓的慢性无作用浓度较低(NOECW=5.1 mg·kg-1)。可见,当超推荐剂量施用毒死蜱到农田时,TCP具有较高生态风险。

图5 不同剂量毒死蜱施用后预测和实测生态风险值Figure 5 Predicted and measured ecological risk values under different doses of chlorpyrifos applied
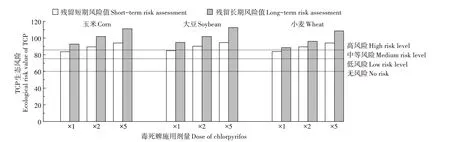
图6 不同浓度毒死蜱施用后TCP短期和长期生态风险值Figure 6 Short-term and long-term ecological risk values of TCP after application of chlorpyrifos at different concentrations
3 结论
(1)施药后,小麦、大豆、玉米3 种作物农田土壤中毒死蜱均在前期表现出快速消解,随着时间延长,消解速率逐渐变缓。3 种作物种植土壤中毒死蜱的半衰期为7.86~24.84 d(均小于30 d),消解速率常数为0.027 9~0.088 2 d-1。
(2)小麦、大豆、玉米3 种作物土壤中前期随着深度的增加土壤中毒死蜱的残留量逐渐降低,0~5 cm土壤中毒死蜱残留量最大,15~20 cm 土壤中毒死蜱残留量最小;随着时间的延长,0~10 cm 土壤中毒死蜱残留量逐渐减少,10~20 cm 土壤中毒死蜱残留量逐渐增加。TCP 比母体毒死蜱更容易迁移,有较高环境污染风险。
(3)随着毒死蜱施用剂量的增加,小麦、大豆、玉米3 种作物农田土壤中毒死蜱及TCP 的短期和长期生态风险均增大。当超推荐剂量毒死蜱施用到玉米、大豆和小麦3 种作物农田时,毒死蜱及TCP 的短期和长期生态风险均较高,其中TCP 生态风险在3 种作物农田中均达到了高风险等级。
