毒死蜱降解菌降解特性及其降解条件优化
2020-11-11杜晓敏王金花朱鲁生王军杨莉莉林琳
杜晓敏,王金花,朱鲁生,王军,杨莉莉,林琳
(山东农业大学资源与环境学院,山东省高校农业环境重点实验室,山东 泰安271018)
毒死蜱作为广谱性有机磷杀虫剂具有高效、中等毒性等优点,是目前全球范围内应用最广泛的5种杀虫剂之一,广泛应用于蔬菜、棉花等作物[1-3]。毒死蜱在农业生产上大量使用,其残留问题也引起了人们的关注。随着使用量的增加,毒死蜱有可能通过多种途径进入地表水、地下水,对水生生物存在高风险,并最终影响环境生物和人体健康[4-5]。Smalling 等[6]发现在加利福尼亚州沿海中心河口处,鱼类和无脊椎动物体内频繁检测出毒死蜱的存在。Campillo 等[7]在地中海沿海的一个流入湾湖的永久性河道口中发现,毒死蜱含量在所监测到杀虫剂中最高。毒死蜱在全球范围内的广泛使用,导致其在全球很多地区都可以被检测到,虽然这种残留量还不会导致水生生物养殖区和自然水体中水生生物的大量死亡或灭绝,但是会通过生物富集或者其他方式间接进入人体,最终影响人类健康[8]。有研究表明,日常暴露在毒死蜱污染环境下的人群的呼吸系统患癌率要高于其他人群[9]。调查显示,农业生产中使用的毒死蜱大部分最终会进入土壤环境,对土壤环境产生负面影响,毒死蜱施用到水稻土中,土壤中真菌数量明显减少,土壤酶活性也受到一定影响[10]。因此,毒死蜱污染土壤修复需求越来越迫切。
微生物修复技术是目前应用最广的农药污染土壤生物修复技术。自20 世纪70 年代以来,已分离并鉴定出多株以毒死蜱为碳源和能源的真菌和细菌,其中黄杆菌(Flavobacterium sp.)[11]是最早发现并被报道的毒死蜱降解菌。另外,已报道的毒死蜱降解菌主要有青枯菌(Ralstonia sp.)[12]、镰孢霉属(Fusarium LK.ex Fx)[13]和粪产碱杆菌(Alcaligenes faecalis)[14]等。Yadav等[15]筛选获得的一株假单胞菌(Pseudomonas sp.)可以有效降解高浓度毒死蜱,毒死蜱浓度为500 mg·L-1时的24 h 降解率为60%。张群等[16]筛选出一株寡养单胞菌(Stenotrophoomonas sp.),在100 mg·L-1毒死蜱溶液中,pH 7.0、温度30 ℃培养条件下,4 d 内毒死蜱降解率为59%。尽管目前对毒死蜱生物降解的研究已经取得了明显进步,但仍需要分离更多降解菌以适应不同环境的需要。为进一步丰富毒死蜱降解菌菌种资源,优化菌株降解条件,本研究从大田土壤中筛选分离出1 株毒死蜱高效降解菌,并对其进行鉴定,采用响应面分析法对菌株降解条件进行优化以提高降解效率,以期为毒死蜱污染土壤原位生物修复提供材料和方法基础。
1 材料与方法
1.1 实验材料
毒死蜱原药(97%)由山东华阳集团提供。气相色谱分析所用试剂为分析纯。
LB 液体培养基:NaCl 10.0 g,蛋白胨10.0 g,酵母粉5.0 g,蒸馏水1 000 mL,调节pH 到7.0 左右,在121 ℃下高压灭菌20 min。
无机盐基础培养基:K2HPO45.8 g,KH2PO44.5 g,(NH4)2SO42.0 g,MgSO40.16 g,CaCl20.02 g,Na2MoO40.002 g,FeSO40.001 g,MnCl20.001 g,蒸馏水1 000 mL,调节pH 到7.0 左右,在121 ℃条件下高压灭菌20 min。
LB 固体培养基:NaCl 10.0 g,蛋白胨10.0 g,酵母粉5.0 g,琼脂粉15.0 g,蒸馏水1 000 mL,调节pH 到7.0左右,在121 ℃条件下高压灭菌20 min。
毒死蜱母液:取1 g 毒死蜱,以丙酮为溶剂,定容到100 mL 容量瓶中,充分摇匀,配成10 000 mg·L-1母液。
毒死蜱溶液:取0.25 mL 毒死蜱母液放入100 mL无机盐溶液中,使其浓度为25 mg·L-1。
1.2 毒死蜱降解菌的富集与分离
取5 g 土壤加入到50 mL 100 mg·L-1的毒死蜱无机盐富集培养液中,置于30 ℃、150 r·min-1恒温摇床培养7 d,以后每隔7 d按10%接种量取培养液接入新鲜毒死蜱无机盐基础培养基中,以一定浓度梯度提高毒死蜱用量,至培养液浓度达到1 000 mg·L-1,如此驯化约2 个月。采用平板划线法,将最后一次培养液进行分离,4 ℃冰箱保存。
1.3 高效毒死蜱降解菌的筛选
将保存的纯化菌株接种至LB 固体培养基中,划线分离单菌落。挑取单菌落至LB 液体培养基中,30 ℃、150 r·min-1恒温振荡培养至对数生长期后期。连续活化2 代后,用生理盐水将培养液离心洗涤两次并使菌体重悬。以3% 接种量接种至毒死蜱无机盐基础培养基中,振荡培养24 h 后检测毒死蜱含量,从中挑选降解毒死蜱能力最强的菌株。
1.4 形态特征鉴定
肉眼观察降解菌的菌落形状、颜色、透明度、隆起和边缘特征,利用扫描电镜观察菌体大小和表面形态。
1.5 16S rDNA基因序列的测定
细菌基因组DNA 采用EasyPure Genomic DNA Kit试剂盒进行DNA 提取和纯化,对菌株的16S rDNA基因进行PCR 扩增,细菌通用引物序列F:5′ -AGAGTTTGATCCTGGCTCAG-3′;R:5′-GGCTACC TTGTTACGACT-3′[17]。PCR 反应程序:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1 min,循环30 次;72 ℃终延伸10 min。待反应结束后,取PCR产物进行琼脂糖凝胶电泳检测,于凝胶图像成像仪中观察凝胶电泳结果。由生工生物工程(上海)股份有限公司完成后续PCR扩增产物测序。
1.6 毒死蜱降解菌降解率的测定
毒死蜱浓度采用安捷伦7890B 气相色谱仪测定。检测器为FID,检测器温度为300 ℃,进样口温度为260 ℃;柱温为程序升温,初始温度为140 ℃,以15 ℃·min-1升到200 ℃,保持1 min;载气流量为7 mL·min-1;压力为209 kPa,恒压模式;空气流量为300 mL·min-1,H2流量为40 mL·min-1;尾吹流量为10 mL·min-1;进样量为1 µL,保留时间4.6 min。本研究采用外标法,方法检出限为0.05 µg·L-1,定量限为1.7 µg·L-1。毒死蜱降解率计算公式:

式中:A0为未接菌对照培养液中毒死蜱的浓度,mg·L-1;A为接菌处理培养液中毒死蜱的浓度,mg·L-1。
1.7 毒死蜱降解菌降解特性
1.7.1 环境条件对菌株降解毒死蜱的影响
(1)时间对毒死蜱降解率的影响
以3% 接种量将菌悬液接种至50 mL 毒死蜱无机盐培养液中,培养时间为12、24、48、72、96 h,pH 为7.0,恒温培养箱25 ℃、150 r·min-1振荡培养,底物浓度为25 mg·L-1条件下,取样测定,计算毒死蜱降解率。
(2)温度对毒死蜱降解率的影响
以3% 接种量将菌悬液接种至50 mL 毒死蜱无机盐培养液中,底物浓度为25 mg·L-1,pH 为7.0,调整培养温度分别为15、20、25、30、35 ℃,150 r·min-1条件下振荡培养,48 h后分别取样测定并计算毒死蜱降解率。
(3)pH对毒死蜱降解率的影响
将毒死蜱浓度为25 mg·L-1的无机盐培养液调整pH 为4.0、6.0、7.0、8.0、10.0,高温灭菌后接种降解菌,接种量为3%,在25 ℃、150 r·min-1条件下振荡培养,48 h后取样测定并计算毒死蜱降解率。
1.7.2 响应面实验
在单因素试验基础上,利用Design-Expert 8.0.6软件中Box-Behnken design(BBD)模型进行3 因素3水平实验设计,以培养时间(A)、pH(B)、温度(C)为自变量,以降解率为唯一响应值,实验设计因素水平见表1。
1.7.3 降解酶定位实验
(1)降解酶提取方法
培养24 h 的菌H27 培养液于4 ℃、8 000 r·min-1条件下离心6 min,将下层菌体冷冻保存,加入适量的(NH4)2SO4于上清液中,混匀后使饱和度达到90% 以上,4 ℃盐析过夜,离心后收集下层沉淀,加入0.05 mol·L-1、pH 为7.5 的PBS 缓冲液重悬,用相同缓冲液透析至无,收集透析液即为胞外酶[18]。
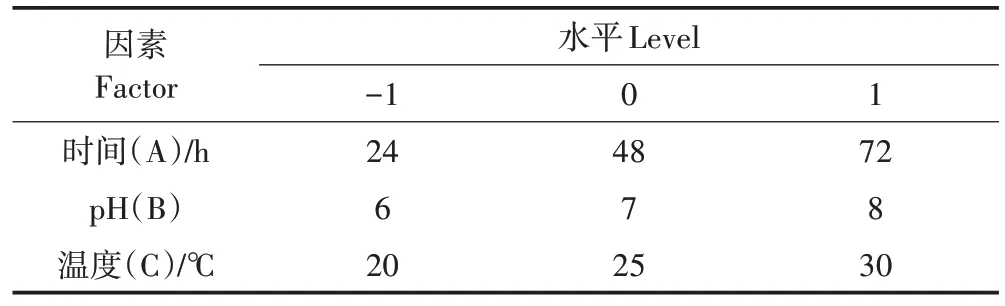
表1 实验设计因素水平表Table 1 Factors and levels of experiment design
将上一步保存的菌体溶于10 mL 0.005 mol·L-1、pH 为7.5 的Tris-HCl 缓冲液中,25 ℃振荡20 min,再次4 ℃、8 000 r·min-1离心6 min,下层菌体重悬于冷超纯水中,冰浴振荡6 min后离心,上清液即为细胞周质酶。
用现配的0.05 mol·L-1、pH为7.5的PBS缓冲液将保存收集的菌体洗涤3 次,收集的菌体按3 mL·g-1缓冲液重悬,超声破碎480 s(功率300 W,工作时间4 s,间隔2 s),将破碎细胞液于4 ℃、8 000 r·min-1条件下离心10 min,上清液即为胞内酶[18]。
(2)降解酶定位
将试验提取的3 种粗酶液各取1 mL 加入到50 mL 毒死蜱降解培养液中,30 ℃、150 r·min-1培养6 h,并设不加酶液的对照组,测定体系中毒死蜱浓度,并计算降解率及酶活力,进而确定酶在细胞中的分布情况。定义毒死蜱活力单位(U)为30 ℃条件下,1 mL酶液1 h转化1 mol毒死蜱所需酶量。
2 结果与分析
2.1 菌株的分离及鉴定
经分离和纯化获得一株毒死蜱高效降解菌,降解率在80% 以上,命名为H27。菌株H27菌落培养特征和扫描电镜图如图1 所示。其形态学特征如下:细胞呈杆状,能产生芽孢;无鞭毛,不能运动。在LB 平板上的菌落形态:圆形,乳白色半透明,边缘整齐,中间隆起,较黏稠。
通过将菌株16S rDNA 序列与GenBank 上其他16S rDNA 序列进行Blast 分析(图2),发现菌株H27与枯草芽孢杆菌(Bacillus subtilis)的相似性为100%。综合菌株形态特征以及16S rDNA 序列分析结果,初步鉴定菌株H27为枯草芽孢杆菌(Bacillus subtilis)。
2.2 环境因素对菌株H27降解毒死蜱效果的影响
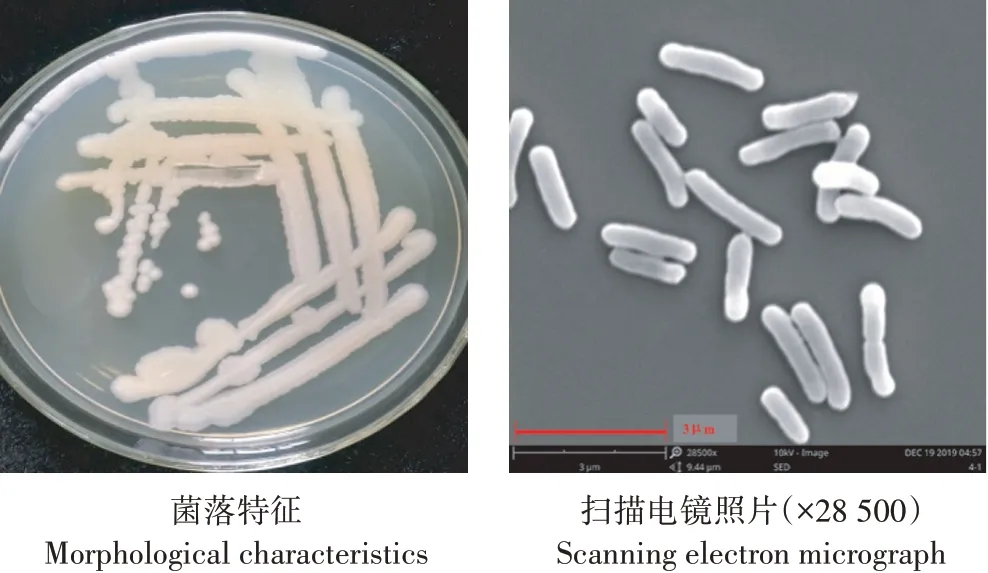
图1 菌株H27菌落形态及扫描电镜图Figure 1 Colony of strain H27 and scanning electron microscopic
图3 为不同时间、不同温度和不同pH 对菌株H27 降解毒死蜱效果的影响。降解菌H27 对毒死蜱的降解随培养时间的变化如图3A所示。从图中可以看出,随着培养时间的延长,降解菌对毒死蜱的降解率不断增大,在第24 h 时降解已经趋于稳定状态,平均降解率在80% 以上,说明H27 对毒死蜱具有高效降解效果。
降解菌H27 对毒死蜱的降解随温度的变化如图3B 所示。从图中可以看出,随着培养温度的升高,降解菌对毒死蜱的降解率不断增大,在25 ℃时达到最大值,随着温度继续升高,毒死蜱的降解速率受到明显抑制。
降解菌H27 对毒死蜱的降解随pH 的变化如图3C 所示。从图中可以看出,降解菌对毒死蜱的降解率随pH 增大先增大后减小,在pH 为7.0 时达到最大值,为87.2%。
2.3 菌株H27降解毒死蜱条件的优化
综合考虑各因素对菌H27毒死蜱降解率的影响,在单因素降解试验基础上,利用响应面分析法对降解时间、温度、pH 3 个因素分析得到菌H27 的最佳降解条件。菌H27 响应面分析实验设计及结果如表2 所示,对表2 中的数据进行多元回归拟合,获得菌H27对自变量温度、时间、pH 的二元多次回归方程为:降解率=88.46+0.90A+3.06B-0.80C-1.40AB+0.18AC-0.43BC-1.03A2-5.99B2-5.60C2。由表2 可以看出零点实验点的降解率较稳定,均在88%左右。

图3 时间、温度、pH对菌株H27降解毒死蜱的影响Figure 3 Effects of time,temperature and pH on chlorpyrifos degradation by H27

图2 菌株H27的16S rDNA系统发育树Figure 2 Phylogenetic tree of strain H27 on the 16S rDNA sequence
实验结果的回归分析见表3。对菌H27 降解率的回归方程进行检验,建立的模型是否有意义取决于P值大小,P值远小于0.01,说明建立的模型有意义;失拟误差P 值为0.254 6,不显著,说明方程对实验拟合情况较好,误差小;模型校正决定系数R2为0.998 5,说明此模型能解释99.85% 的响应值变化,即此模型与数据拟合度很高,实验误差小;标准偏差(Std)为0.29,平均数为82.52,变异系数(CV)为0.35%,表明该模型具有较高的置信度,能够有效反映真实值的情况。因此,该模型对菌H27降解毒死蜱条件的优化合理而有效。
根据回归方程绘制响应面和等高线图,结果如图4 所示。由图4 和表3 可知,降解时间(A)和pH(B)的交互作用显著,B 影响显著性大于A,AB 的交互作用显著。A 和C、B 和C 对降解菌的降解率影响显著,但AC、BC的交互作用不显著。
通过Box-Behnken 响应面优化得到枯草芽孢杆菌H27 降解毒死蜱的最佳降解条件为:降解时间54 h,pH 为7.2、温度为24 ℃时,毒死蜱降解率理论最优值为88.96%。在此条件下进行实际毒死蜱降解实验,得到实际毒死蜱降解率为88.16%(3 次重复平均值),与理论最优值拟合度达到99.20%,表明通过响应面法对菌H27降解毒死蜱条件的优化合理有效,并具有实际意义。
2.4 毒死蜱降解酶的定位
提取毒死蜱降解酶,分别测定胞外酶、胞内酶和细胞周质酶对毒死蜱降解效果的影响,实验结果如表4所示。结果表明,胞外粗酶液与毒死蜱反应,30 min内毒死蜱降解率为23.9%;胞内粗酶液的酶活性较强,降解率为49.6%;细胞周质酶活性略有减小,降解率为35.2%。由此推断出降解菌产生降解毒死蜱的关键酶是胞内酶。

表2 菌H27的响应面分析试验设计及结果Table 2 Experimental design for response surface analysis and corresponding experimental data
3 讨论
本研究成功分离出一株能降解毒死蜱的菌株,经鉴定为枯草芽孢杆菌(Bacillus subtilis)。目前从不同地方分离出属于芽孢杆菌属的毒死蜱降解菌已有很多,如侧芽孢杆菌DSP[19]、Dsp-1和Dsp-3[20],蜡状芽孢杆菌HY-1[21]、HY-4[22]和FO-36bT[23]等。有报道指出,该属细菌能降解许多污染物,如石油烃、苯酚、有机磷农药等[24-25]。已有研究显示芽孢杆菌属菌株在污染物微生物修复方面具有巨大潜力。但报道也指出,多数毒死蜱降解菌环境适应性较差,例如侧芽孢杆菌DSP 在其降解最适pH 为7.0 时,降解率在60% 以上,而pH为5.0和9.0时,毒死蜱降解率仅为20%和30%,说明该毒死蜱降解菌受pH 影响较大,环境适应性较差。本研究中降解菌H27为枯草芽孢杆菌,属于典型的有益细菌,具有控制不同类型细胞发育的能力。因此其对外界有害因子抵抗力强,分布于土壤环境、水环境、大气环境及动物肠道等处。降解菌H27在中性或弱碱性的条件下都具有较高的活性,在pH为4.0以及pH 为10.0 的条件下依然具有明显的降解效果,即使最低的降解率也达到了54.81%,所以该菌对pH 具有较高的耐受性,可以适应比较宽范围的pH变化。

表3 菌H27响应分析试验回归分析结果Table 3 Results of the regression analysis of response analysis
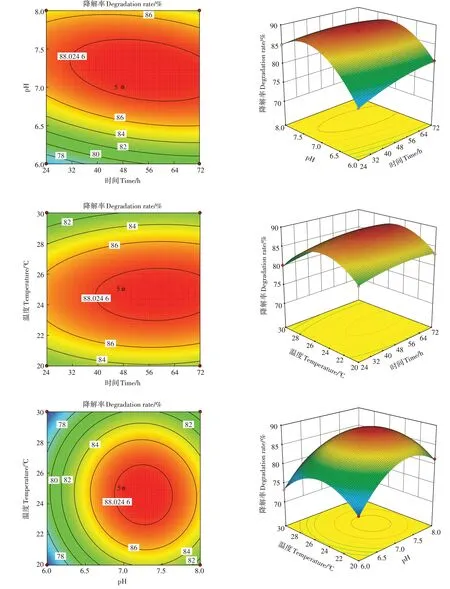
图4 时间、温度和pH及其交互作用对毒死蜱降解率影响的曲面图和等高线图Figure 4 Response surface and contour plot of time,temperature,pH and their interactions on degradation of chlorpyrifos

表4 菌H27不同组分对毒死蜱的降解Table 4 Biodegradation of chlorpyrifos in the different component of strain H27
响应面分析法是结合实验设计和数学建模的一种方法,目的是寻找多因素系统中的最佳条件,已被广泛应用到微生物培养基优化中,但利用响应面分析法优化降解条件的研究较少。已报道的降解菌降解特性研究大部分都以单因素实验为主,例如范瑞娟等[26]研究了不同盐度和pH 条件下菌株对多环芳烃(PAHs)的降解特性;钱娜等[27]研究了不同pH、温度和NaCl浓度对降解菌株生长的影响;贺强礼等[28]运用单因素实验初步确定苯酚降解的最适条件,在此基础上利用响应面分析法确定其最优降解条件,优化后的最佳降解条件可使菌株对苯酚降解率提高7% 左右;王博等[29]在响应面法优化氨氮降解菌净化高原地区污水研究中发现,降解时间、pH 和接种量对降解率有显著影响,且3 因素交互作用对响应值有一定影响,响应面分析法所得最佳降解条件比单因素实验降解条件下提高8.12%。由此可以看出,与单因素实验相比,在响应面分析优化后的降解条件下菌株降解率会有一定提高。本研究利用响应面法优化设计,研究了时间、pH 和温度3 个因素对菌株降解毒死蜱效果的影响,得到最佳降解条件下降解率有一定提高,且实际降解率与预测值接近,说明此方法能有效预测并优化菌株对污染物的降解。在后续研究中可利用研究所得模型与实际农药降解相结合,最大程度地去除环境中的农药污染。在研究中发现,通过响应面实验优化降解条件,一定程度上提高了降解菌降解率,但仍不能达到100%,推测可能是毒死蜱降解产物对毒死蜱降解过程产生了影响。有研究表明毒死蜱初级代谢产物为3,5,6-三氯-2-吡啶酚(TCP),累积的TCP会对环境中细菌、真菌和放线菌产生一定抑制作用,不仅影响微生物自身生长繁殖,还会抑制毒死蜱降解[30-31]。
生物降解是通过生物作用,将大分子物质转化成小分子化合物的过程。生物降解农药主要通过微生物及有关酶来进行。目前研究普遍认为毒死蜱主要通过共代谢和矿化作用进行微生物降解[32]。微生物降解化学农药的作用方式有两大类:一类是通过酶促反应。首先微生物细胞表面吸附农药,此过程是动态平衡,降解初期出现“迟缓期”;然后农药进入细胞内;最后农药在细胞膜内发生酶促反应,此过程较快。微生物通过酶促反应降解农药的方式主要有氧化、脱氢、还原和水解等类型[33]。另一类是通过微生物活动改变环境的理化特性,间接作用于农药[34]。大多数微生物降解农药反应属于酶促反应。降解物种类不同,降解酶在微生物细胞中分布位置也不同。已有报道指出,一些降解酶属于胞内酶和胞外酶,还有一些分布在细胞周质中。刘亚光等[35]研究发现降解菌W2 降解异噁草松关键酶是胞内酶;王卓娅等[36]研究发现克雷伯氏菌ZD112 降解氯氰菊酯的关键酶位于细胞内;汤鸣强等[37]发现一株降解三唑磷农药的降解菌,其降解关键酶为胞内酶;任明[38]分离出一株高效降解毒死蜱的不动杆菌(Acinetobacter sp.),通过降解酶定位研究发现其降解关键酶是胞内酶;徐莲等[39]发现降解功夫菊酯的芽孢杆菌GF-3 的降解酶是胞外酶。由此可见,微生物不同位置的降解酶可能与污染物降解过程有关[40]。由于微生物对毒死蜱降解过程的复杂性,且芽孢杆菌属降解毒死蜱的微生物酶定位还不明确。因此,本研究以毒死蜱为研究对象,通过室内实验研究毒死蜱微生物芽孢杆菌降解酶定域,为降解酶的进一步研究提供了理论基础。后续研究中应加强对降解机理的研究,开发出更高效的降解酶资源。同时,毒死蜱降解酶基因工程将是今后研究方向之一,通过基因工程技术将毒死蜱降解酶基因克隆到宿主菌中使其高效表达,构建高效农药降解菌,对于生态农业发展、保护生态环境有着重要的意义。
4 结论
(1)本研究筛选出一株毒死蜱高效降解菌,将其命名为H27。经菌落形态分析和16S rDNA 基因序列鉴定,确定菌株H27 为枯草芽孢杆菌(Bacillus subtilis)。
(2)通过单因素实验确定毒死蜱降解的最适时间为48 h,最适温度为25 ℃,最适pH 为7.0。采用中心组合实验设计,结合Box-Behnken 及响应面分析,优化菌株H27 降解条件为:降解时间54 h、pH 7.2、温度24 ℃,在此条件下该毒死蜱高效降解菌对毒死蜱的降解率可达88.96%。
(3)菌株H27降解毒死蜱的关键酶是胞内酶。
