HPV18阳性和HPV18阴性子宫颈癌组织中miR-24-3p和HOXB8蛋白的表达差异及其机制研究
2020-11-09李会影徐明鑫徐明研李鑫宋超周宇
李会影 徐明鑫 徐明研 李鑫 宋超 周宇


【摘要】 目的:檢测HPV18阳性和HPV18阴性子宫颈癌患者癌组织中miR-24-3p和HOXB8的表达差异并探讨其变化机制。方法:选取2015年1月-2019年1月于本院就诊的HPV18阳性子宫颈癌患者40例(HPV18+组)和HPV18阴性子宫颈癌患者40例(HPV18-组)的手术标本。实时荧光定量PCR(RT-qPCR)检测两组miR-24-3p和HOXB8 mRNA的表达水平;免疫印迹法检测两组HOXB8蛋白的表达水平;巢式降落式甲基化特异性PCR(nMS-PCR)检测两组miR-24-3p启动子区DNA甲基化水平;染色质免疫共沉淀-定量PCR(ChIP-qPCR)检测两组miR-24-3p启动子区H3K27me3水平;培养人子宫颈癌细胞系HeLa细胞,分别转染miR-24-3p模拟物和miR-24-3p抑制物后检测HOXB8的表达水平。结果:HPV18-组miR-24-3p的相对表达水平高于HPV18+组(P<0.01)。HPV18-组HOXB8 mRNA和蛋白表达水平均低于HPV18+组(P<0.01)。miR-24-3p启动子区富含CpG位点和CpG岛,HPV18-组miR-24-3p启动子区DNA甲基化水平低于HPV18+组,(P<0.01)。HPV18-组miR-24-3p启动子区H3K27me3水平低于HPV18+组,(P<0.01)。在Hela细胞过表达miR-24-3p可抑制HOXB8的表达,而敲减miR-24-3p的表达可提高HOXB8的表达,与阴性对照比较,差异均有统计学意义(P<0.05)。结论:HPV18可能通过DNA甲基化和组蛋白甲基化下调miR-24-3p的表达导致HOXB8表达升高,进而促进子宫颈癌的发生发展,为HPV18+子宫颈癌的治疗研究提供了实验基础和干预靶点。
【关键词】 HPV18 子宫颈癌 miR-24-3p HOXB8 DNA甲基化 H3K27me3
Study on the Expression Differences of miR-24-3p and HOXB8 Protein in HPV18 Positive and HPV18 Negative Cervical Cancer Tissues and Its Mechanism/LI Huiying, XU Mingxin, XU Mingyan, LI Xin, SONG Chao, ZHOU Yu. //Medical Innovation of China, 2020, 17(28): 00-006
[Abstract] Objective: To detect the differential expression of miR-24-3p and HOXB8 in cancer tissues of HPV18 positive and HPV18 negative cervical cancer patients and exploring the mechanisms. Method: From January 2015 to January 2019, surgical specimens were selected from 40 patients with HPV18 positive cervical cancer (HPV18+ group) and 40 patients with HPV18 negative cervical cancer (HPV18- group) visited our hospital. miR-24-3p and HOXB8 were detected by real-time quantitative PCR (RT-qPCR). The expression of HOXB8 protein was detected by Western blotting. The DNA methylation level of miR-24-3p promoter was detected by nMS-PCR. The H3K27me3 level in miR-24-3p promoter region was detected by chromatin immunoprecipitation quantitative PCR (ChIP-qPCR). Hela cells were cultured and expression levels of HOXB8 were detected after transfection with miR-24-3p mimics and miR-24-3p inhibitors, respectively. Result: The relative expression level of miR-24-3p in the HPV18- group was higher than that in the HPV18+ group (P<0.01). Both mRNA and protein expression levels of HOXB8 in the HPV18- group were lower than those in the HPV18+ group (P<0.01). The promoter region of miR-24-3p was rich in CpG sites and CpG islands, and the DNA methylation level of the promoter region of miR-24-3p in the HPV18- group was lower than that in the HPV18+ group (P<0.01). The promoter H3K27me3 level of miR-24-3p in the HPV18- group was lower than that in the HPV18+ group (P<0.01). Over expression of miR-24-3p in HeLa cells inhibited the expression of HOXB8, while knockdown of miR-24-3p
increased the expression of HOXB8, with statistically significant differences compared with the negative control group (P<0.05). Conclusion: HPV18 may down-regulate the expression of miR-24-3p through DNA methylation and histone methylation, leading to increased HOXB8 expression, and then promote the occurrence and development of cervical cancer. It provides experimental basis and intervention targets for the treatment of HPV18+ cervical cancer.
[Key words] HPV18 Cervical cancer miR-24-3p HOXB8 DNA methylation H3K27me3
First-authors address: Hongqi Hospital Affiliated of Mudanjiang Medical College, Mudanjiang 157011, China
doi:10.3969/j.issn.1674-4985.2020.28.001
在世界范圍内,子宫颈癌是女性第四大最常见的癌症,2018年约有57万新增病例,占所有女性癌症死亡人数的7.5%。据估计,每年有超过31万人死于子宫颈癌,其中85%以上发生在欠发达地区[1]。高危人乳头瘤状病毒18型(human papillomavirus 18,HPV18)感染是引起子宫颈癌的主要原因之一,但其导致子宫颈癌发生的分子机制仍不清楚[2-3]。MicroRNAs(miRNAs)是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子。文献[4-5]报道miRNAs可通过调控靶基因的表达参与子宫颈癌的发生和发展,如miR-196可调控HOXB8的表达等。既往及现有子宫颈癌相关的miRNAs研究多集中于其对靶基因的调控作用,忽视了miRNAs本身表达变化的机制。因此,本研究以HPV18阳性和HPV18阴性子宫颈癌患者为研究对象,检测两组癌组织中miR-24-3p的表达情况并探讨其变化机制,同时考察miR-24-3p对HOXB8是否具有调控作用,现报道如下。
1 材料与方法
1.1 材料 (1)主要仪器:Microfuge 16台式高速冷冻离心机(BECKMAN COULTER,美国);Mastercycler nexus X2 PCR仪(Eppendorf,德国);ABI QuantStudio 3荧光定量PCR仪(Themo Fisher,美国);蛋白质电泳、印迹及成像系统(Bio-Rad,美国);超净工作台(海尔生物医疗,中国)。(2)主要试剂:TRIzol试剂(Invitrogen,美国);去DNA及逆转录试剂盒PrimeScript? RT reagent Kit with gDNA Eraser (Perfect Real Time)(大连宝生物,中国);荧光定量PCR试剂盒TB Green? Premix Ex Taq? Ⅱ(大连宝生物,中国);DNA甲基化修饰试剂盒(北京天漠科技开发有限公司,中国);miRNA提取试剂盒、miRNA逆转录试剂盒及miRNA荧光定量PCR试剂盒(天根生化科技有限公司,中国);SDS-PAGE凝胶配制试剂盒(南京凯基,中国);HOXB8抗体(4F8):sc-517156(Santa Cruz Biotechnology,美国);GAPDH抗体(中杉金桥,中国);ECL发光液(Thermo Fisher,美国);miR-24-3p mimic和inhibitor(上海吉玛制药技术有限公司,中国);lipo3000(Invitrogen,美国);染色质免疫共沉淀试剂盒(millipore,美国);
miR-24-3p及U6引物(天根生化科技有限公司,中国);HOXB8、GAPDH及甲基化特异性引物(华大基因,中国)。(3)研究对象:选取2015年
1月-2019年1月本院妇产科收治的HPV18阳性子宫颈癌患者40例(HPV18+组)和HPV18阴性子宫颈癌患者40例(HPV18-组)。留取两组手术切除的癌组织标本,冻存于-80 ℃,备用。纳入标准:(1)经组织活检及术后病理证实为子宫颈癌;(2)不合并其他恶性肿瘤及既往无其他恶性肿瘤病史;(3)于本院首次接受治疗的子宫颈癌患者。排除标准:(1)孕妇;(2)合并严重的肝肾功能障碍;(3)年龄≤18岁;(4)合并严重的高血压、糖尿病及心脏疾病等。所有患者及家属均知情同意并签署知情同意书,本研究已经医院伦理委员会批准。
1.2 方法
1.2.1 实时荧光定量PCR(RT-qPCR)检测两组miR-24-3p和HOXB8 mRNA的表达水平 称取50 mg子宫颈癌组织,冰上匀浆,离心去除上清,收集沉淀。采用TRIzol试剂及miRNA提取试剂盒提取子宫颈癌组织中的总RNA和miRNA。按照PrimeScript? RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒说明书对总RNA进行去DNA及逆转录,按照miRNA逆转录试剂盒说明书对miRNA逆转录进行。以逆转录产物为模板,按照TB Green? Premix Ex Taq? Ⅱ和miRNA荧光定量PCR试剂盒说明书分别对miR-24-3p和HOXB8 mRNA进行RT-qPCR检测。以U6为内参,根据目的基因的相对表达量=2-△△Ct计算miR-24-3p的相对表达水平。以GAPDH内参,根据目的基因的相对表达量=2-△△Ct计算HOXB8 mRNA的相对表达水平。HOXB8及GAPDH引物信息见表1。
1.2.2 免疫印迹法检测两组HOXB8蛋白的表达水平 称取100 mg子宫颈癌组织,冰上匀浆,离心去除上清,收集沉淀。按照总蛋白提取试剂盒说明书提取子宫颈癌组织的总蛋白,并采用BCA法进行蛋白定量。加入4×SDS Loading Buffer后煮沸使蛋白变性。取10 μL蛋白样品,进行SDS-PAGE凝胶电泳,80 V电泳浓缩胶,120 V电泳分离胶。冰上恒流0.3 A(或恒压60 V)转膜2 h,PBST洗一次后采用2%BSA室温封闭1 h。分别与HOXB8
抗体和GAPDH抗体于4 ℃孵育过夜。PBST洗
3次,5 min/次,二抗室温孵育1 h。PBST洗3次,5 min/次,ECL发光液孵育1 min后在凝胶成像分析仪上显影成像,以GAPDH蛋白为内参计算HOXB8蛋白的相对表达水平。
1.2.3 巢式降落式甲基化特异性PCR(nMS-PCR)檢测两组miR-24-3p启动子区DNA甲基化水平 称
取50 mg子宫颈癌组织,冰上匀浆,离心去除上清,收集沉淀。分别按照DNA提取试剂盒说明书和DNA甲基化修饰试剂盒说明提取基因组DNA并进行甲基化修饰。在线查找miR-24-3p启动子序列并设计1对外引物(OutPrimer)和2对内引物,即甲基化引物(MethPrimer)和非甲基化引物(UnmethPrimer),引物信息见表2。外引物扩增的反应条件为:95 ℃ 5 min;95 ℃ 30 s,61 ℃ 30 s,72 ℃ 30 s,20个循环,每个循环退火温度降0.5 ℃直至退火温度降低到52 ℃,72 ℃ 7 min。以外引物扩增所得PCR产物为模板,继续进行内外引物扩增,反应条件同外引物。取5 μL内引物扩增所得PCR产物于2%的琼脂糖凝胶上进行电泳,凝胶成像分析系统成像,按公式计算miR-24-3p启动子区DNA甲基化水平:甲基化%=甲基化OD值/(甲基化OD值+非甲基化OD值)。
1.2.4 染色质免疫共沉淀-定量PCR(CHIP-qPCR)检测两组miR-24-3p启动子区组蛋白甲基化水平 称取100 mg子宫颈癌组织,冰上匀浆,离心去除上清,收集沉淀。以1%甲醛重悬室温固定
10 min;加入0.125 mol/L甘氨酸混匀作用5 min终止交联;离心弃上清,用预冷的PBS洗2遍;离心后弃上清,加入适量SDS裂解液重悬沉淀,冰上超声,将基因组DNA打成100~1 000 bp大小的片段;12 000 r/min离心15 min,取上清100 μL,加入适量H3K27me3抗体,4 ℃孵育过夜以形成anti-H3K27me3-H3K27me3复合物;加入适量A/G琼脂糖结合抗体的Fc段,形成protein G Agarose-anti-H3K27me3-H3K27me3复合物;65 ℃水浴解交联并纯化DNA,以纯化的DNA为模板,对miR-24-3p启动子区进行RT-qPCR,miR-24-3p启动子区组蛋白相对甲基化水平计算方法同RT-qPCR。
1.2.5 细胞培养及转染 HeLa细胞用含10% FBS及100 U/mL青-链霉素的DMEM培养液,于37℃、含5%CO2的培养箱中静置培养。按每孔0.4×106个细胞/孔铺板:(1)取125 μL opti-MEM与适量lipo3000混匀;(2)另取125 μL opti-MEM与适量miR-24-3p模拟物(miR-24-3p mimic)或miR-24-3p抑制物(miR-24-3p inhibitor)或阴性对照(negative control)混匀;(3)将(1)加入(2)中并吹打混匀,室温静置10 min;逐滴滴入细胞培养液中并轻轻摇匀,6 h后换新鲜培养液1 mL,48 h后收集细胞。
1.3 统计学处理 采用SPSS 19.0和GraphPad Prism 8.0统计学软件进行统计分析。计量资料用(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK检验。以P<0.05为差异有统计学意义。
2 结果
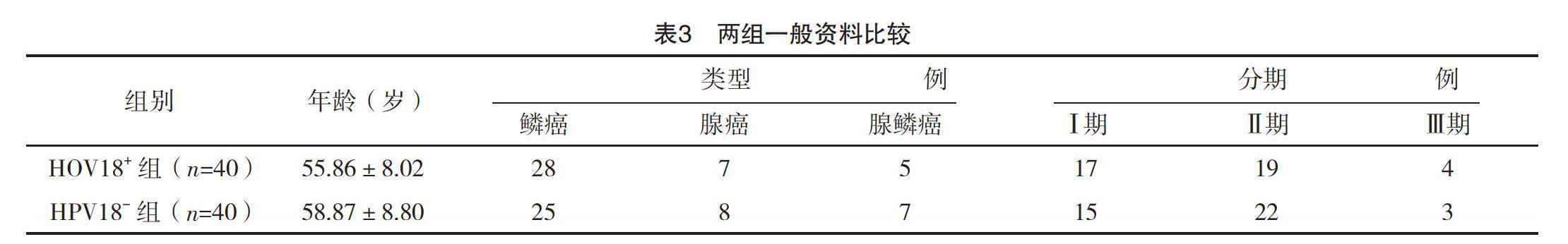
2.1 两组一般资料比较 两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表3。
2.2 两组miR-24-3p mRNA表达水平比较 相对于HPB18+组miR-24-3p的相对表达量标准化为1.00,HPV18-组miR-24-3p mRNA表达水平为(5.28±2.27),HPV18-组miR-24-3p mRNA表达水平高于HPB18+组,差异有统计学意义(t=11.95,P<0.01),见图1。
2.3 两组HOXB8 mRNA和蛋白表达水平比较 相对于HPV18+组HOXB8 mRNA相对表达量标准化为1.00,HPV18-组为(0.32±0.10),HPV18-组HOXB8 mRNA相对表达量低于HPV18+组,差异有统计学意义(t=41.68,P<0.01),见图1A。相对于HPV18+组HOXB蛋白的相对表达量标准化为1.00,HPV18-组为(0.45±0.17),HPV18-组HOXB蛋白的相对表达量低于HPV18+组,差异有统计学意义(t=20.19,P<0.01),见图1B。
2.4 两组miR-24-3p启动子区DNA水平比较 通过生物信息学网站查询miR-24-3p启动子区是否含有CpG位点和CpG岛及其分布情况,结果显示miR-24-3p启动子区富含CpG位点和CpG岛,分布情况见图3A。相对于HPV18+组miR-24-3p启动子区DNA甲基化水平标准化为1.00,HPV18-组为(0.20±0.10),HPV18-组miR-24-3p启动子区DNA甲基化水平低于HPV18+组,差异有统计学意义(t=50.10,P<0.01),见图3B。
2.5 两组miR-24-3p启动子区H3K27me3水平比较 相对于HPV18+组miR-24-3p启动子区H3K27me3水平标准化为1.00,HPV18-组为(0.49±0.30),HPV18-组miR-24-3p启动子区H3K27me3水平低于HPV18+组,差异有统计学意义(t=10.98,P<0.01),见图4。
2.6 miR-24-3p参与调控HOXB8表达 在HeLa细胞转染miR-24-3p 模拟物和抑制物后,检测HOXB8表达变化,结果显示过表达miR-24-3p可抑制HOXB8的表达,而敲减miR-24-3p的表达可提高HOXB8的表达,与阴性对照比较,差异有统计学意义(t=14.90,P<0.01;t=4.16,P<0.05),
见图5。
3 讨论
子宫颈癌是女性生殖系统恶性肿瘤之一,在世界范围内普遍存在。虽然子宫颈癌的发生发展是一个多因素和多阶段调控异常的过程,但高危型HPV感染是子宫颈癌发病的主要诱因之一。文献[6-7]报道感染HPV的子宫颈癌组织与未感染HPV的正常宫颈上皮组织相比,存在miRNAs的异常表达和调控。前期的miRNAs芯片结果显示,在HPV18+的子宫颈癌组织中miR-24-3p表达异常减低[8-9]。本研究所用病例采用RT-qPCR对芯片结果进行验证,结果显示HPV18+组的子宫颈癌组织中
miR-24-3p的表达水平明显低于HPV18-组(P<0.05),与前期miRNAs芯片研究结果一致,可基本排除由于样本量小或样本偏倚导致的误差。Targetscan网站预测HOXB8可能是miR-24-3p的靶基因,因此本研究也对该预测进行验证,结果显示过表达miR-24-3p可抑制HOXB8的表达,而敲减miR-24-3p的表达可提高HOXB8的表达,提示miR-24-3p可调控HOXB8的表达。
目前及既往的研究大多集中于miRNAs的表达变化及其对下游基因的调控作用对子宫颈癌发生发展的影响,并以miRNAs-靶基因信号通路研究干预靶点,而忽略了miRNAs本身变化的机制[10-11]。若找到miRNAs的变化机制,则可实现在更高级的调控层面研究干预靶点。表观遗传学调控是基因表达调控的重要方式,是指在基因核苷酸序列不发生改变的情况下,基因表达的可遗传的变化。表观遗传调控的现象有很多,已知的有DNA甲基化(DNA methylation),组蛋白甲基化(Histone methylation)、基因组印记(genomic imprinting),母体效应(maternal effects),基因沉默(gene silencing),核仁显性,休眠转座子激活和RNA编辑(RNA editing)等[12-13]。研究发现,表观遗传学改变的累加效应体现在宫颈由正常组织—癌前病变—子宫颈癌的发展过程[14]。DNA甲基化和组蛋白甲基化是表观遗传学调控的重要方式,研究发现,DNA甲基化和组蛋白修饰在发育过程中相互影响,组蛋白甲基化可以帮助指导DNA甲基化模式,而DNA甲基化可以作为DNA复制后重建组蛋白修饰模式的模板,因此两者存在互相調控作用[15-16]。DNA甲基化和组蛋白甲基化是否参与HPV18+和HPV18-患者子宫颈癌组织中miR-24-3p的表达调控仍不清楚影响。本研究结果显示,HPV18+组miR-24-3p启动子区DNA甲基化和组蛋白甲基化水平均高于HPV18-组(P<0.05),提示DNA甲基化和组蛋白甲基化参与了HPV18+子宫颈癌中miR-24-3p的表达调控,针对DNA甲基化和组蛋白甲基化设计干预靶点可能比针对miRNAs-靶基因信号通路设计干预靶点取得更好的临床效果。
综上所述,HPV18可能通过DNA甲基化和组蛋白甲基化下调miR-24-3p的表达导致HOXB8表达升高,进而促进子宫颈癌的发生发展,为HPV18+子宫颈癌的治疗研究提供了实验基础和干预靶点。
参考文献
[1] Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2018,68(6):394-424.
[2] Farooqui A,Khan F,Khan I,et al.Glycyrrhizin induces reactive oxygen species-dependent apoptosis and cell cycle arrest at G0/G1 in HPV18+ human cervical cancer HeLa cell line[J].Biomed Pharmacother,2018,97:752-764.
[3]王国荣,韩延霞.高危型人乳头瘤病毒16、18型感染与宫颈癌及癌前病变的相关性分析[J].中国妇幼保健,2018,33(1):67-69.
[4] Chen Z,Han Y,Song C,et al.Systematic review and meta-analysis of the prognostic significance of microRNAs in cervical cancer[J].Oncotarget,2017,9(24):17141-17148.
[5]周雪,夏丽梅.微小RNA在宫颈癌中作用的研究进展[J].现代肿瘤医学,2019,27(17):3164-3166.
[6] Virtanen E,Pietil? T,Nieminen P,et al.Low expression levels of putative HPV encoded microRNAs in cervical samples[J].Springerplus,2016,5(1):1856.
[7] Xia Y F,Pei G H,Wang N,et al.miR-3156-3p is downregulated in HPV-positive cervical cancer and performs as a tumor-suppressive miRNA[J].Virol J,2017,14(1):20.
[8] Shukla V,Varghese V K,Kabekkodu S P,et al.Enumeration of deregulated miRNAs in liquid and tissue biopsies of cervical cancer[J].Gynecol Oncol,2019,155(1):135-143.
[9]蒋莉莎,陆义红,傅柳陶,等.宫颈癌组织中微小RNA-29c的水平及临床意义[J].临床肿瘤学杂志,2019,24(4):344-348.
[10] Li J,Liu Q,Clark L H,et al.Deregulated miRNAs in human cervical cancer:functional importance and potential clinical use[J].Future Oncol,2017,13(8):743-753.
[11] Shukla V,Varghese V K,Kabekkodu S P,et al.Enumeration of deregulated miRNAs in liquid and tissue biopsies of cervical cancer[J].Gynecol Oncol,2019,155(1):135-143.
[12] Botchkarev V A.Second International Symposium-Epigenetic Regulation of Skin Regeneration and Aging:From Chromatin Biology towards the Understanding of Epigenetic Basis of Skin Diseases[J].J Invest Dermatol,2017,137(8):1604-1608.
[13] Zhang L,Tian S,Pei M,et al.Crosstalk between histone modification and DNA methylation orchestrates the epigenetic regulation of the costimulatory factors,Tim?3 and galectin?9,in cervical cancer[J].Oncol Rep,2019,42(6):2655-2669.
[14] Feng C,Dong J,Chang W,et al.The Progress of Methylation Regulation in Gene Expression of Cervical Cancer[J].Int J Genomics,2018,2018:8260652.
[15] Alhaji S Y,Ngai S C,Abdullah S.Silencing of transgene expression in mammalian cells by DNA methylation and histone modifications in gene therapy perspective[J].Biotechnol Genet Eng Rev,2019,35(1):1-25.
[16] Nowacka-Zawisza M,Wi?nik E.DNA methylation and histone modifications as epigenetic regulation in prostate cancer(Review)[J].Oncol Rep,2017,38(5):2587-2596.
(收稿日期:2020-03-19) (本文编辑:田婧)
