激光解吸后电离质谱成像技术在生物医学分析中的应用
2020-11-09聂武艺胡勇军
陆 桥 聂武艺 胡勇军
( 华南师范大学生物光子学研究院激光生命科学教育部重点实验室暨广州市光谱分析与功能探针重点实验室, 广州 510631)
1 引言
激光自发明以来已被应用于多种领域,尤其是与生命科学的结合更是研究的热点和前沿[1],它被誉为“一把锋利的刀”。激光技术与质谱技术的结合始于1963年,由美国科学家Honig提出,最初应用于分子反应动力学和光电离光谱等基础科学的研究[2]。随后,研究人员又将这一技术应用到分析化学领域,用于对无机材料、芳香族化合物、生物材料、氨基酸、药物、有机酸代谢产物等分析中。最开始比较成功的应用是激光解吸电离质谱技术(LDI-MS),它很好地解决了质谱对小分子分析的困扰且实现了对样品的原位分析[7]。然而这种方法的检测灵敏度相对较低,易产生碎片离子峰,且只适合于分析分子量低于500的小分子化合物,而大部分生物组织内源物如磷脂,其分子量都在600以上,因而LDI-MS技术没能在生物医学领域得到广泛应用。
在LDI-MS的基础上,上世纪80年代,分析化学家们又提出了将一束激光解吸电离改成用两束激光分别完成对样品的解吸和离子化任务,然后用质量分析器对样品进行检测,这一方法被称为激光解吸后电离质谱法(LDPI-MS)[8, 9]。两束激光的时空可调性以及第二束电离激光的引入也大大提高了对样品的离子化效率,使得其可以检测到只用第一束激光无法探测到的样品信号。当前质谱成像(MSI)技术日趋成熟,已被广泛应用于诸多领域,而与LDPI结合的MSI技术,即LDPI-MSI,兼具两种技术的优势,也开始得到分析学家和仪器学家的关注。生物技术的快速发展以及亟待解决的生命科学问题也促进了LDPI-MSI技术在生物医学领域的广泛应用,同时也对其提出了一些挑战。本文将深入阐述LDPI-MSI的基本原理和影响LDPI过程中离子化效率的重要参数,同时介绍LDPI-MSI技术在生物医学分析研究中的应用。
2 激光解吸后电离质谱成像技术原理
2.1 基本原理介绍
LDPI-MS与LDI-MS及基质辅助激光解吸/电离(MALDI)质谱法不同,其基本原理如图1所示。在该系统中,两束激光的灯泵和Q开关触发信号线被同时连接在一个延时触发器上,可以分别优化两束激光的能量和延时间隔。同时,可以通过光学元件来调整两束激光的空间位置,从而实现了在时间和空间上对改离子源的同时优化。第一束激光为解吸激光,其作用是使样品在很短的时间内得以解吸/气化,一般使用纳秒级或更短脉冲的激光,这对于热不稳定且难以挥发的物质极为关键。这束激光一般采用低功率密度的可见波段的激光,但有时为了特殊需要也使用红外激光、紫外激光,甚至是真空紫外或极紫外激光。当解吸激光照射到样品上时,待测样品就会吸收光子并迅速将其大部转换成热能,使样品在瞬间被气化而从样品解吸出来,这可以避免样品分子因长时间受热而发生裂解。经过解吸激光的照射后,在离样品表面垂直距离约2 mm内将会形成一个微小的样品分子组成的气团,该气团中的大部分粒子是电中性的,只有少部分是带电粒子,其中性粒子数目是带电粒子的1000倍以上。当经过一定时间的延迟后(时间一般在微秒级,根据气团离样品的距离而不同),触发第二束激光(电离激光),该激光被聚焦到该气团上并将气态的样品分子电离,离子随后被引入质量分析器而被检测到。
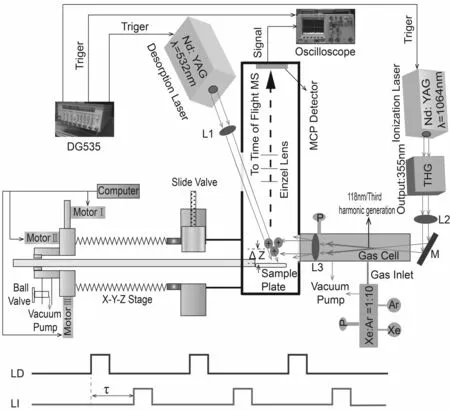
图1 激光解吸后电离质谱成像装置原理图和两束激光触发时序图
在获得单点样品的质谱信号后,研究人员又设想对样品进行逐点探测以获取整个样品表面的质谱信息。他们通过在激光解吸样品的时候有规律地移动样品,同时记录样品的位置信息和质谱峰信息。然后将每一个点的质谱信息与位置逐一对应,获得整个样品每个点的质谱信号强度“热图”,即为质谱成像图。MSI是一种结合质谱分析和影像可视化的分子成像技术,作为分子成像及质谱领域研究的前沿和热点,近年来受到研究人员高度的关注并得到迅速发展[11]。它可对生物组织样品进行多组分检测、多维数据获取,从而实现对多种分子进行高灵敏度地同时检测,与此同时,它还能够直接提供目标化合物在生物组织中的空间分布信息。与其他成像技术相比,MSI技术无需利用放射性同位素或荧光进行标记,样品前处理简单。因此本文所介绍的LDPI-MSI的基本原理就是在LDPI-MS基础上引入MSI技术,实现获取样品的成分信息和分子分布信息。
2.2 解吸激光的选择及对成像分辨率的影响
解吸激光的波长、脉宽、能量、光斑大小等因素对样品的解吸效率具有决定性作用[12]。陆桥等人在LDPI-MS装置上使用光学参量震荡/放大器(OPO/OPA)输出的1.5~5.0 μm波长的红外激光作为解吸光源,并与传统解吸激光波段532 nm和1064 nm作对比,发现生物组织样品更易吸收红外激光,在其它条件相同的情况下表现出更强的质谱信号。崔扬等人利用脉宽为75 fs、波长为800 nm的近红外飞秒激光对样品进行剥蚀,同时利用光阑对激光光斑进行压缩,实现了2.0 μm的横向成像分辨率[14]。在解吸激光波长的选择上也应考虑样品分子的吸收波长,应使用最靠近分子最大吸收峰的激光波长。此外,相同能量下的激光,脉宽越短,其功率密度越高,因此选择短脉冲的激光,可以降低激光的能量,在对样品解吸过程中可降低对样品的破坏程度[15]。基于激光的传统MSI技术,由于受光的衍射极限限制(≈λ/2N.A.,其中N.A.为数值孔径),激光的聚焦光斑直径最小不低于光的半波长。除此之外,聚焦透镜存在球差和相差,使得激光远场聚焦光斑大小会远大于理论值。近些年近场技术的发展很好地解决了光的衍射极限问题,使得激光的聚焦光斑大小突破到亚微米级。Zenobi等人在近场扫描显微镜的基础上构建近场激光解吸系统,可以将解吸激光聚焦到直径为200 nm以下,实现了对样品的高分辨成像[16]。
2.3 电离激光的选择
紫外光或者真空紫外光作为第二束激光已经广泛应用于LDPI-MSI技术中,真空紫外激光(光子的能量为7~11 eV)可以通过单光子吸收对绝大多数的分子进行“软”电离,这样可避免分子裂解而产生大量的碎片离子峰[17]。准分子激光器产生的157 nm波长的激光由于其相对较高的光子密度及成熟的商业化机型,许多实验室将其作为后电离激光的优选[18,19]。但是,对于电离能高于157 nm单光子能量的样品分子,不能对该分子实现单光子电离,因而会产生碎片。其它诸如产生248 nm波长的KrF准分子激光器以及产生160 nm波长的H2准分子激光器也存在同样的问题[20]。刘平等人比较了118 nm波长的真空紫外激光与355 nm和266 nm波长的紫外激光作为后电离源后,发现118 nm激光作为后电离激光时分子碎片率较低,母体离子峰相对更强[5]。使用同步辐射光源作为后电离光时,由于其可调谐性,可针对不同分子有不同的垂直电离能而选择不同波长的光,实现对分子的单光子电离[17,21,22]。此外,共振增强了多光子电离(REMPI)配合超声分子束冷却技术也可以实现对样品分子的“软”电离[23,24]。
2.4 影响离子产率的参数
除了两束激光的自身性质会对样品的离子化效率产生影响外,两束光之间的延迟时间及第二束光与样品台的垂直距离均会对电离效率产生重大影响。通过优化两束光之间的延迟时间及第二束光与样品台的垂直距离, 可以极大地提高电离的效率,有助于质谱信号强度和质谱分辨率的提高。如图2所示,陆桥等人通过实验发现质谱信号强度会随延时的增加先增加然后降低,也会随电离光与样品台的垂直距离的增加先增加然后降低[25]。只有在恰当的时间节点和位置才能获得最佳的质谱信号。对于利用具有大气压接口的四极杆/飞行时间质谱仪的LDPI实验,由于离子传输的问题,离子源所处环境的气压大小也会对质谱信号有极大的影响[26]。
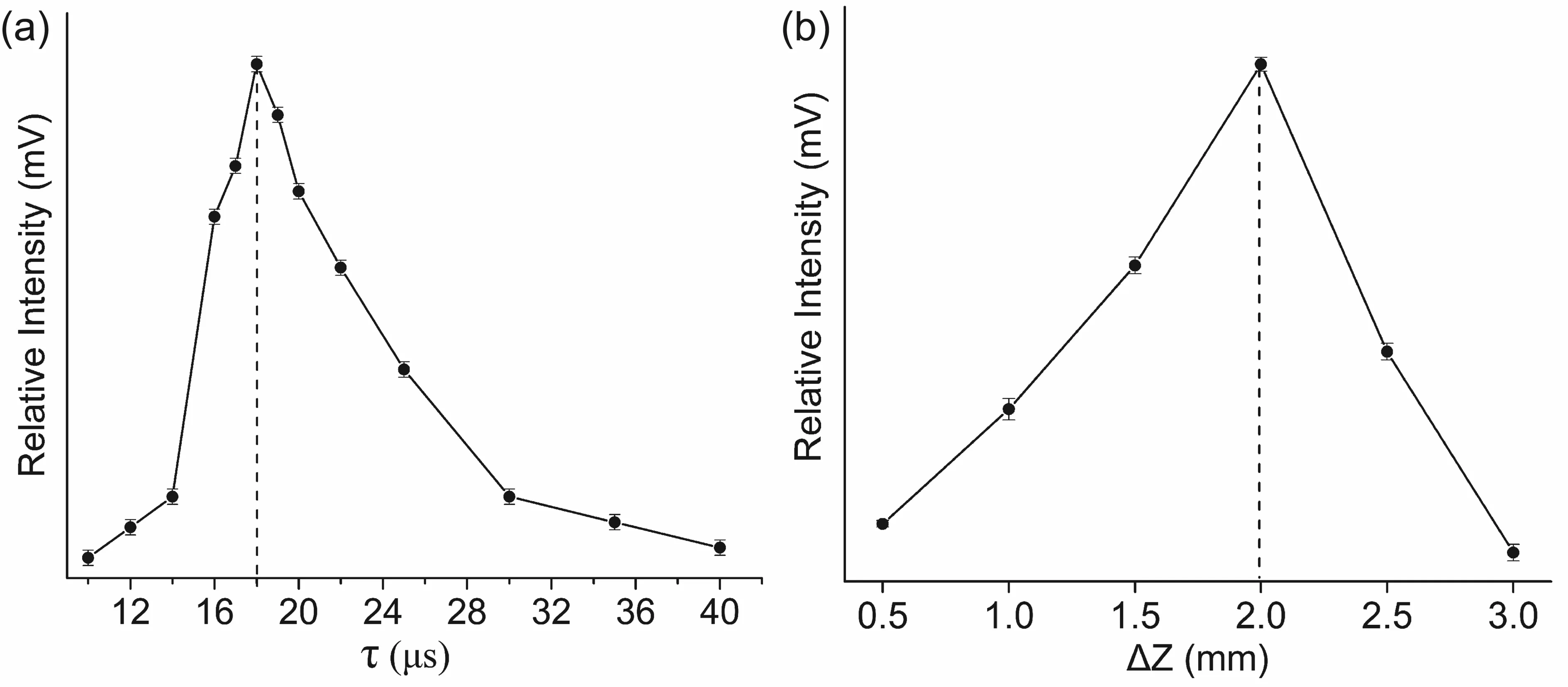
图2 影响激光解吸后电离离子产率的两个因素(a).两束激光的延时时间;(b).电离激光与样品靶的距离
3 在生物医学分析中的应用
3.1 对药物在生物体内作用机理的研究
对药物在生命体内的作用机理研究一直是药学家、生命科学家等的研究热点。通过质谱成像技术我们可以清晰且直观地观察到药物的作用部位以及药物代谢情况[27]。Heeren等人利用LDPI-MSI技术阐述了阿霉素、紫杉醇、曲安奈德等药物在病人组织区域内的分布,揭示了药物在人体内的作用部位和机理。Akhmetov等人对表皮葡萄球菌生物膜上的利福平药物进行成像,模拟研究了该药物的扩散机制[28]。近些年质谱成像技术的快速发展也促进了激光解吸后电离质谱成像(LDPI-MSI)技术在生物医学领域的应用,尤其是对生物样品进行质谱成像。在生物组织层面,杨晴等人以及刘平等人利用LDPI-MS实现了对小鼠肾脏组织中抗癌药物分子的探测[29,30]。陈家新等人在此基础上配合质谱成像技术,揭示了药物分子在组织中的分布,为药物开发及药代动力学研究提供了理论支撑,他们以实验小鼠为模型,通过研究药物在给药小鼠肾脏组织中的分布来探讨药物代谢机理[31,32]。陆桥等人在此基础上创造性地提出在生物组织样品上添加生物相容性较好的纳米材料,提高了解吸激光对样品的解吸效率,以此检测到传统技术难以探测到的低浓度药物分子。崔扬等人将飞秒激光作为第一束解吸激光对培养的生物膜的内源物进行了“低损”质谱成像分析[33]。
3.2 在疾病诊断中的应用
LDPI-MSI技术在医学疾病诊断中也占据越来越重要的地位。陆桥等人通过构建对实验小鼠接种肿瘤,利用LDPI-MSI技术探测肿瘤及癌旁组织中叶酸分子的分布情况,间接鉴别出肿瘤与非肿瘤组织区域[25]。相比于其他的传统方法,该方法操作简便,无复杂的样品前处理及标记过程。这一方法对肿瘤的组织病理学检测具有极大的应用潜力,对肿瘤的外科手术治疗具有潜在的指导价值。Niehaus等人利用LDPI-MSI技术对生物组织中内源性物质的分布进行分析,可以通过检测内源物分布及含量变化推测出致病机理。这一方法对组织病理学检测是一种极大的补充,它可以让我们看到组织病理学不能给出的分子信息[34]。
3.3 对单细胞的分析
细胞是生命体的基本单元,对细胞的研究是揭露生命的起源以及对生命科学研究的重要途经。包括LDPI-MSI在内的质谱技术在单细胞分析领域起到越来越重要的作用。目前基于激光的质谱技术对单细胞分析的最大难点是解吸激光难以聚焦到亚微米级,因而无法对亚细胞结构进行成像分析。当第一束激光聚焦光斑足够小,达到亚微米级别时,可以利用LDPI-MSI技术实现对单细胞进行分析。殷志斌等人将第一束激光引入出口直径为200 nm左右的光纤中,并配合使用原子力显微镜,构建了近场激光解吸系统,加上用157 nm激光后电离,实现了对单个癌细胞内抗癌药物的质谱成像,成像分辨率高达300 nm[35]。Zavalin等人利用一个N.A.值接近1的聚焦透镜,将解吸激光聚焦到1 μm左右[36]。Niehaus等人将样品贴附在玻璃片的另一面,激光透过玻璃片照射在样品的背面,高能激光就可以穿透样品,从而完成对样品的解吸,实现了对细胞内的磷脂类物质进行了质谱成像分析,分辨率达到亚微米级[34]。值得一提的是,他们的解吸激光波长为355 nm,同时在样品上喷涂MALDI技术用的基质,实现了对细胞的内源物质的高分辨质谱成像。
4 结论与展望
质谱技术以其高灵敏度和高分辨率在生物医学检测领域得到了广泛的应用,例如药物分子代谢产物的动态分析、肿瘤标志物的鉴定、蛋白组学分析等。在最近20年间发展起来的质谱成像技术,尤其是生物组织分子质谱成像已经逐步进入生物医学分析领域。本论文详细介绍了LDPI-MSI的基本原理、构建LDPI的两束激光源的选择、影响LDPI-MS参数优化以及其在生物医学分析研究中的应用。可以预见,高空间分辨率质谱分子成像及高灵敏度、高通量质谱检测技术将在生物医学、药学等各个领域得到广泛应用,同时这对仪器的灵敏性、便携化、稳定性提出了更高的要求。国内质谱技术的迅猛发展及国产质谱仪的产业化也将助推LDPI-MSI技术与生物医学分析的融合,助力生物医学分析的发展。
