β-拉帕醌抑制下咽癌Fadu细胞增殖和迁移机制的研究
2020-11-06张双双崔忆旋刘学宝许彬彬蔡常琦朱慧慧韩亚娟丁晓娇韩跃峰
张双双,崔忆旋,刘学宝,许彬彬,蔡常琦,朱慧慧,韩亚娟,丁晓娇,韩跃峰*,赵 报#
(1蚌埠医学院第一附属医院耳鼻咽喉头颈外科,蚌埠 233000;2蚌埠医学院第一附属医院肿瘤内科;*通讯作者,E-mail:hanyf1015@126.com;#共同通讯作者,E-mail:zhaobao86@126.com)
下咽癌是一种少见的头颈部恶性肿瘤,约占头颈部恶性肿瘤的3%-5%,其病理类型以鳞状细胞癌为主[1,2]。下咽癌往往发现比较晚,70%-85%的病例诊断时已经属于Ⅲ期或Ⅳ期。下咽癌生物学特性恶劣,发生部位隐蔽难察觉,且极易发生颈部淋巴结转移,预后差,生存率低[3,4]。尽管对下咽癌的手术治疗、放疗、化疗及靶向药物治疗取得了重要进展,但下咽癌患者的预后尚无明显改善。因此,有必要寻找与下咽癌治疗进展相关的新策略。
上皮-间充质转化(epithelial-mesenchymal transition,EMT)是细胞重塑的一个重要过程,其特征是上皮表型的逐渐丧失和间充质表型的逐步增加,EMT不是一个全有或全无的过程,而是上皮细胞向中间细胞状态的间充质细胞的转变[5]。肿瘤转移是延长癌症患者寿命的主要障碍,上皮-间质转化(EMT)在肿瘤侵袭、浸润和转移形成等致癌过程中起着重要作用,对肿瘤的侵袭和转移尤为重要[6]。上皮标志物如E-cadherin和间充质标志物包括N-cadherin和vimentin的表达水平被用来定义上皮-间充质状态[7]。EMT转录因子snail是一种EMT的调控因子,其抑制上皮基因的表达[8]。实验证明,处于EMT中间状态的癌细胞在转移过程中表现出更强的侵袭性,从而形成集体癌簇以克服压力环境[9]。因此,确定更多的EMT药物靶点作为癌症治疗手段将是发展抗癌治疗的必要条件。
NAD(P)H ∶醌氧化还原酶1(NQO1)蛋白又称醌氧化还原酶,既是一种保护细胞免受氧化损伤的黄素酶,也是人体内一种非常重要的化学致癌物代谢酶[10]。β-拉帕醌(β-lapachone),分子量242.273 8 g/mol,是NQO1蛋白的一种有效抑制剂,从中南美洲天然产物紫檀树的树皮中分离获得[11]。β-拉帕醌的生物学作用广泛,包括抗细菌、抗真菌、杀锥虫、抗银屑病、消炎和抗肿瘤等作用[12]。并且对多种癌细胞具有良好的抗肿瘤作用,包括肝癌、乳腺癌、胰腺癌等[13]。然而其在下咽癌中的作用及机制尚不清楚。因此,本文以下咽癌Fadu细胞株为实验对象,体外分析β-拉帕醌对下咽癌细胞增殖、迁移的抑制作用,并初步探讨其分子作用机制。
1 材料与方法
1.1 材料
人下咽癌Fadu细胞株购自武汉普诺塞生命科技有限公司,培养于蚌埠医学院药学院生化实验室。DMEM培养基、胰蛋白酶(含EDTA)及双抗(青霉素/链霉素)均购自美国Hyclone公司,胎牛血清(FBS)购自浙江天杭生物科技股份有限公司,MTT试剂、双染细胞凋亡检测试剂盒(Annexin Ⅴ-FITC/PI)、SDS-PAGE凝胶配制试剂盒、BCA蛋白定量试剂盒、Transwell小室均购自上海碧云天生物技术有限公司,一抗(Bcl-2、Bax、E-cadherin、vimentin、Snail)、β-actin及辣根过氧化物酶标记的羊抗兔/鼠二抗均购自于美国CST公司等。
1.2 方法
1.2.1 细胞培养 人下咽癌细胞Fadu培养于含10%胎牛血清、1%青霉素/链霉素的DMEM完全培养基中,在37 ℃、5% CO2的恒温培养箱中培养,待细胞长至70%-80%时消化传代。
1.2.2 MTT实验检测细胞存活率 取对数期生长状态良好的Fadu细胞消化,离心,弃上清,制成细胞悬液计数后接种于96孔板,调整培养液为100 μl/孔,细胞数约为1×104个/孔,于培养箱(37 ℃、5%CO2)内培养过夜。待细胞长至密度达80%左右,向96孔板内分别加入浓度为0,1,2,3,4,5,6 μmo1/L的β-拉帕醌溶液,每组设5个复孔,继续培养48 h后,每孔加入配制好的MTT溶液15 μl,MTT浓度为5 g/L,继续培养4 h后,小心吸去培养液,每孔加入150 μl DMSO,继续于培养箱(37 ℃、5%CO2)中培养30 min后,在490 nm波长处用酶联免疫检测仪测吸光度值(OD490 nm)。计算细胞存活率:细胞存活率(%)=实验组OD490 nm/对照组OD490 nm×100%。取平均值绘制药物剂量效应曲线,并计算药物的半数抑制浓度(IC50),实验重复3次取平均值,筛选适宜的药物作用浓度。
1.2.3 平板克隆实验检测细胞增殖 取对数期生长状况良好的Fadu细胞消化,离心,弃上清,制成细胞悬液计数后接种于6孔板,调整培养液为2 ml/孔,细胞数约为5 000个/孔,于培养箱(37 ℃、5%CO2)内培养24 h后,向6孔板内分别加入浓度为0,2,4,6 μmo1/L的β-拉帕醌溶液,再放入培养箱(37 ℃、5% CO2)中培养2周;待细胞生长至出现肉眼可见的细胞集落时,终止细胞培养;弃去培养基,用预先冷却的PBS溶液清洗2遍后,每孔滴加1 ml 4%多聚甲醛溶液固定15-20 min;弃去固定液,然后向每孔中滴加1 ml 结晶紫染色15-20 min;回收保留结晶紫,用自来水洗涤6孔板3次,自然风干并拍照。使用软件Image J计算细胞克隆数。
1.2.4 Transwell实验检测细胞迁移 取对数期生长状态良好的Fadu细胞消化,离心,弃上清,用无血清的DMEM培养液制成细胞悬液计数后,将约含2×105个细胞/ml的无血清细胞悬液加入100 μl至上层小室,并在上层小室中分别加入浓度为0,2,4,6 μmol/L的β-拉帕醌溶液,在下层小室内加入600 μl的DMEM完全培养液,于培养箱(37 ℃、5%CO2)内培养48 h后,丢弃上室液体,将小室放入双蒸水中轻轻洗涤1遍后,再将小室放入含600 μl 4%多聚甲醛溶液的24孔板中固定15-20 min,丢弃固定液,将小室放入双蒸水中洗涤1遍后,再将小室放入含600 μl结晶紫的24孔板中染色15-20 min,回收保留结晶紫,再将小室放入双蒸水中洗涤1遍,用棉签擦拭小室内。最后,用光学显微镜200倍放大观察并拍照。使用软件Image J计算细胞迁移数。
1.2.5 流式细胞术(Annexin Ⅴ-FITC/PI双染法)检测细胞凋亡 取对数期生长状态良好的Fadu细胞消化,离心,弃上清,制成细胞悬液计数后接种于6孔板,调整培养液为2 ml/孔,细胞数约为5×105个/孔,于培养箱(37 ℃、5%CO2)内培养24 h后,向6孔板内分别加入浓度为0,2,4,6 μmo1/L的β-拉帕醌溶液,于培养箱(37 ℃、5%CO2)中继续培养24 h后,用不含EDTA的胰酶消化细胞并收集细胞,其中空白孔(0 μmo1/L组)分为4份,分别为空白对照组、PI组、Annexin Ⅴ-FITC组以及对照组。500g离心5 min,弃上清,用预冷的PBS清洗2遍,每组加入200 μl Annexin Ⅴ-FITC结合液混匀,再加入1.5 μl Annexin Ⅴ-FITC染色液轻轻混匀,在4 ℃冰箱中避光孵育15 min;之后再加入1.5 μl PI染色液,在4 ℃冰箱中避光孵育5 min,1 h内,用流式细胞仪分析检测细胞凋亡率,激发波长488 nm;发射波长530 nm。此实验重复3次。
1.2.6 Western blot法检测Bcl-2、Bax、E-cadherin、vimentin、Snai1蛋白表达水平 将对数期生长状态良好的Fadu细胞用不同浓度的β-拉帕醌溶液处理,浓度分别为0,2,4,6 μmol/L,于培养箱(37 ℃、5%CO2)中继续培养,48 h后将细胞消化收集至离心管,PBS洗涤2遍后,加入含有PMSF的裂解液冰上裂解30 min,放入-20 ℃冰箱过夜,次日离心30 min(12 000 r/min,30 min),弃去沉淀,取上清液。用BCA法测出蛋白浓度,然后加入上样缓冲液,并计算出每组样本所需上样量。将蛋白总量相同的样本加入到蛋白凝胶(SDS-PAGE)内进行蛋白分离,待溴酚蓝到达凝胶的底部后终止,将凝胶上的蛋白转移至PVDF膜。用5%脱脂奶粉封闭PVDF膜2 h于室温摇床上摇晃,用TPBS洗涤5 min,重复3次。用一抗稀释液分别稀释Bcl-2(1 ∶1 000)、Bax(1 ∶1 000)、E-cadherin(1 ∶1 000)、vimentin(1 ∶1 000)、Snail(1 ∶1 000)、β-actin(1 ∶2 000)一抗,将PVDF膜放于不同的一抗中4 ℃孵育过夜,次日室温下在摇床上摇晃30 min后,用TPBS洗膜,洗涤5 min,重复3次,再将PVDF膜放入二抗中室温孵育2 h于摇床上摇晃,之后用TPBS洗膜5 min,重复3次。最后ECL发光试剂盒显色、成像。β-actin蛋白作为内参。使用软件Image J分析各组条带灰度值,计算目标蛋白条带灰度值/内参条带灰度值的比值。
1.3 统计学分析
采用GraphPad Prism 8软件对实验结果进行分析,实验数据均以均数±标准差表示,各组间差异采用单因素方差分析和LSD-t检验比较各组间差异,P<0.05表示差异具有统计学意义。
2 结果
2.1 β-拉帕醌对Fadu细胞存活率的影响
MTT实验结果显示,当浓度为0,1,2,3,4,5,6 μmol/L的β-拉帕醌作用于Fadu细胞48 h,随着β-拉帕醌浓度的增加Fadu细胞的存活率降低,与0 μmol/L相比,差异具有统计学意义(P<0.05,见图1),作用48 h的IC50值为3.547 μmol/L。表明β-拉帕醌对Fadu细胞具有抑制增殖的作用且呈浓度依赖性。
2.2 β-拉帕醌对Fadu细胞增殖的影响
平板克隆实验结果显示,Fadu细胞经浓度为0,2,4,6 μmol/L的β-拉帕醌处理2周后,随着β-拉帕醌浓度的增加Fadu细胞的克隆形成数量明显减少,与0 μmol/L相比,差异具有统计学意义(P<0.05或P<0.01,见图2)。提示β-拉帕醌可显著抑制Fadu细胞的克隆能力,且呈浓度依赖性。

与0 μmol/L相比,*P<0.05图1 不同浓度β-拉帕醌作用48 h对Fadu细胞存活率的影响Figure 1 Effect of different concentrations of β-lapachone for 48 h on the survival rate of Fadu cells

图2 不同浓度β-拉帕醌作用2周对Fadu细胞增殖的影响Figure 2 Effect of different concentrations of β-lapachone for 2 weeks on the proliferation of Fadu cells
2.3 β-拉帕醌对Fadu细胞迁移的影响
Transwell实验结果显示,随着β-拉帕醌浓度的增加,Fadu细胞的迁移数量逐渐减少,与0 μmol/L相比,差异具有统计学意义(P<0.05或P<0.01,见图3)。表明β-拉帕醌可显著抑制Fadu细胞迁移,且呈浓度依赖性。

图3 不同浓度β-拉帕醌作用48 h对Fadu细胞迁移的影响Figure 3 Effect of different concentrations of β-lapachone for 48 h on migration of Fadu cells
2.4 β-拉帕醌对Fadu细胞凋亡的影响
Annexin Ⅴ-FITC/PI双染实验,流式分析结果显示不同浓度的β-拉帕醌(0,2,4,6 μmol/L)作用于Fadu细胞24 h,细胞发生凋亡,并且随着药物浓度的增加,细胞凋亡率明显增高,与0 μmol/L相比,不同浓度药物作用后细胞凋亡率差异具有统计学意义(P<0.05或P<0.01,见图4)。提示β-拉帕醌可显著诱导Fadu细胞凋亡。

图4 不同浓度β-拉帕醌作用24 h对Fadu细胞凋亡的影响Figure 4 Effect of different concentrations of β-lapachone for 24 h on apoptosis of Fadu cells
2.5 β-拉帕醌对Fadu细胞凋亡相关蛋白Bcl-2、Bax及EMT相关蛋白E-cadherin、vimentin、Snai1表达的影响
Western blot结果显示,与0 μmol/L相比,不同浓度的β-拉帕醌(2,4,6 μmol/L)作用于Fadu细胞48 h,Bcl-2、vimentin、Snail蛋白表达量明显下降(P<0.05或P<0.01),Bax、E-cadherin蛋白表达量明显上升(P<0.05或P<0.01,见图5)。表明β-拉帕醌可下调凋亡抑制蛋白Bcl-2的表达并上调凋亡诱导蛋白Bax的表达,与此同时,下调EMT间质标志物vimentin、Snai1蛋白的表达和上调EMT上皮标志物E-cadherin蛋白的表达。
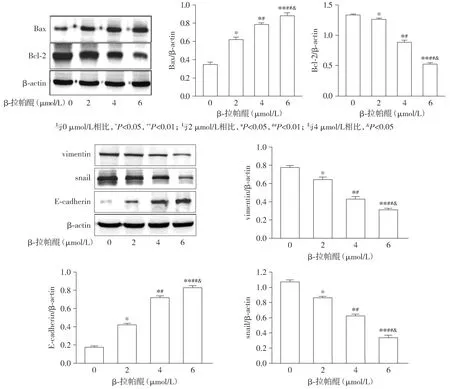
与0 μmol/L相比,*P<0.05,**P<0.01;与2 μmol/L相比,#P<0.05,##P<0.01;与4 μmol/L相比,&P<0.05图5 Western blot检测不同浓度β-拉帕醌对Fadu细胞Bcl-2、Bax、E-cadherin、vimentin、Snail蛋白表达的影响Figure 5 Effect of different concentrations of β-lapachone on the expression of Bcl-2,Bax,E-cadherin,vimentin,Snail in Fadu cells by Western blot
3 讨论
在所有头颈部恶性肿瘤中,下咽癌的生存率最低,总体预后差,95%以上的下咽癌患者被证实为鳞状细胞癌,通常表现为黏膜表面的病变[14]。下咽癌在其行为上通常具有侵袭性,并表现出一种自然史,其特征是弥漫性原发肿瘤伴黏膜和黏膜下局部扩散,早期颈部淋巴结转移,以及相对较高的远端扩散率[15]。目前下咽癌的治疗方式以手术治疗为主,但由于术后复发、远处转移等原因,治疗效果不理想。寻找新的药物来治疗下咽癌成为科研工作者研究的热点。
在过去的30年里,天然化合物的药用价值一直很高,并且一直是癌症治疗的主要药物[16]。天然化合物β-拉帕醌(β-lapachone)化学名为3,4-二氢-2,2-二甲基-2H-萘并[1,2-b]-吡喃-5,6-二酮,属于1,2-萘醌类[17]。β-拉帕醌为新型抗癌候选药物,是一种有力的细胞毒性剂,显示出对多种肿瘤细胞的杀伤作用[18]。但其在下咽癌细胞中的作用及机制尚不清楚,本研究旨在探讨β-拉帕醌对下咽癌细胞的抗癌作用,为此本研究在体外进行了一系列实验探讨β-拉帕醌对下咽癌细胞的作用及相关机制。
细胞不受控制的增殖与肿瘤的整体进展密切相关,而许多恶性肿瘤细胞通过凋亡逃逸获得无限的增殖能力[19]。促凋亡蛋白和抗凋亡蛋白平衡的破坏是凋亡逃逸的一种机制[20]。而Bcl-2基因家族与细胞凋亡的关系密切,如家族中的抗凋亡成员Bcl-2、促凋亡蛋白Bax[21]。因此,通过调控凋亡的关键蛋白或酶的表达或功能来诱导癌细胞凋亡成为癌症研究的热点[22]。因此,本实验从细胞的增殖、凋亡和迁移等方面着手设计,观察β-拉帕醌处理后相关基因蛋白表达水平的变化,以期探索可能的作用机制。经β-拉帕醌处理后,由MTT实验及克隆形成实验的结果可知,β-拉帕醌对下咽癌Fadu细胞具有明显的增殖抑制作用,且呈浓度依赖性。由Tranwell实验结果和流式细胞仪分析结果可知β-拉帕醌还可以抑制下咽癌Fadu细胞的迁移并诱导细胞凋亡。Woo等[23]报道表明,β-拉帕醌可通过降低BCL-2/Bax途径诱导HepG2肝癌细胞凋亡。Jeon等[24]报道表明β-拉帕醌通过凋亡相关蛋白抑制NSCLC细胞增殖和诱导凋亡。本研究的结果与上述报道一致,Fadu细胞经β-拉帕醌处理后,Bcl-2蛋白表达下调,而Bax蛋白的表达上调(BCL-2/Bax比值明显下降),提示β-拉帕醌可能通过凋亡相关蛋白途径诱导下咽癌细胞凋亡的发生。
转移是任何类型癌症死亡的根本原因,而且由于转移过程的复杂性,人们对癌症生物学的这一方面仍然知之甚少[25]。目前,在肿瘤侵袭和转移过程中,上皮细胞向间充质细胞的转化(epithelial-mesenchymal transition,EMT)被认为是一个关键的发展过程[26]。然而,关于EMT在β-拉帕醌抑制下咽癌细胞中的作用尚不清楚。因此,本实验研究了β-拉帕醌和EMT相关分子标志物之间的关系,以阐明β-拉帕醌对下咽癌侵袭和转移的分子机制。Western blot检测结果显示,经β-拉帕醌处理后的Fadu细胞中,与0 μmol/L相比,E-cadherin蛋白的表达水平升高,vimentin和Snail蛋白的表达水平降低,呈现EMT典型的相关分子标志物的表现。这些实验结果表明,β-拉帕醌可以显著抑制Fadu细胞的EMT进展。
综上所述,β-拉帕醌作为NQO1的有效抑制剂可显著抑制下咽癌细胞的增殖、诱导下咽癌细胞凋亡,还可通过EMT途径体外抑制下咽癌细胞的迁移能力。本研究为β-拉帕醌的开发及下咽癌的治疗提供了参考价值,可以预见β-拉帕醌有望成为新的靶向治疗药应用于下咽癌临床治疗。但详细确切的机制还有待于进一步的实验证明。
