磁性镁铝水滑石的制备及非均相Fenton降解甲基橙*
2020-11-05杜昌俊王光华李文兵张政陈铁李享成
杜昌俊 王光华 李文兵 张政 陈铁 李享成
(1.武汉科技大学化学与化工学院绿色与智能煤化工工程技术研究中心 武汉 430081;2.武汉科技大学材料与冶金学院省部共建耐火材料与冶金国家重点实验室 武汉 430081)
0 引言
染料广泛应用于纺织、造纸、皮革鞣制、食品加工、塑料、化妆品、橡胶、印刷染料制造业等领域。染料具有难脱色、毒性大等特点,并且含有大量难去除有机物,纺织工业中染料渗漏对水体的污染一直是环境污染亟待解决的问题之一[1]。
目前对于废水中染料处理主要有吸附、混凝、电化学和生物处理等方法。Fenton高级氧化法因其有成本低、易于实施的优点,在废水处理领域得到了广泛应用[2]。但纯Fe3O4颗粒作为一种典型非均相芬顿催化剂,易发生团聚,反应催化活性会下降。随着纳米技术的发展,各种纳米材料的研发为传统芬顿试剂的缺点带来了新的希望,将Fe3O4颗粒负载在蒙脱土、膨润土、碳纳米管、石墨烯等载体上,形成高效非均相芬顿催化剂,能有效避免纳米颗粒团聚现象发生。
水滑石作为一种新型纳米材料,其主要结构为八面体晶体,与水镁石的层状结构相类似,是一种双金属或多金属氢氧化物[3]。水滑石具有大比表面积,对于染料具有很强的吸附和保持能力[4],其独特的层状结构特性可使其成为非均相芬顿催化剂的理想载体。本文使用了共沉淀法制备了Mg-Al水滑石(LDH),并用氧化沉淀法将Fe3O4原位负载在水滑石表面[5]。采用XRD,SEM和FITR对Fe3O4/LDH复合催化剂进行表征。测定了催化剂催化双氧水降解甲基橙脱色的情况。系统对比了不同催化剂负载量、催化剂用量、溶液初始pH值、温度以及双氧水用量条件下复合催化剂的催化活性,探究了催化剂的重复使用性能。
1 材料与仪器
1.1 材料
实验所需试剂有FeSO4·7H2O,Mg(NO3)2·6H2O,Al(NO3)3·9H2O,NaOH,Na2CO3,NaNO3,HCl,30%H2O2,无水乙醇,甲基橙等,均为分析纯,购于国药集团化学试剂有限公司。
1.2 仪器
DF-101S型磁力搅拌器,河南予华仪器有限公司;UV-2550紫外可见光分光光度计,岛津公司;PHS-3C型pH测量计,上海佑科仪器仪表有限公司;HH SY21-Ni型水浴锅,北京市长风仪器仪表公司;Nova 400 Nano SEM,美国FEI公司;VERTEX70型傅里叶变换红外光谱仪(FI-TR),德国布鲁克公司;XPert Pro MPD X射线粉末衍射仪(XRD),荷兰PANalytical分析仪器公司。
1.3 催化剂的制备
LDH的制备:采用共沉淀法制备水滑石,按3∶1的摩尔比取适量Mg(NO3)2·6H2O,Al(NO3)3·9H2O溶于100 mL蒸馏水中,记为溶液A,取一定量NaOH,Na2CO3溶于100 mL蒸馏水中,记为溶液B。取适量蒸馏水于三口烧瓶中,放置60 ℃水浴中,不断搅拌,将A,B两种溶液分别逐滴加入烧瓶内,调节pH值并稳定在10左右,待沉淀完成后,水浴温度调至80 ℃,恒温陈化24 h,抽滤并将其洗至中性,80 ℃真空干燥12 h,研磨至100 μm,即得到Mg-Al LDH。
Fe3O4/LDH的制备:采用原位氧化沉淀法制备Fe3O4/LDH复合材料,首先取一定量LDH分散于蒸馏水中,按4∶3的摩尔比取适量NaOH,NaNO3加入装有LDH的三口瓶内,通氮30 min,然后将其置于95 ℃水浴中,逐滴加入一定量FeSO4·7H2O溶液,持续搅拌3 h,磁分离并将其冷却至室温,用蒸馏水和无水乙醇交替洗涤3次,80 ℃真空干燥8 h,研磨即得到Fe3O4/LDH复合材料。根据Fe3O4与LDH的不同质量比(质量比分别为1∶2,1∶1,2∶1,3∶1),记催化剂为:Fe3O4X/LDH(X=Ⅰ、Ⅱ、Ⅲ、Ⅳ)。
1.4 甲基橙的降解实验
取100 mL甲基橙溶液(100 mg/L)于锥形瓶中,用HCl和NaOH溶液将其初始pH值调至2~7,加入一定量Fe3O4X/LDH,并置于水浴中搅拌60 min使其吸附平衡,然后加入一定量H2O2,每隔半小时取上清液用分光光度计测定甲基橙浓度,反应结束后,将催化剂磁分离,洗涤烘干后备用,按相同方法分别进行不同催化剂、溶液初始pH值、催化剂用量、初始H2O2浓度以及温度下甲基橙的降解实验。
2 结果与分析
2.1 催化剂的表征与分析
2.1.1 SEM分析
纯Fe3O4的SEM如图1(a)所示,氧化沉淀法制备的Fe3O4纳米颗粒具有球状结构,颗粒粒径大小均一,团聚较严重,纳米颗粒的平均粒径约为50~80 nm。图1(b)和图1(c)分别为Fe3O4Ⅰ/LDH与Fe3O4Ⅱ/LDH的SEM图,LDH表面没有被Fe3O4纳米颗粒完全覆盖,这可能是由于Fe3O4负载量较少所导致的。图1(d)是Fe3O4Ⅲ/LDH的SEM图,随着Fe3O4负载量的增加,纳米颗粒均匀地分布在LDH表面,粒径均一,分散性好。图1(e)是Fe3O4Ⅳ/LDH的SEM图,当Fe3O4负载量过大时,LDH表面几乎被Fe3O4纳米颗粒完全覆盖,团聚严重。

(a)
2.1.2 XRD分析

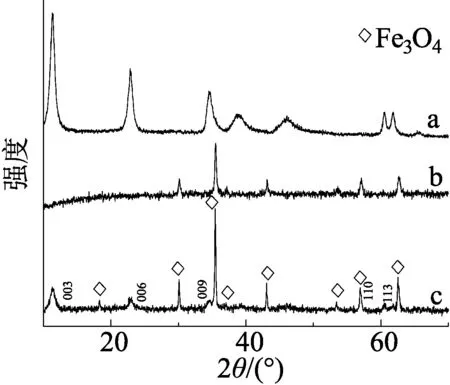
图2 各样品的XRD衍射谱图
2.1.3 红外分析


图3 各样品的红外光谱图
2.2 不同Fe3O4负载量的影响
分别取Fe3O4(Ⅰ~Ⅳ)/LDH样品0.1 g在pH=3、温度25 ℃、H2O2浓度30 mmol/L的条件下对100 mg/L甲基橙进行降解实验,结果如图4所示,Fe3O4负载量很少时,对于Fe3O4Ⅰ/LDH,90 min后甲基橙就达到降解平衡,这可能是由于LDH表面没有被Fe3O4纳米颗粒完全负载,能快速将MO分子吸附在其层间,并被Fe3O4降解。但因Fe3O4负载量太少,总降解率只有70%。对于Fe3O4Ⅱ/LDH和Fe3O4Ⅲ/LDH,随着Fe3O4负载量的增加,甲基橙的降解率明显提高,这可能是由于Fe3O4Ⅱ/LDH和Fe3O4Ⅲ/LDH中Fe3O4颗粒分布得更加均匀,为H2O2提供了更多的催化活性位点,加速了降解过程的进行。但对于样品Fe3O4Ⅳ/LDH,当Fe3O4负载量超过80%时,降解速率反而下降,270 min后总降解率虽然才能达到90%,这可能是由于Fe3O4纳米颗粒在LDH表面团聚过于严重导致的。由此可知,n(Fe3O4)∶n(LDH)=2∶1为最佳负载比例。

图4 不同Fe3O4负载量对MO降解效果的影响
2.3 pH值的影响
在其他条件不变(催化剂用量1.0 g/L、H2O2浓度30 mmol/L、温度25 ℃)时,探究了体系pH值对甲基橙降解的影响,结果如图5所示。体系pH值为2~5时,Fe3O4/LDH具有较好的催化活性,pH值为2和3时,甲基橙降解速率极高,120 min后其降解率达到97%以上。但当pH值升至4和5时,甲基橙的降解速率和降解率呈现明显下降趋势,180 min后体系才能达到降解平衡,降解率分别为89%和85%。当pH值升至中性时,甲基橙几乎没有被降解,这可能是因为在接近碱性条件下H2O2容易分解成H2O和O2,并不会产生·OH,且溶液中Fe2+和Fe3+容易和OH-结合形成氢氧化铁复合物,进而导致催化剂活性下降。因此复合催化剂的最佳反应pH值为3。

图5 初始pH值对MO降解效果的影响
2.4 催化剂用量的影响
图6显示了在pH=3,H2O2浓度30 mmol/L、温度25 ℃的条件下,催化剂用量在0.2~1.2 g/L范围内对甲基橙降解的影响,可以看出随着催化剂用量的增加,甲基橙的降解速率显著提高。催化剂用量为0.2 g/L时,降解速率缓慢,240 min后甲基橙的去除率仅为42%。但当催化剂用量提升为0.4~1.2 g/L时,甲基橙的降解率从82%逐渐增加到97%,这可能是由于催化剂用量的增加,反应体系给H2O2提供了更多的催化活性位点,加快了·OH的产生速率,从而提高了甲基橙的降解率。但当催化剂用量大于1.0 g/L时,甲基橙的降解率基本不变,可能是由于过多的催化剂导致了Fe3O4的团聚从而影响了·OH生成速率。由此可知复合催化剂的最佳用量为1.0 g/L。

图6 催化剂投入量对MO降解效果的影响
2.5 H2O2用量的影响
为了探究H2O2用量对去除甲基橙的影响,在催化剂用量1.0g/L,pH=3、温度25 ℃的条件下,进行了不同H2O2浓度下催化剂对染料的降解实验,结果如图7所示。当H2O2浓度从10 mmol/L提升到30 mmol/L时,甲基橙的降解速率逐渐提高,120 min后达到降解平衡,这可能是因为H2O2浓度的提升使其能充分和催化剂表面活性位点接触,并快速生成·OH,进而加快了甲基橙的降解速率,去除总量也逐渐提高。但当H2O2用量提升到50 mmol/L时,降解效率反而下降,这可能是因为过量的H2O2会与·OH结合形成HO2-,从而导致了甲基橙降解率下降。H2O2浓度继续升至80 mmol/L时,甲基橙的去除率也降至89%。结果表明H2O2的最佳用量为30 mmol/L。

图7 H2O2投入量对MO降解效果的影响
2.6 温度的影响
在催化剂用量1.0 g/L,pH=3,H2O2浓度30 mmol/L的条件下,探究了反应温度对甲基橙降解的影响,结果如图8所示。随着环境温度从15 ℃升高至55 ℃,甲基橙的降解速率明显提升,甲基橙的去除率从85%增加至99%,且在55 ℃时,甲基橙在30 min降解率就达到了96%,这可能是由于温度的提高,促进了·OH的产生,加快了甲基橙的降解速率。因此在55 ℃时,甲基橙的降解速率最快,但是考虑在不外加能量就能达到较好的甲基橙降解效果,最后选择室温25 ℃为最佳反应温度。
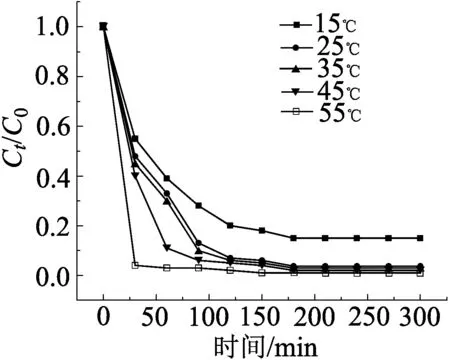
图8 反应温度对MO降解效果的影响
2.7 催化剂的重复利用实验
取一定量的Fe3O4/LDH复合催化剂,对甲基橙进行降解实验,降解完成后,通过外加磁场从反应溶液中分离出Fe3O4/LDH催化剂,将催化剂烘干备用,并在相同条件下重复上述降解实验4次,得到Fe3O4/LDH催化剂的重复利用实验结果,如图9所示。可以看出,重复4次后催化剂对MO的去除率仍有92%,没有明显降低。结果表明,Fe3O4/LDH具有良好的化学稳定性和重复使用性。
3 结论
(1)制备了Fe3O4/LDH纳米材料,并利用SEM,XRD和FITR对其形貌结构、晶型结构进行表征。结果表明制备的Fe3O4/LDH复合催化剂中无其他杂相产生,Fe3O4纳米颗粒大小均一,并能均匀地负载在LDH表面。
(2)在pH=3、温度25 ℃、H2O2用量30 mmol/L、催化剂用量1 g/L的条件下,100 mg/L的MO在120 min后几乎完全被去除,磁性水滑石非均相芬顿催化体系实现了甲基橙的高效降解。
(3)Fe3O4/LDH复合催化剂的催化活性高于纯Fe3O4,当Fe3O4的负载量为66.7%时,复合催化剂对于MO的降解达到最佳效果。复合催化剂具有良好的化学稳定性,重复使用4次效果稳定。
