尿素循环限速酶CPS1在胃黏膜肠上皮化生及癌变过程中的表达特征
2020-11-04方旭前罗方秀李芹芹马乾宸陈培战
方旭前, 罗方秀, 李芹芹, 马乾宸, 陈培战, 袁 菲
1.上海交通大学医学院附属瑞金医院北院病理科,上海 201801;2.上海交通大学医学院附属瑞金医院病理科;3.上海交通大学医学院附属瑞金医院北院中心实验室
肠型胃癌的发生经历了多步骤、多阶段的过程。Correa等[1]于1975年提出的胃癌发生模型被广为接受,其中肠型胃癌的发生历经慢性非萎缩性胃炎、萎缩性胃炎、肠上皮化生、低度异型增生[低级别上皮内瘤变(LGIN)]、高度异型增生[高级别上皮内瘤变(HGIN)]、癌变、浸润性腺癌等多个阶段。其中肠上皮化生是胃癌的重要癌前病变之一,可导致胃癌风险增加10倍[2]。尾型同源盒转录因子2(CDX2)是一种肠上皮特异性转录因子,CDX2在胃黏膜中异源性表达可驱动肠上皮化生而形成肠道表型。许多研究表明,CDX2是肠上皮化生特异性标志物,在>85%肠化生腺上皮中呈强阳性表达[3-4]。氨甲酰磷酸合成酶1(CPS1)是尿素循环第1个限速酶,在组织病理中曾命名为肝细胞石蜡抗原1(HepPar1)或肝细胞抗原(hepatocyte antigen,Hep),用于识别肝源性肿瘤。HepPar1也是小肠分化的一个敏感标志物,可特异性识别Barrett食管或慢性胃炎伴生的肠化生,是食管黏膜和胃黏膜肠化生的早期诊断标志物[5],提示CPS1可能参与食管癌及结肠癌的癌变过程。Srivastava等[6]发现,CPS1在Barrett食管中高表达,在异型增生、食管腺癌中表达下调,认为CPS1表达下调是食管癌癌变标志物。在结肠癌癌变过程,May等[7]发现,伴发高度异型增生或癌变的溃疡性结肠炎患者的结肠黏膜中CPS1呈高表达,认为CPS1表达上调是预测溃疡性结肠炎是否会向异型增生或癌变发展的分子标志物。提示CPS1在不同肿瘤的发生过程中表达模式不一。本研究以经典的肠化标志物CDX2为对照,评价CPS1在慢性萎缩性胃炎伴生的肠化生及癌变过程中的表达特性,以进一步研究其在肠型胃癌演变过程中的作用。
1 材料与方法
1.1 入组病例124例不同病变胃黏膜组织来自瑞金医院北院2018年1月至2020年1月的胃镜活检标本,结合胃镜检查和病理组织学检查,诊断为胃浅表黏膜慢性炎10例、小肠黏膜慢性炎10例、结肠黏膜慢性炎10例、慢性萎缩性胃炎伴肠化生32例、低度异型增生30例、高度异型增生32例。所取组织标本均经瑞金医院北院伦理委员会的审批。
172例肠型胃癌组织选自南通肿瘤医院2000年12月至2005年4月收治的患者。大多数患者在先前的研究中已有报道[8]。入组人群为初诊胃癌患者,尚未接受任何治疗。如患者有其他类型的恶性肿瘤病史,且接受过新辅助化疗或手术治疗,则将其排除在外。所有病例均经术后病理证实。从入院记录中获取基线资料,从病历中提取临床和病理数据,由临床医师根据实验室检查和图像进一步评估。所取组织标本均经南通肿瘤医院伦理委员会的审批。
1.2 组织芯片的建立胃癌术后组织经甲醛固定、石蜡包埋、病理组织学检查确定肿瘤核心区及邻近癌旁区。委托生物芯片上海国家工程研究中心进行芯片的点样与制作。
1.3 免疫组化染色采用Leica Bond Ⅲ全自动免疫组化仪进行免疫组化(IHC)染色。石蜡包埋组织层厚3~5 μm切片。CPS1抗体(Abcam,美国),克隆号GR147297-2,工作浓度1∶200。CDX2抗体(Abcam,美国),克隆号BP6023,工作浓度1∶400。具体实验步骤按仪器说明书。
1.4 结果判断根据阳性细胞染色强度和阳性细胞的百分率进行评分[9]。弥漫强阳性:染色强度强,阳性细胞弥漫分布(3分);局灶阳性:染色强度强,阳性细胞局灶分布(2分);弱阳性:染色强度弱-中(1分);阴性:不着色或非特异性染色(0分)。所有结果均经由两位经验丰富的病理医师独立判读。
1.5 统计学分析采用统计学软件GraphPad Prism 8对数据进行χ2检验,用Mann Whitney testU检验检测不同癌变阶段CPS1和CDX2的表达差异,P<0.05为差异有统计学意义。
2 结果
2.1 CPS1和CDX2的表达情况在胃黏膜中,CPS1和CDX2均无阳性表达。CPS1在10例小肠黏膜中均表达(包括3例十二指肠、5例空肠和2例回肠),其中空肠部位表达最为明显,但在结肠黏膜中不表达。CDX2在小肠、结肠黏膜中均表达。CPS1和CDX2在肠化生中均呈强阳性表达,阳性率分别为100%(32/32)和87.5%(28/32)(见图1)。在小肠黏膜中,CPS1只有吸收细胞呈胞质颗粒阳性,而杯状细胞为阴性。在肠化生中,CPS1于整个肠化生区域内呈弥漫强阳性表达,比在小肠黏膜中表达更加显著。CPS1和CDX2在小肠型(Ⅰ型)、结肠型(Ⅱ型)肠化生中均弥漫强阳性表达,不同类型肠化生间(完全型肠化生与不完全型肠化生)表达程度差异无统计学意义(见图2A、2B)。CPS1和CDX2在异型增生或肠型胃癌的肠化生中亦呈弥漫强阳性表达。本研究纳入30例低度异型增生中28例合并肠化生,32例高度异型增生中17例合并肠化生,CPS1和CDX2在异型增生合并肠化生中的阳性率分别为100%(45/45)和93.3%(42/45)。
2.2 CPS1和CDX2在胃癌癌前病变及胃癌中的表达CPS1在低度异型增生中,21例(70.0%)呈弥漫强阳性,与周围非瘤变的肠化腺上皮表达程度差异无统计学意义,而9例(30.0%)呈局灶阳性。在高度异型增生中,4例(12.5%)呈弥漫强阳性,7例(21.9%)呈局灶阳性,7例(21.9%)呈弱阳性,14例(43.8%)阴性(见图2C~2H)。CPS1的表达在各个阶段间差异均有统计学意义(P<0.05,见表1)。同比,CDX2在28例(87.5%)肠化生及30例(100%)低度异型增生腺上皮中呈胞核强阳性。CDX2在高度异型增生中,25例(78.1%)强阳性,7例(21.9%)局灶或弱阳性。CDX2表达在低、高度异型增生间差异有统计学意义(P=0.0118,见表1)。
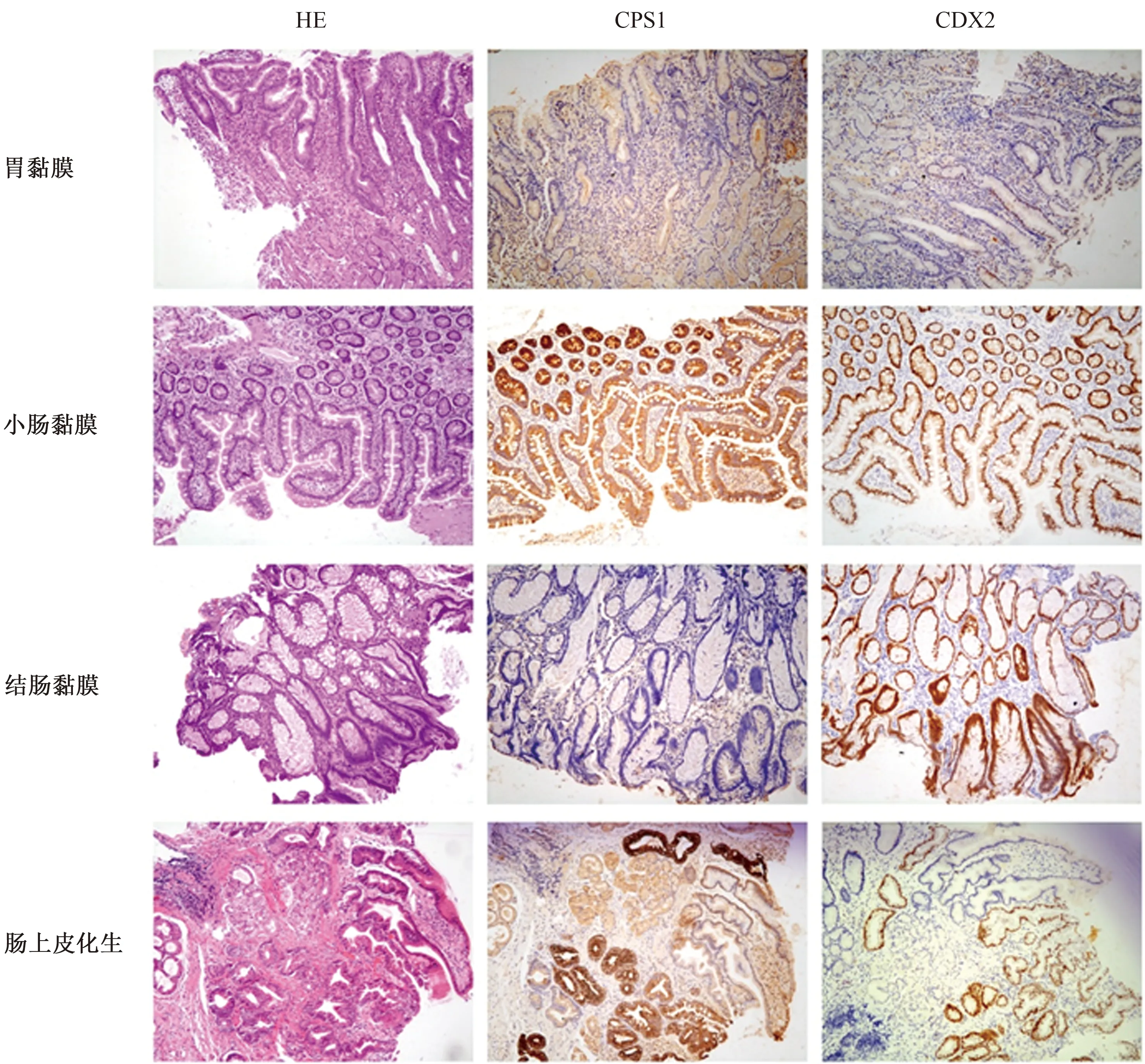
图1 CPS1和CDX2 在胃、小肠、结肠黏膜及肠化生病灶中的表达(放大100倍)Fig 1 The expressions of CPS1 and CDX2 in gastric, intestinal, colonic mucosa and intestinal metaplasia

注:A:完全型肠化生:弥漫强阳性;B:不完全型肠化生:弥漫强阳性;C:LGIN:弥漫强阳性;D:LGIN:局灶阳性;E:HGIN:弥漫强阳性;F:HGIN:局灶阳性;G:HGIN:弱阳性;H:HGIN:阴性。图2 CPS1 在不同类型肠化生及异型增生病变组织中的表达(放大200倍)Fig 2 The expression of CPS1 in different types of intestinal metaplasia and dysplasia

表1 CPS1和CDX2在胃癌癌前病变及胃癌中的表达[例数(%)]Tab 1 The expressions of CPS1 and CDX2 in gastric cancer and precancerous lesions [n(%)]
2.3 CPS1表达与肠型胃癌临床参数相关性分析CPS1在172例肠型胃癌中,14例(8.1%)呈弥漫强阳性,14例(8.1%)呈局灶阳性,37例(21.5%)呈弱阳性,107例(62.2%)阴性。CPS1阴性组与TNM分期(P=0.031)和浸润深度(P=0.037)显著相关,但与年龄、性别、淋巴结转移、远处转移无关(P>0.05)(见表2)。

表2 CPS1表达与肠型胃癌临床参数相关性分析[例数(%)] Tab 2 Correlation between the expression of CPS1 and clinical parameters in intestinal type gastric cancer [n(%)]
3 讨论
肠上皮化生是Barrett食管或慢性萎缩性胃炎重要的组织学特征,在形态学上表现为胃黏膜上皮转变为小肠或结肠黏膜上皮组织。肠化生若未经合适的治疗可能发展成不典型增生或癌,是肠型胃癌重要癌前病变之一。大部分肠化生根据形态特征如帕内特细胞或杯状细胞很容易判读,但少数情况下肠化生腺体较少,细胞形态较小,借助有效的肠化生标志物可以降低判读的难度。目前,认为肠化生标志物根据分化方向可分为两类:一类为胃源性相关蛋白,如SOX2[10]、黏蛋白MUC5AC和MUC6[11]。一类为肠源性相关蛋白,如肠特异性转录因子CDX2[12]、黏蛋白MUC2和绒毛蛋白Villin[13]。在肠化生阶段,控制胃表型的胃源性相关蛋白表达下调,而控制肠表型的肠源性相关蛋白表达上调,实现了胃表型的去分化和肠表型的再分化。
与以往的标志物不同,CPS1是较明确的肝源性标志物,虽然在小肠黏膜中有一定程度的表达。有研究比较CPS1在分化成熟的肝、小肠中的表达程度和酶的活性,肝是小肠的10~20倍[14]。Chu等[15]首先报道Hep(即CPS1)作为肠化生标志物的优点。在正常胃、食管黏膜中不表达,在Barrett食管和胃炎性肠化生中高表达。相比MUC2仅在杯状细胞中表达,Hep在含杯状细胞的柱状上皮细胞中均弥漫强阳性表达,因此Hep对肠化腺体的标记更加明显。除此外,我们还检测了异型增生及胃癌癌旁的肠化腺体,均能检测到CPS1的弥漫强阳性表达,进一步肯定了CPS1是肠上皮化生特异性标志物。在肠上皮化生阶段,与CDX2相比,CPS1的灵敏度更高。我们仔细观察了CDX2漏检的几例标本,存在肠化腺体较小、杯状细胞不够明显的情况。且CPS1在完全型肠化生与不完全型肠化生中均呈弥漫强阳性表达。因此CPS1是一个覆盖全面、高灵敏度的肠上皮化生标志物。
CDX2是较为公认的肠化生标志物,在不同亚型的肠化生中差异有统计学意义[16]。在本研究中,CDX2在87.5%(28/32)肠化生及100%(30/30)低度异型增生上皮中呈胞核强阳性,在高度异型增生阶段虽然维持表达,但43.8%(14/32)样本出现局灶或弱阳性表达。相比之下,CPS1在肠化生恶性转变过程中表达丢失更为明显。CPS1在肠型胃癌的癌变进程中不断表达下调,CPS1的表达程度在癌变的各个阶段差异均有统计学意义,提示CPS1表达下调可能是肠化生恶性转变的标志物。我们的研究与Srivastava等[6]在Barrett食管及相关异型增生、食管腺癌中表达模式一致,与May等[7]在溃疡性结肠炎癌变过程中表达模式相反。Abu-Zeid等[17]探索了CPS1在结肠癌癌变过程中表达模式,发现CPS1在正常结肠黏膜中不表达,但在47.5%的结肠癌、41.7%的高度异型增生性息肉和23.5%的低度异型增生性息肉中表达。在结肠癌中,CPS1表达与预后较好的临床参数如无淋巴结转移、较低的TNM分期相关[17]。因此研究者认为,CPS1可能参与异型增生的启动,但在肿瘤的进展和转移过程中扮演抑癌基因的角色。我们在172例肠型胃癌患者中分析了CPS1表达与临床参数的相关性,发现CPS1表达下调与更高的TNM分期和浸润深度显著相关,提示CPS1表达下调预后较差。与上述研究结论相似,CPS1可能是肠型胃癌的一个抑癌基因。
过去的研究认为,肠上皮化生是胃源性相关蛋白与肠源性相关蛋白参与的分化再编程的过程[18-19]。胃、肠、肝及胰腺均来源于卵黄囊内脏内胚层。有研究显示,人胃上皮细胞可转变成多潜能的内胚层祖细胞,进一步被诱导分化为成熟的肝细胞、胰腺细胞和肠道上皮细胞[20]。我们猜测在胃幽门螺杆菌和胆汁酸反流这两个最常见的肠化生因素的刺激下,胃上皮细胞去分化为内胚层祖细胞,此时具有多向分化的潜能。虽然在形态学上仅能观察到肠表型,但在分子层面并不能否认其他表型存在的可能性。脂肪酸结合蛋白(FABP)根据组织学特征可分为肝脏型、心脏型、表皮型和小肠型。而肝脏型FABP(FABP1)被发现在Barrett食管中高表达,进一步研究显示它是比CDX2灵敏度和特异度更高的Barrett诊断标志物[21],且FABP1在异型增生和食管腺癌阶段表达下调,表达模式与CPS1一致[6]。肝细胞核因子4α(HNF4α)在成体表达于肝脏、肾脏、胰腺、小肠和结肠,在分化成熟的肝细胞高表达,与肝特异基因的表达密切相关。目前研究发现,HNF4α是Barrett化生形成的关键早期步骤,在食管中异位表达HNF4α,可以在成年小鼠食管上皮中诱导出柱状表型[22]。因此肠化生过程中,是否有肝表型的分化,而在癌变过程肝表型的迅速丢失与癌变有怎样的关系,有待进一步研究。
综上所述,本研究报道了CPS1与CDX2在胃黏膜肠上皮化生及癌变过程中的表达特征,发现CPS1是一个覆盖全面、高灵敏度的肠上皮化生标志物。在异型增生阶段,CPS1呈现更显著的表达丢失,提示CPS1表达下调可能是肠化生恶性转变的标志物。在肠型胃癌中,CPS1表达下调与更高的TNM分期和浸润深度显著相关,提示CPS1可能是肠型胃癌的一个抑癌基因。CPS1可能在肠型胃癌的发生中发挥重要作用,但其表达调节的具体机制、CPS1是肠化的始动因素还是伴生现象、是否受肠化生相关转录因子调控、在癌变过程中逐渐丢失的目的和分子机制等仍有待进一步研究。
