黄芩苷介导光动力疗法治疗宫颈癌的疗效及其机制研究
2020-11-03郭婕潘彦舒庞大承牟天龙
郭婕 潘彦舒 庞大承 牟天龙

摘要 目的:觀察黄芩苷介导光动力疗法(PDT)治疗宫颈癌的疗效,探讨其可能机制。方法:将宫颈癌Hela细胞悬液注入裸鼠皮下,构建移植瘤模型,成模后随机均匀分为模型组、黄芩苷-PDT观察组、PDT观察组、姜黄素-PDT观察组4组,每组18只。PDT观察组:肿瘤周围注射100 μL生理盐水,6 h后瘤周注射硼砂缓冲液100 μL后行PDT治疗,照射剂量为80 J/cm2(435 nm波长,0.60 A,0.54 W,距离肿瘤表面3~5 cm,照射2 min 28 s);黄芩苷-PDT观察组:以80 μg/mL的黄芩苷溶液100 μL代替生理盐水,其他同PDT观察组;姜黄素-PDT观察组:以50 μmol/L的姜黄素溶液100 μL代替生理盐水,其他同PDT观察组;模型组:以自然光照代替PDT治疗,其他同PDT观察组。治疗1 d后,各组处死6只取材肿瘤组织制备成病理切片,HE染色观察组织病理学改变;另外处死6只,利用蛋白质印迹法检测肿瘤组织中Bcl-2和Bax蛋白的表达情况;剩余6只分别于治疗第1、3、7、14 d测量肿瘤体积,计算肿瘤体积抑瘤率。结果:模型组肿瘤体积持续增大,光动力治疗1 d后肿瘤组织出现坏死,肿瘤生长受到抑制,黄芩苷-PDT观察组和姜黄素-PDT观察组肿瘤体积在3 d内均无增大趋势,随后逐渐增大。黄芩苷-PDT观察组Bcl-2和Bax蛋白表达与模型组比较,差异有统计学意义(P<0.05)。结论:黄芩苷介导的PDT能够有效抑制宫颈癌体外移植瘤的增长,其机制可能通过促进癌细胞凋亡发挥作用。
关键词 黄芩苷;姜黄素;光动力疗法;肿瘤抑制;凋亡机制
Abstract Objective:To observe the therapeutic effects of baicalin-mediated photodynamic therapy (PDT) on cervical cancer and explore its possible mechanism. Methods:A cervical cancer Hela cell suspension was injected subcutaneously into nude mice to construct a transplanted tumor model. After the model was formed, it was randomly and evenly divided into 4 groups: a model group, a baicalin-PDT treatment group, a PDT treatment group, and a curcumin-PDT treatment group , with 18 cases in each group. PDT treatment group: 100μL of saline was injected around the tumor, and 100 μL of borax buffer was injected around the tumor 6 hours later, followed by PDT treatment. The irradiation dose was 80J/cm2 (435nm wavelength, 0.60A, 0.54W, 3-5cm from the tumor surface, irradiation 2 min28s); Baicalin-PDT treatment group: 100 μL of baicalin solution at 80 μg/mL instead of normal saline, others were the same as PDT treatment group; curcumin-PDT treatment group: 50 μmol/L curcumin solution instead of 100 ml normal saline, others were the same as PDT treatment group; model group: natural light instead of PDT treatment, others were the same as PDT treatment group. After 1 day of treatment, 6 rats were sacrificed in each group and their tumor tissues were prepared for pathological sections, and the histopathological changes were observed by HE staining; another 6 were sacrificed, and the expression of Bcl-2 and Bax proteins in tumor tissues were detected by Western blot technology; their tumor volume of 6 remaining rats, was measured only on the 1st, 3rd, 7th, and 14th days of treatment, and the tumor volume inhibition rate was also calculated. Results:The tumor volume in the model group continued to increase. Tumor tissue appeared necrosis and tumor growth was inhibited after 1 day of photodynamic therapy. The tumor volume of baicalin-PDT treatment group and curcumin-PDT treatment group did not increase within 3 days, and then gradually increased. The expression of Bcl-2 and Bax proteins in the baicalin-PDT treatment group was significantly different from that in the model group (P<0.01). Conclusion:Baicalin-mediated PDT can effectively inhibit the growth of cervical cancer xenografts in vitro, and its mechanism may play a role in promoting cancer cell apoptosis.
Keywords Baicalin; Curcumin; Photodynamic therapy; Tumor suppression; Apoptosis mechanism
中图分类号:R284;R711.74文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.11.013
宫颈癌具有发病率高、致死率高以及发病年龄趋于年轻化的特点,目前在危害女性生命健康的恶性肿瘤排名中,位居第2位[1],给女性的身心健康带來严重的威胁。宫颈癌的死亡率位居全球癌症死亡率的第4位[2]。世界卫生组织(WHO)估计,全球宫颈癌新发病例数为52.8万,死亡人数为26.6万,其中85%的病例发生在中低收入国家。我国近年来子宫颈癌发病率呈上升趋势,子宫颈癌的防治作为公共卫生问题已引起中国政府的高度重视和关注[3]。
在诸多治疗宫颈癌的疗法中,光动力疗法(Photodynaminc Therapy,PDT)是一种在肿瘤治疗方面有着广阔前景的新型疗法,该疗法具有对病变部位造成的创伤小、定位精准、治疗时间短、操作简便、价格低等优点[4-5],而宫颈上皮是由宫颈阴道部鳞状上皮和宫颈管柱状上皮共同组成,宫颈鳞状上皮一般厚度为1 mm[6],当其发生宫颈上皮内瘤变(Cervical Intraepithe-lial Neoplasia,CIN)时,其局限于宫颈上皮基底膜以上的上皮组织内,这部分组织厚2~3 mm。当CIN发展至早期宫颈微小浸润癌时的浸润深度在3~5 mm[7]。对于大多数组织而言,PDT作用深度为5~10 mm[8],因此使得PDT可以治疗CIN和宫颈癌;加之宫颈部位特殊,容易暴露,使宫颈病变成为“浅表”病变,局部给药和光照十分方便,对局部作用针对性强,对机体产生的不良反应较全身用药后小,不易产生耐药性[9],从而使得PDT在治疗宫颈病变方面更显优势。此外,PDT在保留完整器官的前提下,还可以行多次重复治疗,清除剩余病变组织[10],这样对于病变直径大于3 cm,累及宫颈腺腔深度超过2.5 cm的病变,更加突显优势。同时,PDT治疗后,女性的生育功能未受到破坏。
目前临床中使用的光敏剂由于其成分复杂,易受生物代谢的影响,光敏损伤作用的程度不易控制,且多次使用会出现不良反应和耐受性[5],因而限制了PDT治疗作用的发挥。而黄芩苷具有感光效应,在加入硼砂溶液后,其光敏性明显增强[11-12],此外,黄芩苷具有明显的抗肿瘤、抗炎、防止炎癌转化以及调经等功效[13],对比我们前期研究的姜黄素结合PDT疗法[14],黄芩苷具有治疗妇科相关病症的药效,在相关妇科疾病的对症治疗上,可能其结合PDT后会有优于姜黄素的疗效;黄芩苷有望成为一种高效、低毒且具有多重抗肿瘤作用的新型光敏剂。因此,本实验拟采用黄芩苷介导PDT疗法治疗宫颈癌,观察该疗法对肿瘤组织的治疗作用,并初步探讨其可能的抑瘤机制。
1 材料与方法
1.1 材料
1.1.1 动物 健康雌性BALB/c裸鼠,4周龄,SPF级,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0006,饲养于北京中医药大学科研实验室IVC动物房,自由进食和饮水,适应性饲养1周。本实验经过北京中医药大学医学实验动物伦理委员会批准(伦理审批号:BUCM-4-2018122101-4065)。
1.1.2 细胞 宫颈癌Hela细胞,由北京协和医学院馈赠,用含10%的胎牛血清的完全培养基于37 ℃、5%CO2的培养箱中培养。
1.1.3 药物 黄芩苷(Biorule公司,美国,货号:RB11127),姜黄素(Bioruler公司,美国,货号:RB12712)。
1.1.4 试剂与仪器 硼砂-氢氧化钠缓冲液0.1 mol/L pH10.1(北京鼎国昌盛生物技术有限责任公司,货号:BF-0091);4%固定液(南京凯基生物技术有限公司,批号:备KGIHC016CS);Bcl-2一抗(Abcam公司,英国,批号:ab692);Bax一抗(CST公司,美国,批号:14796S);RIPA裂解液(北京索莱宝科技有限公司,批号:R0020);蛋白磷酸酶抑制剂混合物(北京索莱宝科技有限公司,批号:P1260);脱脂奶粉(北京索莱宝科技有限公司,批号:D8340);BSA(北京索莱宝科技有限公司,批号:A8010);蛋白Marker(北京索莱宝科技有限公司,批号:PR1920);PVDF膜(0.45 μm)(Millipore公司,美国,批号:IPVH00010);ECL超敏发光液(北京索莱宝科技有限公司,批号:PE0010A+B);30%丙烯酰胺(北京索莱宝科技有限公司,批号:0933);TEMED(Sigma公司,美国,批号:T8133);BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司,批号:PC0020);β-tubulin(中山金桥生物有限公司,批号:TA-09);山羊抗鼠-HRP(中山金桥生物技术有限公司:批号:134560);山羊抗兔-HRP(中山金桥生物技术有限公司,批号:ZB-2301);兔抗山羊-HRP(中山金桥生物技术有限公司,批号:ZB-2306);光动力治疗仪(北京镭志威光技术有限公司,型号:BL18111611);数显游标卡尺(宁波得力工具有限公司,型号:DL91150);电泳仪(北京六一生物科技有限公司,型号:DYY-7C);水平摇床(ORBITAL公司,美国,型号:TS-1);pH计(上海精密科学仪器有限公司雷磁仪器厂,型号:PHS-3C);电子天平(Precisa公司,瑞士,型号:321LS);磁力搅拌器(上海跃进医疗器械有限公司,型号:CJ-78-1A);酶标仪(BioTek Synergy公司,美国,型号:H4);离心机(Thermo公司,美国,型号:lablerv ls);化学发光成像仪(上海天能科技有限公司,型号:Tanon-5200)。
1.2 方法
1.2.1 分组与模型制备 将培养好的宫颈癌Hela细胞调整计数为5×107/mL,在每只裸鼠的背部皮下注入100 μL细胞悬液,经过一周潜伏期,背部出现近似于米粒大小的肿块,提示宫颈癌体外移植瘤模型造模成功。待肿块直径大于等于0.5 cm时,将造模成功的模型鼠随机分为4组,即:模型组、黄芩苷-PDT观察组、PDT观察组、姜黄素-PDT观察组,18只/组。
1.2.2 干预方法 PDT观察组:肿瘤周围注射100 μL生理盐水,6 h后瘤周注射硼砂缓冲液0.01 mol/L 100 μL后行PDT治療,照射剂量80 J/cm2(435 nm波长,0.60 A,0.54 W,距离肿瘤表面3~5 cm,照射2 min 28 s);黄芩苷-PDT观察组:以80 μg/mL的黄芩苷溶液100 μL代替生理盐水,其他同PDT观察组;姜黄素-PDT观察组:以50 μmol/L的姜黄素溶液100 μL代替生理盐水,其他同PDT观察组;模型组:以自然光照代替PDT治疗,其他同PDT观察组。治疗1 d后,各组处死6只取材肿瘤组织制备成病理切片,HE染色观察组织病理学改变,另外处死6只,利用蛋白质印迹法检测肿瘤组织中Bcl-2和Bax蛋白的表达情况;剩余6只分别于治疗第1、3、7、14天测量肿瘤体积,计算肿瘤体积抑制率。
1.2.3 检测指标与方法 肿瘤体积及抑瘤率测算,利用数显游标卡尺对肿瘤进行测量。计算各组裸鼠肿瘤体积均值并制作相关生长曲线图:肿瘤体积V=a×b2/2(a为肿瘤的最大直径;b为肿瘤的最短直径);计算观察组抑瘤率:抑瘤率(%)=[(模型组体积-观察组体积)/模型组体积]×100%。
HE染色进行组织病理学分析,将取材后的瘤体迅速置于4%的多聚甲醛溶液中固定12 h,经过常规脱水,石蜡包埋,切片后进行HE染色,于光镜下观察各组肿瘤组织不同放大倍数下的病理改变情况。
蛋白质印迹法对凋亡相关蛋白Bax和Bcl-2进行检测,从超低温冰箱取出肿瘤组织放于冰盒上,剪碎组织后用天平称量30 mg左右,加入适量提前配置好的盛有裂解液的离心管中,冰上裂解30 min,于4 ℃下12 000 r/min离心15 min,收集上清液,BCA测定样品蛋白浓度,之后根据浓度测定结果加入5×Loading Buffer混合后于100 ℃处理5 min,使蛋白充分变性,分装备用;进行SDS-PAGE凝胶电泳;然后用聚偏二氟乙烯膜(PVDF膜)转膜90 min;PBS冲洗后用5%脱脂牛奶封闭2 h;用1%BSA封闭液稀释相应的一抗(Bcl-2 1∶500稀释;Bax 1∶1 000稀释),使PVDF膜浸泡于一抗孵育液中,4 ℃过夜;TBST充分洗涤PVDF膜3次,10 min/次;用封闭液稀释HRP标记二抗(1∶5 000稀释),37 ℃摇床孵育1 h,TBST充分洗涤PVDF膜3次,10 min/次;采用ECL超敏发光液显影成像,拍照。用β-tubulin作为内参同法检测(β-tubulin1∶5 000稀释)。
1.3 统计学方法 采用SPSS 20.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,若数据呈正态分布且方差齐,采用单因素方差分析,组间多重比较采用LSD检验;方差不齐则采用非参数检验统计,各组间差异采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 各组宫颈癌体外移植瘤体积变化情况
2.1.1 各组移植瘤体积估算均值比较
PDT治疗后,3组观察组肿瘤体积在治疗后1~3 d保持不变或略减小,3 d后体积逐渐增大;模型组肿瘤体积则呈现逐渐增大的趋势。各观察组与模型组比较,差异有统计学意义(P<0.05)。见图1。
2.1.2 各组抑瘤率比较
治疗后1~14 d,PDT观察组抑瘤率呈下降趋势。黄芩苷-PDT组和姜黄素-PDT组在治疗1~3 d,抑瘤率呈上升趋势;3~14 d呈下降趋势;黄芩苷-PDT组抑瘤率高于其他2个观察组。治疗1~3 d,黄芩苷-PDT组抑瘤效果明显,抑瘤率上升幅度大于姜黄素-PDT组;而治疗7~14 d,黄芩苷-PDT组抑瘤率虽高于其他2组,但是姜黄素-PDT组抑瘤率下降幅度小于黄芩苷-PDT组。
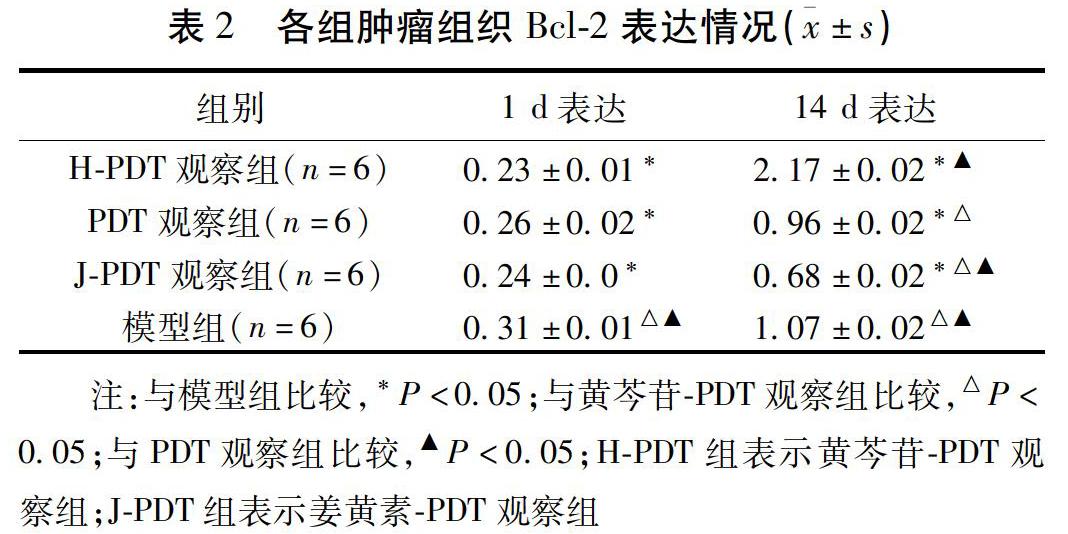
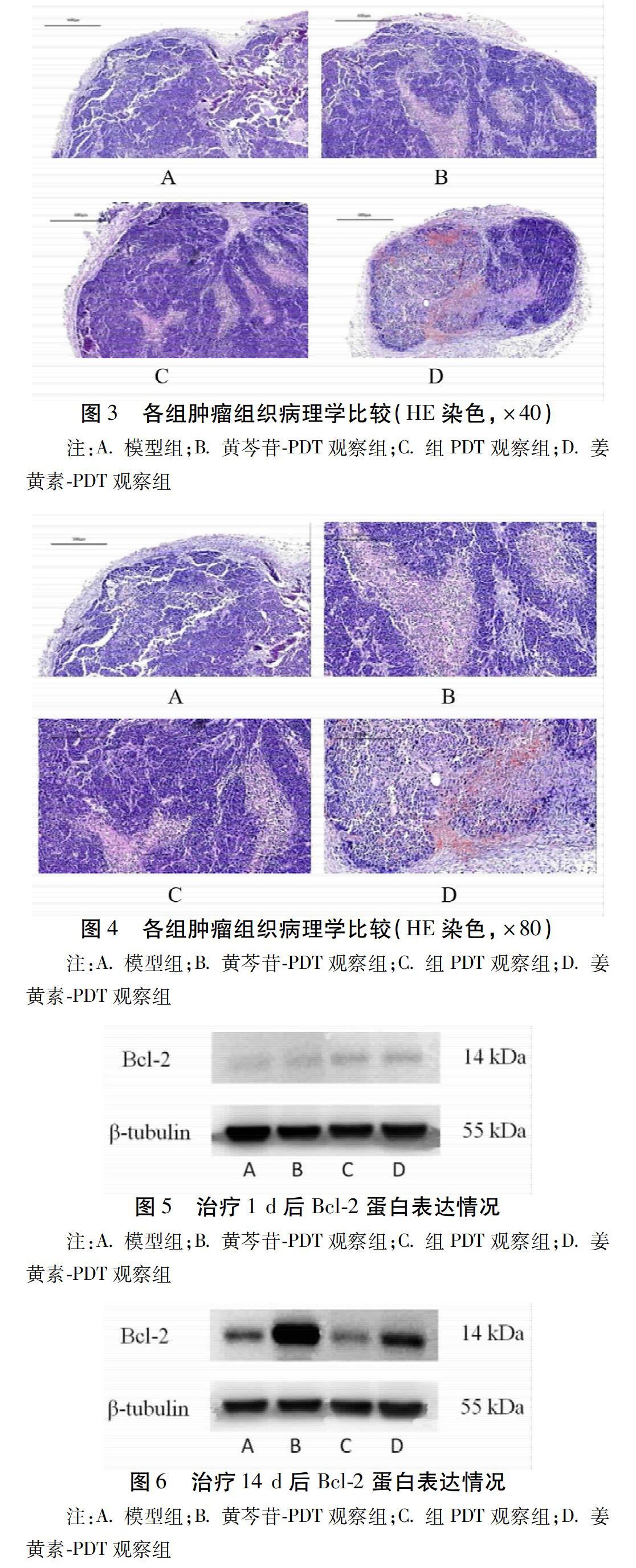
2.2 肿瘤的组织病理学变化
镜下可见:观察组肿瘤组织均小于模型组肿瘤组织,且观察组肿瘤组织坏死面积大于模型组肿瘤组织。黄芩苷-PDT观察组治疗区域肿瘤组织坏死面积大于其余2个观察组;且姜黄素-PDT组肿瘤组织内有出血现象。镜下4×可见模型组模型组肿瘤细胞成分相对单一,呈团巢状排列,细胞大小不等,边界不清,呈圆形或卵圆形,核浆比增大,染色质粗糙,核分裂像常见,偶见坏死。与模型组比较,其余各观察组可见坏死灶,灶内细胞核固缩,胞质嗜酸性变,其他肿瘤组织细胞排列较稀疏,核分裂象较模型组少见,其中以黄芩苷-PDT观察组最为明显,姜黄素-PDT观察组比较明显。见图2~4。
2.3 凋亡相关蛋白的表达情况变化
2.3.1 Bcl-2的表达情况
治疗1 d后,与模型组比较黄芩苷-PDT观察组与PDT观察组表达结果差异有统计学意义(P<0.05);见图5,表2。
治疗14 d后,与模型组比较,其余3组表达结果差异有统计学意义(P<0.05);与黄芩苷-PDT观察组比较,其余3组表达结果差异有统计学意义(P<0.05);与PDT观察组比较,其余3组表达结果差异有统计学意义(P<0.05);见图6,表2。
2.3.2 各组Bax的表达比较
治疗1 d后,与模型组比较黄芩苷-PDT观察组与姜黄素-PDT观察组表达结果差异有统计学意义(P<0.05);与黄芩苷-PDT观察组比较模型组与PDT观察组表达结果差异有统计学意义(P<0.05);与PDT观察组比较黄芩苷-PDT观察组与姜黄素-PDT观察组表达结果差异有统计学意义(P<0.05);结果见图7,表3。
治疗14 d后,与模型组比较黄芩苷-PDT观察组与姜黄素-PDT观察组表达结果差异有统计学意义(P<0.05);与黄芩苷-PDT观察组比较其余3组表达结果差异有统计学意义(P<0.05);与PDT观察组比较黄芩苷-PDT观察组与姜黄素-PDT观察组表达结果差异有统计学意义(P<0.05);结果见图8,表3。
3 讨论
近年来研究表明,目前临床对于宫颈癌的主要治疗手段包括手术治疗、放疗和化疗,这些传统的治疗方法,给患者带来了严重的身体及心理负担,尤其对于年轻女性而言,甚至会影响其生育能力,降低患者后期生命质量[4]。所以寻找创伤性小、不良反应小并且治疗效果好的方法对于提高宫颈癌患者生存率和后期生命质量至关重要,这也是临床研究的热点方向。
光动力疗法是一种无创或微创的新型治疗技术,通过在病患部位局部注射光敏剂,光敏剂经过一段时间后特异性富集在病变组织,之后利用选定的特定波长的光源照射并激发光敏剂产生活性氧,从而导致病变组织细胞发生一系列凋亡、坏死以及过度自噬等过程,最终达到治疗目的[15]。因该疗法具有操作简单,对患者伤害小,治疗后可保护器官结构的完整性以及可重复治疗等优势[10],结合宫颈本身结构的特点,该疗法适用于治疗宫颈癌。
黄芩苷是一种从中药黄芩中提取出的黄酮类化合物,目前国内外对于黄芩苷抗肿瘤作用的研究日渐深入,现已被证实在乳腺癌[16]、卵巢癌[17]、宫颈癌[18-19]等妇科疾病中均有疗效。但关于黄芩苷联合光动力疗法的研究,国内外鲜有报道。黄芩苷可通過促凋亡作用、抑制肿瘤血管新生、逆转抗药性及诱导分化等方面抑制肿瘤的生长[13]。Liang等[20]研究证实黄芩苷有广泛的抗肿瘤作用,并且对于正常的细胞没有明显的不良反应。此外,在杜永峰等[11]和孟晓彩等[12]的研究中发现,黄芩苷有弱感光性但在加入硼砂溶液后,其感光性有所加强。据此,黄芩苷可作为一种新型的高效低毒且符合治疗宫颈癌的优质光敏剂,将其联合PDT来对症治疗宫颈癌具有一定的可行性。本研究发现,黄芩苷联合PDT疗法在治疗前期能够有效抑制肿瘤生长,其效果优于单纯PDT和姜黄素联合PDT疗法。
肿瘤的发生和发展过程较为复杂,相关研究表明,Bcl-2突变在宫颈组织发生癌变的过程中发挥了重要的作用[21]。而促/抑凋亡基因Bax和Bcl-2蛋白表达与细胞凋亡密切相关。Bcl-2是一种抑制凋亡相关的蛋白,它主要通过影响线粒体凋亡途径引发细胞凋亡,而Bax主要通过抑制Bcl-2的生物学活性从而促进凋亡[22]。
本实验研究中发现,治疗1 d后,各观察组与模型组比较,Bcl-2表达均降低;Bax表达均升高。治疗14 d后,PDT观察组与姜黄素-PDT观察组与模型组比较,Bcl-2表达降低;黄芩苷-PDT观察组与姜黄素-PDT观察组与模型组比较,Bax表达升高。这些结果表明黄芩苷介导的PDT疗法对肿瘤可有抑制作用,且作用效果呈时间性,在治疗前期黄芩苷-PDT疗法治疗效果优于其余2个观察组,但是后期效果不佳,且这种抑制作用可能是通过抑制Bcl-2的表达,促进Bax的表达,从而诱发肿瘤细胞凋亡实现的。
综上所述,黄芩苷介导的PDT疗法可以抑制宫颈癌肿瘤组织的生长,其机制可能与下调肿瘤组织Bcl-2的表达,增加Bax的表达从而发挥其抑瘤的作用相关,提示Bcl-2和Bax在宫颈癌的发生、发展过程中起到重要的作用,黄芩苷-PDT治疗可以在前期通过有效抑制Bcl-2表达和促进Bax表达从而发挥抑瘤效果,但是其作用随着时间延长而减弱,可能需要进行多次重复治疗,其过程及最佳作用时效,有待后续实验进一步深入探讨、分析。
参考文献
[1]Zaman MS,Chauhan N,Yallapu MM,et al.Curcumin Nanoformulation for Cervical Cancer Treatment[J].Sci Rep,2016,6:20051.
[2]Koh WJ,Abu-Rustum NR,Bean S,et al.Cervical Cancer,Version 3.2019,NCCN Clinical Practice Guidelines in Oncology[J].J Natl Compr Canc Netw,2019,17(1):64-84.
[3]王临虹,赵更力.中国子宫颈癌综合防控指南[J].中国妇幼健康研究,2018,29(1):1-3.
[4]赵艺,郝淑维,崔澂.宫颈癌的个体化综合化治疗进展[J].医学综述,2017,23(1):76-81.
[5]陈文晖,浦宇.光动力疗法的起源和发展史[J].中国医学文摘:皮肤科学,2015,32(2):109-118,101.
[6]成令忠.现代组织学[M].上海:上海科学技术文献出版社,2003:10.
[7]Pecorelli S,Zigliani L,Odicino F.Revised FIGO staging for carcinoma of the cervix[J].Int J Gynaecol Obstet,2009,105(2):107-108.
[8]卞美璐,刘树范.子宫颈疾病的诊治[M].北京:科学技术文献出版社,2001:271.
[9]Wan MT,Lin JY.Current evidence and applications of photodynamic therapy in dermatology[J].Clin Cosmet Investig Dermatol,2014,7(9):145-163.
[10]Muroya T,Suehiro Y,Umayahara K,et al.Photodynamic therapy(PDT)for early cervical cancer[J].Gan To Kagaku Ryoho,1996,23(1):47-56.
[11]杜永峰,周健,姚秉华.紫外分光光度法测定黄芩中黄芩苷的含量[J].化学分析计量,2008,17(5):43-45.
[12]孟晓彩,秦身钧,魏永巨.黄芩苷-硼砂体系的荧光光谱研究[J].分析化学,2009,37(z1):206.
[13]王婷婷,赵鹏翔,谢飞.黄芩苷的抗肿瘤作用及机制研究进展[J].生物技术进展,2019,9(1):13-20.
[14]牟天龙,潘彦舒,贺桂芳,等.姜黄素介导PDT治疗宫颈癌的疗效及其机制研究[J].世界中西医结合杂志,2015,10(6):764-766.
[15]Shi X,Zhang CY,Gao J,et al.Recent advances in photodynamic therapy for cancer and infectious diseases[J].Wiley Interdiscip Rev Nanomed Nanobiotechnol,2019,11(5):e1560.
[16]戴新军.黄芩苷抗乳腺癌的作用及对肿瘤缺氧微环境影响的实验研究[D].长沙:湖南中医药大学,2015.
[17]阎皓,张恒,刘金东,等.黄芩苷对人卵巢癌细胞株SKOV3、CAOV3增殖侵袭的作用机制研究[J].河北中医,2018,40(2):260-264.
[18]苏佩华.黄芩素—黄芩苷复合物对宫颈癌HeLa细胞凋亡作用的研究[D].秦皇岛:燕山大学,2018.
[19]陈璐,张娟,栾丽平.黄芩苷通过增强自噬介导顺铂对宫颈癌C-33A/cis细胞敏感性的影响[J].中药药理与临床,2018,34(5):44-47.
[20]Liang RR,Zhang S,Qi JA,et al.Preferential inhibition of hepatocellular carcinoma by the flavonoid Baicalein through blocking MEK-ERK signaling[J].Int J Oncol,2012,41(3):969-978.
[21]林韵,陈建国.新辅助化疗对宫颈癌组织CD34和Bcl-2表达影响的研究进展[J].中华实用诊断与治疗杂志,2018,32(12):1240-1242.
[22]Riedl SJ,Salvesen GS.The apoptosome:signalling platform of cell death[J].Nat Rev Mol Cell Biol,2007,8(5):405-413.
(2020-02-01收稿 責任编辑:杨觉雄)
