金花葵花粗黄酮对自然衰老小鼠抗氧化的影响
2020-10-30王元梁泽华崔明勋
王元 梁泽华 崔明勋


摘 要:为了探究金花葵花粗黄酮对动物体衰老的生理影响,采用有机回流的方法对金花葵干花进行分级萃取,选取黄酮含量较高的乙酸乙酯提取层和正丁醇提取层作为药物,研究其对自然衰老小鼠抗氧化的影响。将50只(210±5)d的昆明小鼠随机分为5组,每组10只,包括乙酸乙酯提取物高、低剂量组,正丁醇提取物高、低剂量组、衰老对照组,并通过灌胃进行给药处理。其中,乙酸乙酯提取物高、低剂量组灌胃给药剂量分别为5mg/kg、2mg/kg,正丁醇提取物高、低剂量组给药剂量分别为30mg/kg、15mg/kg,另将6只35d的昆明小鼠作为年轻对照组,衰老对照组灌胃同体积的蒸馏水。给药30d后处死采样,测定小鼠的红细胞膜唾液酸含量(SA)、脑脂褐素含量,肝、肾的超氧化物歧化酶活力(SOD)、丙二醛含量(MDA)。结果表明:与衰老对照组相比,乙酸乙酯提取物组的红细胞膜SA含量水平升高(P<0.01,P<0.05)、肝、肾SOD活力提高(P<0.01)、脑脂褐素含量水平降低(P<0.01)、肝和肾MDA含量水平降低(P<0.01或P<0.05),而正丁醇层提取物对小鼠均无明显的效果。说明金花葵花粗黄酮提取物中乙酸乙酯层提取物使老龄小鼠抗氧化体系活力提高,并且其脂质过氧化物有所减少,具有一定的抗氧化作用。
关键词:金花葵黄酮;衰老;唾液酸;超氧化物歧化酶;丙二醛;脂褐素
中图分類号 R285.5文献标识码 A文章编号 1007-7731(2020)19-0025-04
Effect of Flavonoid Extracts from Flowers of Hibiscus Manihot in Aging Mice
WANG Yuan# LIANG Zehua# et al.
(College of Agronomy, Yanbian University, Yanji 133002, China)
Abstract:To study effect of flavonoid extracts from flowers of hibiscus manihot on Aging mice,in this paper,extracting the flowers of hibiscus manihot by organic solvents,and choosing the ethyl acetate and butyl alcohol extracts as drops,which contents the higher levels of flavonoid,and the aging KM mice were chosen as test object.7 monthly healthy KM mice were divided into 5 group:normal aging group,ethyl acetate extract low and high dosage group,butyl alcohol extract low and high dosage group,with 10 mice in each group,and 6 young mice were chosen as the young contral group ;the mice in each group were administrated by gavage with ethyl acetate extract low and high dosage group(2mg/kg,5mg/kg),and butyl alcohol extract low and high dosage group(15mg/kg,30mg/kg ),and the aging contral group were gavaged with water.30 days later,the mice were killed to detect the content of sialic acid (SA)on red cell,lipofuscin of brain tissues,and the content of malondialdehyde(MDA)and the activity of superoxide dismutase(SOD )in liver and kidney.Compared with the control groups ,the ethyl acetate extracts can significantly increase the content of SA(P<0.01 or P<0.05),and in the liver and kidney,the distinction of SOD activity in the ethyl acetate extracts groups bears significance in statistics(P<0.01),while the levels of MDA and lipofuscins deposition are lower(P<0.01 or P<0.05).But the butyl alcohol extracts has no effects in aging mice,showing that the ethyl acetate extracts can delay the senility on mice by enhancing antioxidation and reduce the contents of lipid peroxide.
Key words:Hibiscus Manihot Flavonoid; Aging; Sialic acid(SA); Superoxide dismutase(SOD); Malondialdehyde(MDA); Lipofuscin
金花葵(Hibiscus manihot L.)为一年生草本锦葵科秋葵属植物,是一种濒临绝种植物,又名菜芙蓉或野芙蓉、黏干或山榆皮,在食用、药用、保健方面的价值极高。近年来,许多学者对金花葵进行了各方面的研究,表明其主要活性成分为黄酮类物质,其中金花葵干花总黄酮含量最高[1-2],比银杏、大豆等高数十倍,是植物界天然黄酮含量较高的品种[3]。黄酮类物质近年来受到了广泛的关注,有许多研究表明其良好的抗氧化能力。例如,秦晶晶等[4]对菟丝子中提取黄酮,发现黄酮在体外实验中对1,1-二苯基-2-三硝基苯肼(DPPH)自由基,羟自由基和超氧阴离子又具有一定的清除作用;丁婷婷等[5]对刺玫叶总黄酮进行研究,通过对衰老模型昆明鼠不同给药剂量的黄酮处理,检测血清中细胞因子及各组织脏器抗氧化酶的变化,得出刺玫叶总黄酮具有延缓衰老的作用。
目前,以自然衰老小鼠为对象,进行金花葵粗黄酮体内试验,观察肝肾等脏器的研究却鲜有报道。为此,本研究通过对自然衰老小鼠进行不同剂量金花葵粗黄酮灌胃给药,观测小鼠肝、肾组织中超氧化物歧化酶活力(SOD)、丙二醛(MDA)、红细胞唾液酸(SA)以及脑脂褐素含量的变化,探讨金花葵粗黄酮抗氧化损伤、抗衰老效果,为金花葵黄酮抗衰老功效的深入研究提供理论依据。
1 材料与方法
1.1 材料与仪器 金花葵干花:采于延边大学农学院;56只昆明小鼠,其中50只为平均日龄在(210±5)d健康雌性昆明小鼠,体重为(41±4)g,另外6只为日龄为35d健康的昆明小鼠,是延边大学生化实验室近交繁殖系,标准饲料饲养,室温20~25℃。
无水乙醇;石油醚;氯仿;乙酸乙酯;正戊醇;甲醇;正丁醇;乙酸;浓盐酸;氢氧化钠;硝酸铝;氯化钠;亚硝酸钠;联苯三酚;FeCl3;3,5-二羟基甲苯;硫代巴比妥酸;SDS(十二烷基硫酸钠);硫酸奎宁;考马斯亮蓝G-250(分析纯):国药集团药业股份有限公司。
722S紫外可见分光光度计:上海精密科学仪器有限公司;FA1004A电子分析天平:上海精天电子仪器有限公司;旋转蒸发器RE-5299:巩义市英峪高科仪器厂;SHB-Ⅲ循环水式多用真空泵:郑州长城科工贸有限公司;DFY-5/10低温冷却液反应浴:巩义市予华仪器有限责任公司;超纯水系统:Millipore公司;CT15RT台式高速冷冻离心机:中国天美科学仪器有限公司;DK-8D型电热恒温水槽:上海精宏实验设备有限公司;FD-1D-50冷冻干燥箱:北京博医康实验仪器有限公司。
1.2 方法
1.2.1 金花葵干花粗黄酮的提取 干花经过60℃低温烘干6h,粉碎、过60目筛,按照1∶35料液比加入70%乙醇,抽提3次,得到金花葵乙醇粗提物,用石油醚进行脱脂,蒸干有机溶剂后冻干,取上述冻干物,分别用氯仿、乙酸乙酯、正丁醇进行充分萃取,旋转蒸发浓缩后冻干,得到不同萃取层的金花葵干花粗黄酮,用标准曲线法测定其黄酮含量[6]。在金花葵干花粗黄酮中,乙酸乙酯层干燥提取物黄酮含量约为63.73%,正丁醇层约为46.49%。
1.2.2 试验分组及给药处理 50只(210±5)d的健康雌性昆明小鼠,按随机取样的方式分成5组,每组10只,分别为:自然衰老对照组、乙酸乙酯提取物高剂量组、乙酸乙酯提取物低剂量组、正丁醇提取物高剂量组和正丁醇提取物低剂量组,另有6只35d的昆明小鼠作年轻对照组。适应环境饲养7d后,年轻和衰老对照组灌胃等体积的双蒸水,乙酸乙酯提取物高、低剂量组分别按照5mg/(kg·d)、2mg/(kg·d)的剂量灌胃乙酸乙酯提取物,正丁醇提取物高、低剂量组分别按照30mg/(kg·d)、15mg/(kg·d)的剂量灌胃正丁醇提取物。另取6只平均日龄为(35±1)d的小鼠作为年轻对照组。给药组连续灌胃30d,各组小鼠自由进食和水,每7d记录1次体重。
1.2.3 采血取样及指标测定 灌胃30d后,摘眼球取血,低温保存于含有抗凝剂的离心管中。脱颈处死小鼠后,低温条件下,取肝、肾组织约0.1g左右,加入1mL生理盐水用高速匀浆器以15000r/min的条件下研磨制成10%组织匀浆液,离心后避开脂肪层,取清液进行指标测定。
1.2.3.1 唾液酸含量 Bialsche比色法:Bialsche试剂组成为0.1g3.5-二羟基甲苯;40.7mL浓盐酸(12mol);1mL 1%FeCl3溶液;8.3mL双蒸水;血影蛋白溶液的制备:小鼠眼球采血于抗凝管,加入1mL预冷生理盐水,于4℃下3000r/min离心10min,洗涤3次。加入0.05mol/L pH=8.4的磷酸盐缓冲液1mL,低温溶胀1h,加入磷酸盐缓冲液,于4℃下3000r/min离心20min,吸弃上清液,重复洗涤3次。加入300μL磷酸盐缓冲液,制成血影蛋白溶液。取100μL血影蛋白溶液于1.5mL离心管中,加入生理盐水、Bialsche试剂各100μL,震荡混匀,沸水浴12min,冰浴3min,加入正戊醇600μL,摇匀,5000r/min,离心4min,取上清液,于569nm波长下,以空白管调零,测定吸光度值[7]。
1.2.3.2 脂褐素[6] 取一半脑组织,称重记录,加入1.5mL氯仿-甲醇溶液(2∶1)研磨,然后8 000r/min离心10min,取上清液,以360nm波长为激发波长,在420nm波長下测定上清液吸光度值。
1.2.3.3 SOD活力 联苯三酚自氧化法[8]:将0.1molpH=8.3的磷酸盐缓冲液加热至29℃,然后放在电热毯上进行保温。向比色杯中加入2.95mL的缓冲液,再加入适量的联苯三酚,快速盖上玻璃纸,开始上下颠倒混匀的同时按下30s的计时器。30s的时候读取340nm波长下的吸光度。再过30s后再次读数,共计6次。计算间隔1min的OD差值的平均值A0,调整联苯三酚的使用量A0使接近0.07,记录联苯三酚的量为BmL。向比色杯中加入2.95mL的缓冲液和0.02mL脏器匀浆上清液和联苯三酚BmL,记录340nm波长下的吸光度,计算间隔1min的OD差值的平均值为A1。SOD活力值计算公式如下:
SOD活力值(U/mL):(A0-A1)/A0*2*(2.95+B+0.02)/0.02
1.2.3.4 MDA含量 硫代巴比妥酸法[9]:取0.06mL脏器组织匀浆上清液,先加入0.03mL8.1%SDS溶液和0.2mL DW振荡10min,再加0.3mL的0.2mol/L的乙酸和0.3mL 1%TBA,混匀后放入100℃水浴20min,水浴结束后8000r/min离心10min,然后以空白管调零在532nm处测吸光度。
1.2.3.5 蛋白质含量 考马斯亮蓝法[10]:取适量标准血清蛋白溶液加1mL考马斯亮蓝溶液测595nm波长的吸光度值做成标准曲线,另取等量的脏器组织匀浆上清液重复上述操作测595nm波长的吸光度值,以标准曲线来计算脏器组织匀浆上清液中的单位蛋白含量。
1.3 数据处理 经SPSS 22.0统计软件以及Excel对试验所得数据统计,各指标以x±s表示,对各组进行t检验比较,P<0.05为差异显著,P<0.01为差异极显著。
2 结果与分析
2.1 各组小鼠脏器指数 由表1可知,肝、肾、脑、心、脾的脏器指数均为年轻对照组最大。与年轻对照组相比,衰老对照组肝、脑、心的脏器指数出现极显著地偏低(P<0.01)。与衰老对照组相比,各给药组均未出现统计学上的显著性差异。
2.2 各组小鼠红细胞膜中SA和脑脂褐素含量 由表2可知,SA含量中,与年轻对照组相比,衰老对照组SA含量有偏低趋势,但未出现显著性差异。与衰老对照组相比较,乙酸乙酯提取物高、低剂量组红细胞SA含量均显著升高(P<0.01或P<0.05),正丁醇提取物高、低剂量组SA含量略未出现显著性差异。脑脂褐素含量结果:与年轻对照组相比,衰老对照组脑脂褐素含量显著性升高(P<0.05)。与衰老对照组相比较,乙酸乙酯提取物高、低剂量组脑脂褐素含量极显著降低(P<0.01),且高剂量组低于低剂量组,正丁醇提取物高、低剂量组脑脂褐素含量未见明显变化。
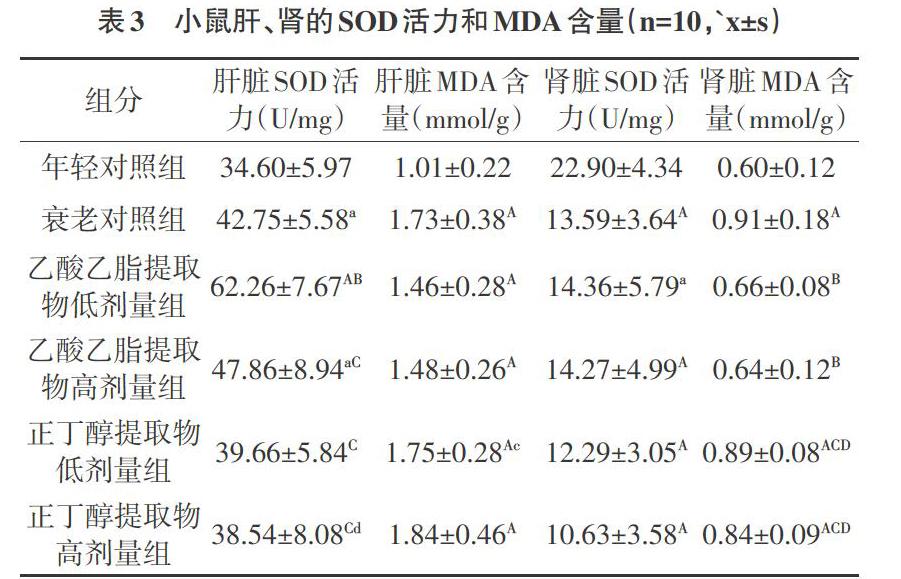
2.3 各组小鼠肝、肾的SOD、MDA变化 由表3可知,在肝脏的指标中,与年轻对照组相比,衰老对照组SOD活力显著性升高(P<0.05),MDA均极显著升高(P<0.01)。与衰老对照组相比,乙酸乙酯提取物低剂量组SOD活力极显著升高(P<0.01),MDA含量降低,但未出现显著性差异,乙酸乙酯提取物高剂量组SOD活力未见明显变化,MDA降低,但未出现显著性差异。正丁醇提取物高、低剂量组SOD、MDA未见明显变化。在肾脏指标中:与年轻对照组相比,衰老对照组SOD活力显著性降低(P<0.01),MDA极显著性升高(P<0.01),与衰老对照组相比,各给药组SOD活力未见显著性差异,乙酸乙酯提取物高、低剂量组MDA含量极显著降低(P<0.01)。
3 结论与讨论
黄酮类化合物是一类重要的天然有机化合物,广泛存在于各类植物中,因其繁多的种类和复杂而独特的化学结构造成了它对哺乳动物和其他类别的细胞具有各种各样的生理、生化作用[11]。黄酮类化合物是多种中草药的有效活性成分,如黄芩、银杏、沙棘等,而且在其他植物中均有发现。而金花葵其中主要成分是黄酮类化合物,许多药理研究证明其药用价值[2-3]。仇燕等[12]应用菜芙蓉(金花葵)花80%乙醇提取物,进行体外抗氧化实验,证明其对DPPH、·OH、[O-2]·自由基的清除能力高于VC,且具有随总黄酮质量浓度增加而上升的趋势。雷波等[13],对SD大鼠进行不同剂量金花葵总黄酮灌胃给药,得出金花葵总黄酮能够提高大鼠皮肤中SOD活性,提高谷胱甘肽(GSH)、羟脯氨酸(HYP)含量,可能具有延缓皮肤衰老的功效。因此,以金花葵黄酮为研究对象,探究其抗衰老、抗氧化功效的研究非常必要。本研究用不同萃取层的金花葵黄酮灌胃给自然衰老的老龄昆明鼠,观察小鼠体内各生化指标情况来判断小鼠的抗氧化情况,进而判断其效果。
衰老的自由基学说的理论认为,机体随着年龄增长的退行性变化是由于自由基物质过剩造成氧化损伤的结果。机体自身有一整套平衡自由基体系,如果这体系无法维持自由基平衡,就会导致机体在内外环境因素和抗氧化酶活力下降的情况下使自由基过剩进而造成一定程度的细胞毒性和不可逆损伤[14]。机体内的氧化代谢过程会产生对细胞有毒副作用的氧自由基,也叫活性氧(ROS),它们能够通过一系列有害的生化反应来破坏细胞体。而在对应的防御体系中,SOD发挥了重要作用。SOD是一种抗氧化金属酶,是生物体中抗氧化酶体系的重要成员,能通过歧化反应消除机体内的[O-2]·,保护机体并消除氧化损伤,减缓衰老[15]。MDA是生物体内由于自由基与脂质发生过氧化作用而生成的产物,会导致蛋白质等大分子发生交联,还能加剧膜损伤引起细胞衰老[16]。脂褐素是溶酶体不能消化的物质,是由一些电子密度不等的小泡、脂滴等沉积于溶酶体后形成的残余体,随年龄增长在体内蓄积,是衰老的重要指标之一。脑脂褐素含量反映脑组织脂质过氧化强度和速度,从而反映出衰老程度,其值越高衰老程度越高[17]。SA与细胞代谢旺盛程度密切相关,具有促进细胞转移,抑制细胞凋亡的作用,红细胞膜SA降低,会引起膜结构异常,细胞破裂,数量减少,其中红细胞膜表面SA含量随细胞老化逐渐下降[18]。
金花葵花乙酸乙酯提取层黄酮能有效提高红细胞膜SA含量,肝、腎SOD活性,降低脑脂褐素含量,降低肝、肾MDA含量,具有较好的抗氧化、抗衰老效果,但金花葵正丁醇提取层黄酮上述效果均不明显。在本试验中,脏器指数这项指标显示,年轻小鼠各脏器指数均较衰老组偏大,该现象可能由于随年龄增长,器官产生了退行性变化,或由于年老小鼠基础代谢率下降,能量囤积造成脏器指数相对减小现象。指标测定结果表明,金花葵花乙酸乙酯提取层黄酮的抗氧化效果未见明显剂量效应,最适给药剂量有待进一步研究。此外,在肝脏SOD活性指标中,衰老组活性高于年轻组,发生这种情况的原因,是否由于肝脏作为解毒器官,年轻小鼠体内氧自由基含量少、其他抗氧化酶活性也很强,体内积累有害物质相对少,对SOD的需求不如衰老小鼠高。关于以上的问题还有待进一步研究探讨。
参考文献
[1]刘琦,辛秀兰,兰蓉,等.金花葵花中总黄酮提取工艺的研究[J].食品研究與开发,2011,32(7):19-21.
[2]卢丹,贾瑞波.中药金花葵的研究进展[J].中国药物评价,2015(2):90-92.
[3]梁泽华,崔明勋.金花葵黄酮类化合物提取工艺综述[J].安徽农学通报,2019,25(8):18-19,56.
[4]秦晶晶,钱慧琴,魏婧,等.菟丝子总黄酮提取工艺及其抗氧化活性[J].食品工业科技,2019,40(23):151-157.
[5]丁婷婷,柳佳莹,沈明浩.山刺玫叶总黄酮的抗衰老作用研究[J].西北农林科技大学学报:自然科学版,2019,47(12):140-146.
[6]张路,于慧敏,杜凤沛,等.金花葵中总黄酮的分离提取及含量测定[J].吉林师范大学学报:自然科学版,2015(36):108.
[7]李海飞,崔美花,姜成哲,等.MS活性糖对自然衰老小鼠的唾液酸、脂褐素及抗氧化的影响[J].延边大学学报:自然科学版,2016,42(04):321-324.
[8]李海飞.MS活性糖对小鼠抗氧化能力的影响[D].延吉:延边大学,2019.
[9]向荣,王鼎年.过氧化脂质硫代巴比妥酸分光光度法的改进[J].生物化学与生物物理进展,1990(03):241-242.
[10]李留安,袁学军.动物生物化学实验指导[M].北京:清华大学出版社,2013:43.
[11]延玺,刘会青,邹永青,等.黄酮类化合物生理活性及合成研究进展[J].有机化学,2008,28(9):1534-1544.
[12]仇燕,宋建军,王少杰.菜芙蓉花乙醇提取物抗氧化性及抑制Hela细胞生长的研究[J].食品科学,2011,32(19):209-213.
[13]雷波,刘长征.金花葵总黄酮对老龄大鼠皮肤中HYP,GSH及SOD的影响[J].中国皮肤性病学杂志,2011,25(02):110-111.
[14]SaltmanP.Oxidativestress:a radical view[J].Semi-nars inHematology,1989,26:249.
[15]董亮,何永志,王远亮,等.超氧化物歧化酶(SOD)的应用研究进展[J].中国农业科技导报,2013(5):53-58.
[16]刘洋.不同运动训练强度对小鼠血清MDA含量和SOD活性的影响[J].黑龙江畜牧兽医,2016(12):231-233.
[17]冯福奎.健康成人唾液脂褐素增龄性变化的研究[D].天津:南开大学,2015.
[18]牛雯颖,王鸣慧,袁良杰,等.补阳还五汤对老龄大鼠红细胞膜组分的影响[J].中国实验方剂学杂志,2011,17(2):125-128.
(责编:张宏民)
