早期停育胚胎的滋养层细胞相关基因与特征分析
2020-10-29张悦冯颖马芳
张悦,冯颖,马芳,3
早期停育胚胎的滋养层细胞相关基因与特征分析
张悦1,冯颖2,马芳1,3
1. 四川大学华西第二医院教育部“妇儿疾病与出生缺陷”重点实验室,成都 610041 2. 四川大学华西基础医学与法医学院,成都 610041 3. 四川大学华西第二医院妇产科,成都 610041
滋养层细胞对维持正常胚胎植入、生长发育有重要作用。研究停育胚胎的滋养层细胞的基因表达差异有助于了解胚胎发育停止或不良妊娠结局的发生发展机制。本研究通过对26例正常妊娠、胚胎停育妇女的绒毛组织进行全转录组测序和初步生物信息学分析,发现胚胎停育组存在436个差异基因,其中406个mRNA为显著上调基因,32个mRNA为显著下调基因。基因富集分析显示这些基因显著富集于免疫相关功能、细胞间黏附等方面,如淋巴细胞激活、髓系细胞激活、细胞外基质及胶原连接等,其潜在调控通路富集到补体及凝血级联反应和细胞外基质降解等条目。此外,本研究利用WGCNA共表达分析得到和差异基因存在共表达关系的lncRNA。根据模块功能不同,绘制了两个网络图,可得4个关键基因,分别为和。本研究得到的这些差异基因可作为对胚胎停育具有潜在影响的关键分子,所富集到的条目可为深入了解胚胎发育停止或不良妊娠结局的病因及机制提供理论依据及方向。
滋养层细胞;RNA测序;富集分析;基因特征
早期绒毛组织的细胞构成主要指滋养层细胞(trophoblast)[1]。根据细胞功能及形态的特点,滋养层细胞可分为细胞滋养层、合体滋养层和绒毛外滋养层细胞。其中,细胞滋养层分化为合体滋养层参与营养、分泌、代谢等功能[2],而绒毛外滋养层细胞主要参与迁移、侵袭作用入侵子宫内膜及血管,建立母胎循环及启动血管重塑[3]。绒毛滋养层细胞作为直接和母体子宫内膜接触的细胞,目前认为对维持胚胎正常发育有3大功能:侵袭迁移功能、内分泌功能(包括自分泌及旁分泌)及免疫调节功能。绒毛外滋养层细胞通过分泌黏附因子(整合素、钙黏素、选择素及免疫球蛋白超家族[4])对子宫内膜上皮细胞进行识别及黏附,并通过分泌水解酶(基质金属蛋白酶、纤维蛋白酶等)降解植入部位的细胞外基质进行迁移、浸润,以完成正常的胚胎植入。其中,整合素家族和子宫内膜容受性密切相关,整合素αvβ3表达不足会降低子宫内膜容受性,导致胚胎着床能力低下,引起流产或胚胎发育迟滞[5]。而过高的水解酶会导致滋养层细胞过度浸润,引起妊娠期高血压、侵入性胎盘疾病等病理妊娠[6]。滋养层细胞还通过分泌细胞因子(如表皮生长因子EGF[7]、转化生长因子TGF[8]及集落刺激因子CSF-1[9]等)调节自身增殖分化、能量代谢及侵袭功能等。其中,EGF表达异常可能造成滋养层细胞侵袭不足、胎盘血管重铸障碍,最终引起流产[7]。TGF的表达不足影响滋养层细胞分化,造成胎盘发育不良[8]。此外,滋养层细胞可分泌激素(人绒毛膜促性腺激素hCG、孕酮等)维持早期胚胎发育及妊娠。hCG能维持及促进母体卵巢分泌雌、孕激素,并作为早孕时判断胚胎发育停止的指标之一。因此,绒毛滋养层细胞对胚胎植入、发育及胎盘生长、妊娠结局等均有重要影响,而绒毛滋养层细胞的异常形态及功能障碍往往提示胚胎停育或不良妊娠结局。据报道[9],普通光学显微镜下观察可发现停育胚胎的绒毛组织形态异常,出现绒毛间质水肿,合体滋养层核固缩等病理改变。经凋亡小体检测发现,停育胚胎的绒毛滋养层细胞中细胞凋亡数目明显增多[10]。考虑到目前胚胎停育的病因复杂,且部分患者未能找到病因,深入研究异常滋养层细胞变化能在一定程度上对胚胎停育及不良妊娠结局做出解释。本研究借助全转录组测序技术,对停育胚胎的绒毛组织进行大规模的基因筛选及挖掘,寻找异常变化的基因,预测其变化对滋养层细胞生物学功能的潜在影响,为临床上不明原因性胚胎停育的病因及分子生物学机制做出一定解释。
1 材料与方法
1.1 样本收集及制备
26例患者的绒毛组织均来自华西第二医院门诊手术室,其中10例用于转录组测序,其中5例为无生育要求进行人工流产的患者(对照组),5例患者为经B超检测确诊胚胎停育进行清宫术的患者(胚胎停育组)。剩余16例用于验证测序结果,其中9例为无生育要求进行人工流产的患者(对照组),7例患者为经B超检测确诊胚胎停育进行清宫术的患者(胚胎停育组)。两组别中对照组患者平均年龄29.2岁,孕周46.4 d,胚胎停育组患者平均年龄30.6岁,孕周60.2 d,患者临床信息(参与转录组测序的临床样本)见表1。患者术后的绒毛组织立即置于4℃冰盒中防止RNA降解。加入10%中性福尔马林固定12 h,依次通过50%酒精、70%酒精梯度脱水,进行石蜡包埋。所有的总RNA提取、逆转录、扩增、文库构建由南京极光基因科技有限公司完成。本研究通过了四川大学华西第二医院伦理委员会的审查,参与研究的所有患者均签署了知情同意书。
1.1 样本收集及测序
以Trizol法提取总RNA,每个样本取3 μg的总RNA作为起始量构建文库,使用试剂盒Ribo-ZeroTMGoldKits (北京New England Biolabs公司)去除样品中的rRNA,并在两端添加测序引物结合位点,在Illumina HiSeq2000平台上进行测序。测序结束后,通过去除低质量序列,去接头污染,去除rRNA后得到高质量序列(clean reads),后续分析基于高质量序列。采取HiSAT2将过滤后的RNA-seq数据同人基因组(hg19)进行比对。
1.2 差异mRNA的筛选
采用FPKM (fragments per kilobase per millon mapped fragments)定量估计基因的总表达量,采用R包ggplot2对总基因数绘制箱式图进行比较。采用DEseq进行差异表达分析,定义值≤0.05或者|log2ratio|≥1的基因为差异mRNA。采用R包ggplot2对差异mRNA绘制火山图,采用R包pheatmap对差异mRNA绘制热图。
1.3 差异mRNA的注释及富集分析
采用omicshare在线平台(https://www.omicshare. com/tools/home/soft/getsoft.html)对筛选出的基因进行了GO基因功能(gene ontology, GO)和KEGG通路(Kyoto encyclopedia of genes and genomes)的富集分析,以FDR<0.05作为显著性的阈值。
1.4 加权共表达网络分析WGCNA筛选核心lncRNA
使用R包WGCNA构建加权基因共表达网络并进行模块划分[11]。首先准备基因矩阵,将差异mRNA按差异倍数(fold change, FC)排序,选择前20个差异mRNA及所有lncRNA纳入分析。同时,剔除了平均表达量低于0.5的低质量RNA,并利用函数hclust进行聚类,剔除了离群样本。采用pick soft threshold计算权重值,采用power=9,使用blockwiseModules构建无尺度网络[12],对基因进行模块分析。每个模块的最低基因容量为50,利用函数plot dendro and colors绘制树状图并对每个模块进行颜色可视化。最后,确定了差异mRNA所在的两个模块作为目标模块,进行后续分析。

表1 患者临床信息(参与转录组测序的临床样本)
−:因患者未进行此项检查,数据缺失。
1.5 差异mRNA及lncRNA共表达网络的构建
选择WGCNA中富集到的两个模块,根据关联强度(weight)和关联数(edge)筛选最有可能和差异mRNA互作的lncRNA。lncRNA筛选标准为weight值>0.6且和差异mRNA至少存在一条直接连接。使用cytoscape软件绘制网络图。
1.6 差异表达mRNAs和lncRNAs实时荧光定量PCR验证
为了验证测序结果的可靠性,选取了10个mRNAs (包括后续分析所得模块中的核心mRNA,和)和4个lncRNA进行实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)验证。纳排标准与前期测序的样本一致,能有效保证实验结果的可靠性。根据Ensemble (http:// asia.ensembl.org/index.html)提供的序列,使用在线引物设计网站Primer3Plus (http://www.primer3plus.com/ cgi-bin/dev/primer3plus.cgi)设计引物,并通过BLAST (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM= blastn&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome)进行引物特异性验证。以Trizol法提取总RNA,使用逆转录试剂盒(大连TaKaRa公司)反转录为cDNA。以此cDNA为模板进行实时荧光定量PCR (美国Thermo Fisher公司),引物序列见表2。以GAPDH作为内参基因,使用2–ΔΔCt法计算两组中差异表达mRNAs和lncRNAs的相对表达量。
1.7 统计学方法
采用R语言(3.6.1)进行算法分析及可视化图形。患者的临床信息采用描述性统计,两组别间所有mRNA采用独立样本检验,所有数据分析采用双侧检验,以≤0.05表示差异有统计学意义。
2 结果与分析
2.1 正常与胚胎停育组绒毛组织存在436个差异mRNA、41个差异lncRNA
经高通量测序、数据过滤后,10例绒毛样本的基因总体表达值(图1A),log2(FPKM+1)值集中于2~3,说明各样本间基因数均一,测序质量良好,具有良好的可比性。经过差异表达分析后,发现有436个mRNA在两组间具有统计学差异,胚胎停育组相较于正常对照有406个mRNA显著上调,32个mRNA显著下调(图1B)。此外,发现41个lncRNA在两组间具有统计学差异,胚胎停育组相较于正常对照有28个lncRNA显著上调,13个lncRNA显著下调(图1C)。对差异mRNA及lncRNA进行表达聚类分析,从蓝到黄表示表达水平从低到高,发现各组均可形成独立的簇,说明两组别间生物学重复较好。
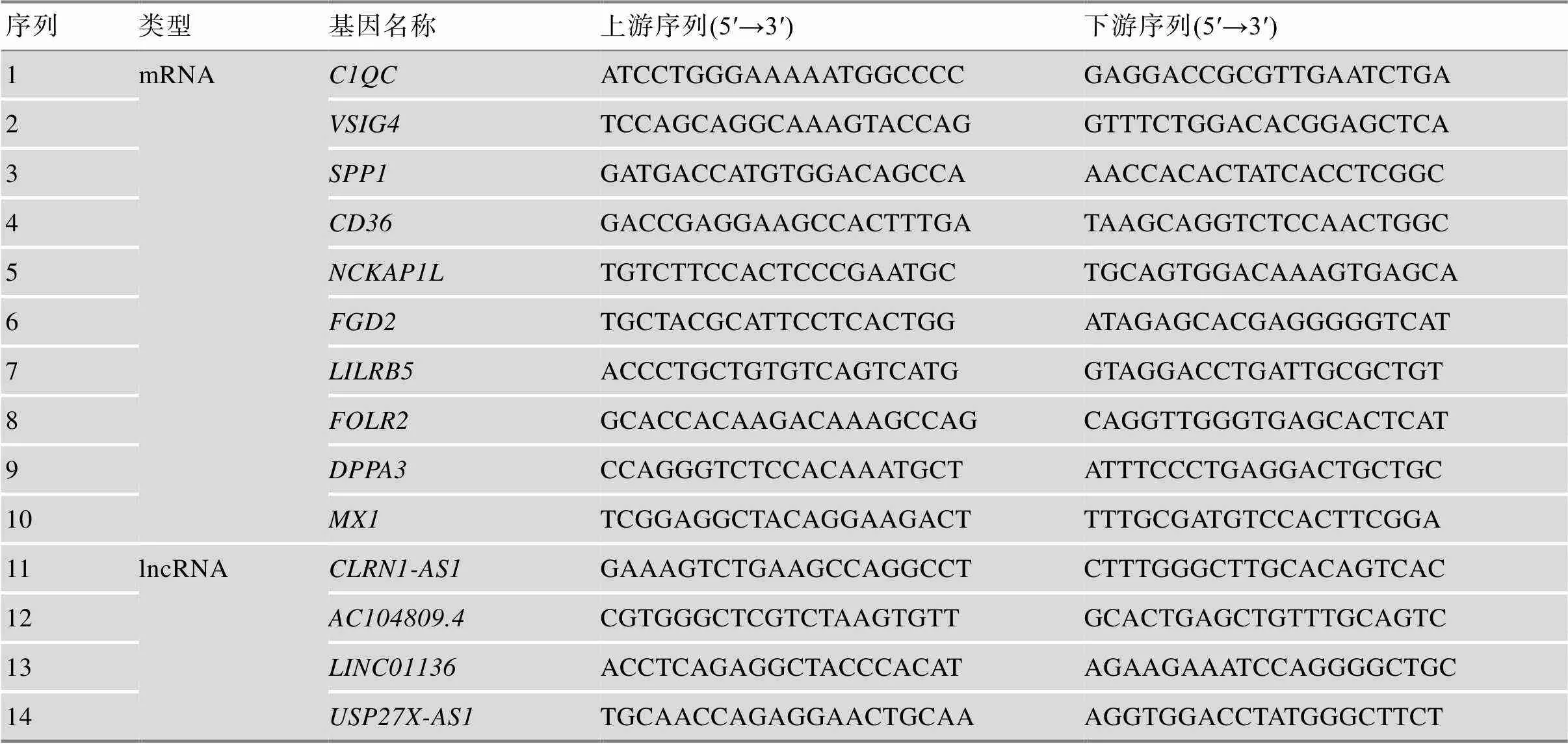
表2 实时荧光定量PCR引物序列表
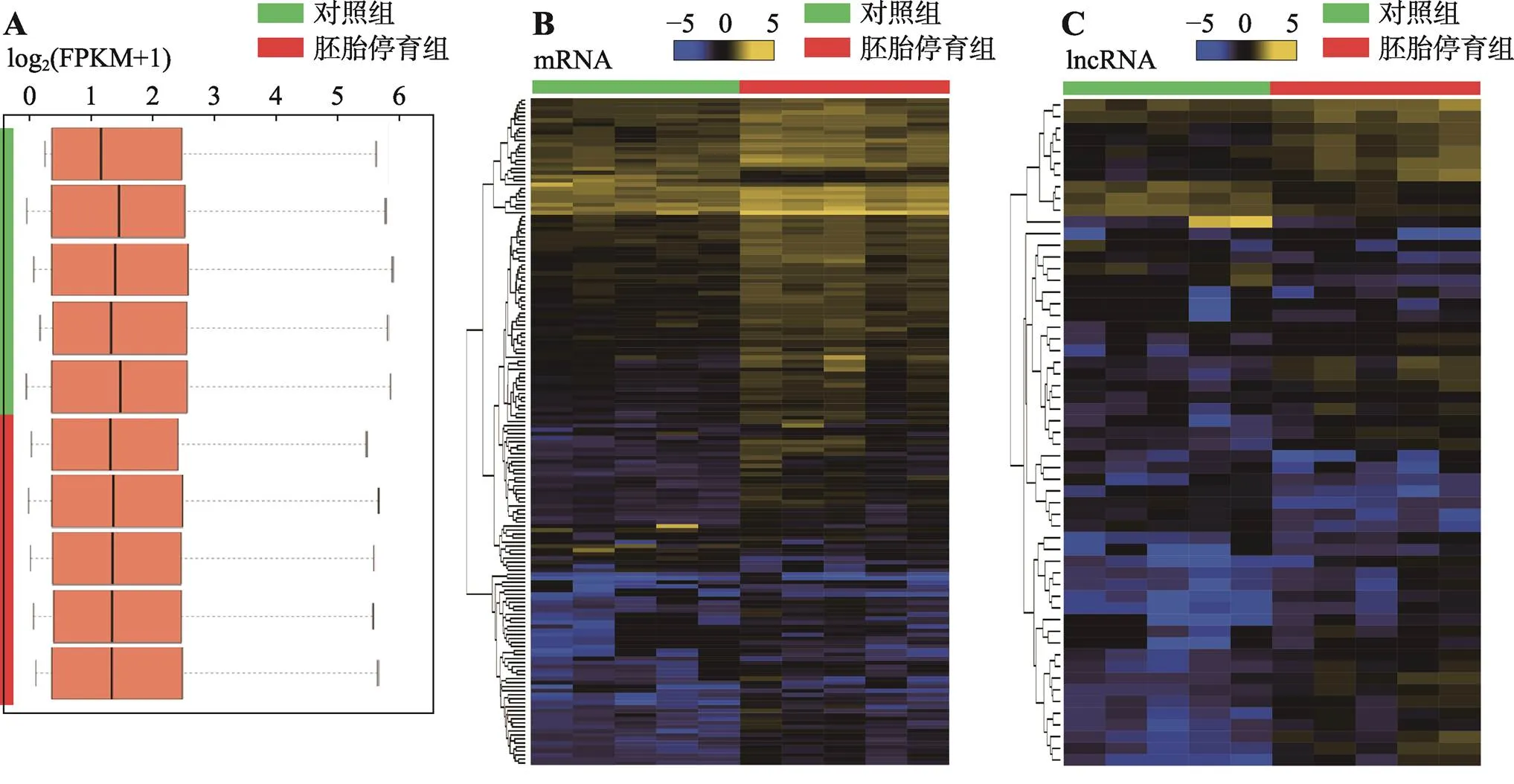
图1 差异基因的表达情况
A:10例样本的基因总体表达量(箱式图);B:两组别的差异mRNA分析(热图);C:两组别的差异lncRNA分析(热图)。
2.2 代表性差异mRNA及lncRNA的qRT-PCR验证结果与转录组结果一致
为了确定测序结果的正确性,分别选择了10个mRNA (包括后续分析所得模块中的核心mRNA,和)和4个lncRNA进行实时荧光定量PCR (图2)。图2A、B结果是通过转录组测序所得的差异mRNA和lncRNA相对表达量。在胚胎停育组中,基因的mRNA水平显著高于对照组,基因的mRNA水平显著低于对照组。对于lncRNA而言,CLRN1- AS1、AC104809.4、LINC01136、USP27X-AS1的水平显著高于对照组。图2 C、D结果是通过实时荧光定量PCR所得的差异mRNA和lncRNA相对表达量。在胚胎停育组中,基因的mRNA水平显著高于对照组,基因的mRNA水平显著低于对照组。对于lncRNA而言,CLRN1- AS1、AC104809.4、LINC01136、USP27X-AS1的水平显著高于对照组。此结果与转录组测序结果相符合。为了更为直观地比较两种方法所得结果的一致性,计算了两组间的相对表达比值(胚胎停育组相对于对照组的差异倍数) (图2,E和F),在转录组结果中显著上调/下调的mRNA和lncRNA在实时荧光定量PCR中也呈现显著上调/下调的趋势。由此推断,这些差异mRNA及lncRNA在qRT-PCR中的表达模式与转录组结果一致,说明本研究的测序结果具有一定的可信度。
2.3 差异mRNA功能富集于细胞外基质黏附、免疫功能类别
为了深入分析差异mRNA的具体功能,选择436个mRNA进行GO分析,共富集到54个条目(FDR<0.05) (图3A)。其中,分别富集到生物学过程(biological process, BP)、细胞组分(cellular component, CC)和分子功能(molecular function, MF)的基因数分别为26条、17条及11条。在BP条目下的富集程度最高前3个的条目为细胞内过程(cellular process)、生物调节(biological regulation)和生物学过程调节(regulation of biological 下的富集程度最高前3个的条目为细胞(cell)、细胞组分(cell part)和细胞器(organelle)。在MF条目下的富集程度最高前3个的条目为连接(binding)、催化过程(catalytic activity)和分子传导过程(molecular transducer activity)。436个mRNA进行KEGG富集分析,共富集到36个条目(FDR<0.05) (图3B)。其中,代谢相关通路富集程度最高的是脂质代谢(lipid metabolism)和碳水化合物代谢(carbohydrate metabolism),其他二级信号通路富集程度最高前3个分别是免疫系统(immune system)、感染性疾病(infectious process)。在CC条目 diseases)和信号传导(signal transduction)。为进一步明确二级信号通路下属的具体条目,按置信度从低到高将所有信号通路进行排列,列出了前10条富集程度最高的信号通路(表3)。从表3可知,胚胎停育组中差异基因富集于补体及凝血级联反应、细胞外基质、吞噬体、血小板活及微生物感染相关的通路。已有的研究已经表明,过度的补体系统激活[13]、凝血系统激活[14]、细胞外基质降解[15]、血小板激活[16]均引起免疫系统过度攻击胚胎并导致流产的发生,而富集于微生物感染相关通路可能是由于免疫失衡后,机体对胚胎的攻击和感染性疾病类似,且胚胎停育后植入部位易引起感染。

图2 差异mRNA及lncRNA的qRT-PCR、转录组验证结果
A:两组别间差异mRNA相对表达量(转录组测序);B:两组别间差异lncRNA相对表达量(转录组测序);C:两组别间差异mRNA相对表达量(实时荧光定量PCR);D:两组别的差异lncRNA相对表达量(实时荧光定量PCR);E:差异mRNA相对表达比值=胚胎停育组/对照组(取log2对数后);F:差异lncRNA相对表达比值=胚胎停育组/对照组(取log2对数后)。

图3 差异mRNA的GO功能和KEGG通路富集分析
A:两组别差异mRNA的GO功能分析;B:两组别差异mRNA的KEGG功能分析。
2.4 筛选细胞外基质黏附、免疫功能模块下具有共表达关系的6个核心lncRNA
为筛选和差异mRNA有共表达关系的lncRNA,采用加权共表达网络WGCNA (weighted gene co- expression network analysis)分析差异mRNA及lncRNA的相关性。WGCNA是基于待测基因间的共表达关系对基因进行模块分类.从而呈现基因的全局表达规律,并通过寻找与样本性状相关的模块和候选基因,为下游机制方面的研究提供方向。
在本研究中,根据差异mRNA及lncRNA的共表达关系,可聚类为4个聚类树,树的一个分支代表一簇表达量高度相关的基因模块(图4A)。通过动态剪切树法对各模块进行区分,并根据模块相似度(0.8)合并相似模块,最终得到4个模块,分别为Blue模块(1236个)、Brown模块(1227个)、Green模块(642个)和Turquoise模块(1292个) (图4B)。在Brown和Turquoise这两个模块中,按照筛选标准:连接程度大于0.6且和差异mRNA至少存在一条直接连接,确定了两个模块中的lncRNA,并对其进行网络图的绘制(图5)。图5A是Brown模块的网络图,包括58个节点(node)和201条边(edge)。蓝色圆形符号包括差异基因和,红色矩形符号代表与其相连的lncRNA,其中连接度最高的lncRNA是RP11-212I21.4LINC00954RP11- 327J17.9。图5B是Turquoise模块的网络图,包括55个节点(node)和285条边(edge)。蓝色圆形符号包括差异基因和,红色矩形符号代表与其相连的lncRNA,其中连接度最高的lncRNA是CTD-2201G3.1RP11-147L13.11RP11-541N10.3。

表3 差异mRNA的KEGG富集分析(置信度最高的前10条信号通路)
Brown模块以和为核心基因,根据表3可知,和是KEGG富集分析中补体及凝血级联反应(complement and coagulation cascades,3.70E-07)通路下的基因,故本研究推测和可能协同该模块其他基因及共表达lncRNA介导补体及凝血级联反应。已有的研究表明[17,18],生理状态下的补体成分激活对妊娠及胎儿发育是有利的,但是过度激活可导致炎症损伤,免疫紊乱。因此,滋养层细胞中过度升高的和可能协同该模块其他基因过度激活了补体系统,可能导致植入部位免疫应激状态,最后引起母胎免疫耐受失衡。同时,凝血系统的激活容易引发凝血–抗凝机制或纤溶活性失衡,引起微血栓形成,使得绒毛或胎盘发育受限。

图4 基因聚类系统树状图及模块划分
A:基于拓扑重叠网络的聚类树;B:动态剪切法得到的基因模块。每一个颜色代表一类表达程度相似的基因,共4个模块,分别为Blue模块(1236个基因)、Brown模块(1227个基因)、Green模块(642个基因)和Turquoise模块(1292个基因)。

图5 候选mRNA及相关lncRNA共表达网络
A:Brown模块所富集到的差异mRNA及共表达lncRNA;B:Turquoise模块所富集到的差异mRNA及共表达lncRNA。节点椭圆形为mRNA,长方形为lncRNA。节点颜色越深表示关联程度越高。
Turquoise模块以和为核心基因,根据表3可知,和是KEGG富集分析中细胞外基质(cell adhesion molecules,3.78E-07)通路下的基因,因此推测和可能协同该模块其他基因及共表达lncRNA对胚胎停育时细胞外基质的分泌和降解有关。细胞外基质对于维持植入部位的正常细胞间连接及细胞-基质黏附非常重要,同时也是调节免疫应答的场所,过度的细胞外基质降解不利于绒毛的早期发育和免疫耐受的建立,可能引起妊娠丢失。
3 讨论
目前研究发现,滋养层细胞对胚胎发育早期有重要作用,承担内分泌、迁移侵入及免疫调节等多种功能[19,20],且和宫内生长受限[21]、妊娠期高血压、子痫[22]和早产[23]等妊娠疾病密切相关。在胚胎发育早期,滋养层细胞的结构或功能异常可能引起胚胎植入失败、胚胎发育停止,可能导致流产的发生[24,25]。但目前胚胎停育原因复杂,具体机制未明。通过研究滋养层细胞的异常变化可以帮助理解胚胎停育的发生机制,找到可能对胚胎停育存在潜在影响的关键分子。因此,本研究通过收集临床胚胎停育患者的绒毛组织,寻找可能引起滋养层细胞功能改变的重要的基因,共筛选到436个差异基因,并通过GO、KEGG富集分析对差异基因进行功能注释及信号通路预测,发现停育胚胎的绒毛组织中存在过度的补体反应和细胞外基质降解不足的情况,可能引起母体对胎儿细胞的过度攻击或胚胎发育障碍,从而导致胚胎停育。同时,为了寻找可能对mRNA存在调控的lncRNA,本研究利用加权共表达网络进行分析,发现Green和Turquoise模块富集到了较多的差异mRNA,并找到了和差异mRNA呈高共表达关系的lncRNA。
通过差异表达分析,本研究在对照组和胚胎停育组间共发现了436个差异基因,胚胎停育组相较于正常对照显著上调的基因较多,406个mRNA显著上调,32个mRNA显著下调。基于此进行文献回顾后发现,Yang等[26]通过对绒毛组织全转录组测序发现早期胚胎丢失(early embryonic arrest, EEA)相较于对照组也存在大量mRNA上调的情况。Pan等[27]的研究显示通过对妊娠丢失患者绒毛的蛋白组学发现早期胚胎丢失相较于对照组存在大量蛋白上调的情况。由此可知,本研究结果和以往类似研究结果趋势一致,说明本研究结果具有一定可信度。其中均被报道和胚胎停育、母胎界面免疫异常或滋养层细胞功能障碍有关[28]。本研究发现这些基因和以往研究相类似,说明本研究结果较为可信。通过对差异mRNA进行GO富集分析发现,在细胞组分条目下差异mRNA显著富集于细胞外基质、胶原连接等,富集到该条目的基因有等。在分子功能条目下,差异mRNA显著富集于淋巴细胞激活、髓系细胞激活等,说明当发生胚胎停育时,绒毛组织中存在过度免疫反应,可能和母胎免疫耐受失衡、启动流产发生有关,富集到该条目的基因有等。
通过KEGG的信号通路分析,本研究发现差异mRNA显著富集在免疫系统中的信号通路数目较多,包括补体及凝血级联反应、血小板激活,FcγR介导的吞噬作用等(表3),提示停育后的绒毛组织中存在母胎免疫耐受异常和过度免疫炎性反应。本研究筛选高置信度的前20个基因,发现其中2个基因可能和绒毛组织中的免疫反应密切相关,分别是。其中(log2FC=3.791,=0.016)和(log2FC=4.142,=0.011)在胚胎停育组中表达水平较对照组显著升高,且富集到补体及凝血级联反应这一信号通路中。是免疫球蛋白结构域遏制蛋白4,和B7家族共抑制分子具有一定的同源性,主要表达于肺、胎盘组织中。目前主要认为可作为T细胞受体的负向调节靶点[29],同时在清除补体调理的病原或其他颗粒如自体成分[30]中发挥作用。被报道和免疫抑制密切相关,在胚胎停育组织中异常升高提示可能介导母胎界面的免疫抑制紊乱。是C1Q的其中一个亚基,而C1Q是经典补体系统的重要组成部分,能够通过激活补体下游成分,诱导免疫复合物介导的杀伤作用并提高吞噬作用[31]。补体广泛分布于体内,在滋养层细胞表面有高水平的表达[32]。具有凝血酶的C5组分可直接激活补体系统,介导炎症损伤,影响胚胎及胎盘发育障碍,最终导致妊娠失败[33]。在动物实验中,补体过度活化可引起小鼠胎盘病理改变、炎症因子增加和血栓形成[34]。由此推测,绒毛细胞中差异基因和可能介导了过度的补体激活,引起免疫耐受失衡,从而导致胚胎损伤,引起发育停止[35]。
同时,(log2FC=3.026,=0.006)和(log2FC=3.357,=0.002)作为本研究中置信度相对较高的基因,在KEGG分析中被富集到细胞外基质这一信号通路,提示可能滋养层细胞对子宫内膜细胞外基质降解出现异常,可能存在组织蛋白酶、金属蛋白酶分泌异常的情况[36]。是广泛表达于单核细胞、巨噬细胞等多种血细胞表面的一类跨膜糖蛋白受体[37],可作为脂类受体、血小板受体及胶原受体调控多种生物学功能,如免疫调节[38]、炎症[39]、癌症[40]的发生与转移等。又称骨桥蛋白,主要参与细胞黏附、细胞间基质附着或免疫调节等多种生物学过程,是母胎界面粘附和信号转导所需的重要分子[41]。正常的胚胎着床和黏附需要多种基质酶促使植入部位的子宫内膜疏松而富有粘性[42]。当胎儿的滋养层细胞分泌能力下降时,植入部位的细胞外基质可能因过于致密导致植入失败或胚胎发育障碍,从而导致胚胎停育或流产的发生[43]。在研究复发性流产时,可作为评价子宫内膜容受性的指标,其水平的异常提示植入失败或胚胎发育障碍。
此外,本研究还发现差异mRNA集中于炎性反应和感染性疾病中,富集到了金黄色葡萄球菌感染、阿米巴病和肺结核等的信号通路中,推测原因可能是胚胎发育异常、停育后母胎免疫逐渐失衡,母体免疫系统开始将绒毛组织作为外来物进行强烈的免疫排斥,并启动免疫反应开始攻击胎儿,此时的绒毛组织中也存在大量炎性反应及免疫因子,这种胚胎停育后的攻击状态和感染性疾病类似。
同时,本研究通过WGCNA算法构建了共表达模块,寻找了和差异mRNA具有相关性的lncRNA。在Brown模块的网络图中,连接度最高的是RP11- 212I21.4、LINC00954和RP11-327J17.9;在Turquoise模块的网络图,连接度最高的是CTD-2201G3.1、RP11-147L13.11和RP11-541N10.3。这6个lncRNA和核心基因具有相类似的表达模式,其机制可能是由于差异mRNA及lncRNA共同参与了某条通路或者受到同样的调控,有可能协同发挥同一生物学功能。目前,由于大部分lncRNA的功能未明确,通过WGCNA共表达分析探究和差异mRNA具有相关性的lncRNA能从一定程度上预测其功能,同时从lncRNA的角度对两组间出现的差异mRNA做出解释,例如lncRNA通过选择性剪切模式改变mRNA的亚型种类及表达水平或合成内源性siRNA进行转录干扰,从而影响mRNA的转录水平[44,45]。
本研究也存在些许不足。首先,本次研究样本量有限,仅纳入14例人工流产患者作为对照和12例胚胎停育患者。因此本研究的结果还需要进一步的大样本测序结果来验证。本研究对于筛选到的lncRNA的功能未进一步研究,希望在今后能开展相关实验,以深入分析lncRNA对差异基因的确切的调控机制。其次,本研究使用的转录组测序流程依次为:首先去除rRNA,进行文库构建(mRNA片段化、逆转录、双链合成、末端补齐、末尾加A、加测序接头、PCR富集)和Illumina测序,最后采用FPKM对转录本进行相对定量分析[46,47]。但由于文库PCR扩增偏好性,可能存在所有序列不会被同比例放大的情况,可能对结果带来一定程度的偏倚。
综上所述,本研究通过全转录测序及初步生物信息学分析,发现了数个可能对滋养层细胞的生物学功能存在潜在影响的重要差异基因及相关lncRNA网络。深入研究这些基因能从母胎免疫失衡和滋养层细胞植入不足等原因对胚胎停育出一定解释,并为不明原因流产提供新的思路和方向。
[1] Staud F, Karahoda R. Trophoblast: The central unit of fetal growth, protection and programming.,2018, 105: 35–40.
[2] Moser G, Windsperger K, Pollheimer J, de Sousa Lopes SC, Huppertz B. Human trophoblast invasion: new and unexpected routes and functions.,2018, 150(4): 361–370.
[3] Baines KJ, Renaud SJ. Transcription factors that regulate trophoblast development and function.,2017, 145: 39–88.
[4] Harris LK, Jones CJ, Aplin JD. Adhesion molecules in human trophoblast - a review. II. extravillous trophoblast.,2009, 30(4): 299–304.
[5] Chung TW, Park MJ, Kim HS, Choi HJ, Ha KT. Integrin αVβ3 and αVβ5 are required for leukemia inhibitory factor-mediated the adhesion of trophoblast cells to the endometrial cells.,2016, 469(4): 936–940.
[6] Huppertz B. Traditional and new routes of trophoblast invasion and their implications for pregnancy diseases.,2019, 21(1): 289.
[7] Malik A, Pal R, Gupta SK. Interdependence of JAK-STAT and MAPK signaling pathways during EGF-mediated HTR-8/SVneo cell invasion.,2017, 12(5): e0178269.
[8] Huang ZY, Li SW, Fan W, Ma QH. Transforming growth factor β1 promotes invasion of human JEG-3 trophoblast cells via TGF-β/Smad3 signaling pathway.,2017, 8(20): 33560–33570.
[9] Chitu V, Stanley ER. Regulation of embryonic and postnatal development by the CSF-1 receptor.,2017, 123: 229–275.
[10] Ding JL, Yin TL, Yan NN, Cheng YX, Yang J. FasL on decidual macrophages mediates trophoblast apoptosis: A potential cause of recurrent miscarriage.,2019, 43(6): 2376–2386.
[11] Shaik R, Ramakrishna W. Genes and Co-Expression modules common to drought and bacterial stress responses in arabidopsis and rice.,2013, 8(10): e77261.
[12] Robinson MD, McCarthy DJ, Smyth GK. edgeR: a Bioconductor package for differential expression analysis of digital gene expression data.,2010, 26(1): 139–140.
[13] Takeshita A, Kusakabe KT, Hiyama M, Kuniyoshi N, Kondo T, Kano K, Kiso Y, Okada T. Dynamics and reproductive effects of complement factors in the spontaneous abortion model of CBA/J×DBA/2 mice., 2014, 219(5): 385–391.
[14] Huang J, Qin H, Yang YH, Chen XY, Zhang JM, Laird S, Wang CC, Chan TF, Li TC. A comparison of transcriptomic profiles in endometrium during window of implantation between women with unexplained recurrent implantation failure and recurrent miscarriage., 2017, 153(6): 749–758.
[15] Yurdakan G, Ekem TE, Bahadir B, Gun BD, Kuzey GM, Ozdamar SO. Expression of adhesion molecules in first trimester spontaneous abortions and their role in abortion pathogenesis., 2008, 87(7): 775–782.
[16] Soylu Karapınar O, Benk Şilfeler D, Dolapçıoğlu K, Keskin Kurt R, Beyazıt A. The effect of molar pregnancies on platelet parameters., 2016, 36(7): 912–915.
[17] Girardi G, Salmon JB. The role of complement in pregnancy and fetal loss., 2003, 36(1): 19–26.
[18] Kouser L, Madhukaran SP, Shastri A, Saraon A, Ferluga J, Al-Mozaini M, Kishore U. Emerging and novel functions of complement protein C1q., 2015, 6: 317.
[19] Liu FL, Zhou J, Zhang W, Wang H. Epigenetic regulation and related diseases during placental development., 2017, 39(4): 263–275.刘福林, 周瑾, 张蔚, 汪晖. 胎盘发育过程中的表观遗传学改变及其相关疾病. 遗传, 2017, 39(4): 263–275.
[20] Lai XM, Wang YX. Trophoblastic invasion and its regulatory factors., 2007, 15(3): 1–3.赖雪梅, 王应雄. 滋养层侵袭力及其调控因素. 中国优生与遗传杂志, 2007, 15(3): 1–3.
[21] Burton GJ, Jauniaux E. Pathophysiology of placental- derived fetal growth restriction.,2018, 218(2S): S745–S761.
[22] James-Allan LB, Whitley GS, Leslie K, Wallace A, Cartwright JE. Decidual cell regulation of trophoblast is altered in pregnancies at risk of pre-eclampsia.,2018.
[23] Zadrozna M, Nowak B, Marcinek A, Duc J. Villous trophoblast cell turnover in placentas from preterm pregnancyand pregnancy complicated by intrauterine growth restriction (IUGR).,2009, 58(1–2): 79–83.
[24] Check JH, Aly J, Chang E. Improving the chance of successful implantation-Part I-Embryo attachment to the endometrium and adequate trophoblast invasion.,2016, 43(6): 787–791.
[25] Burton GJ, Jauniaux E. The cytotrophoblastic shell and complications of pregnancy.,2017, 60: 134–139.
[26] Yang WM, Lu ZY, Zhi ZF, Liu LL, Deng LJ, Jiang XL, Pang LH. High-throughput transcriptome-Seq and small RNA-Seq reveal novel functional genes and microRNAs for early embryonic arrest in humans., 2019, 697: 19–25.
[27] Pan HT, Ding HG, Fang M, Yu B, Cheng Y, Tan YJ, Fu QQ, Lu BB, Cai HG, Jin X, Xia XQ, Zhang T. Proteomics and bioinformatics analysis of altered protein expression in the placental villous tissue from early recurrent miscarriage patients., 2018, 61: 1–10.
[28] Atanasova MA, Konova EI, Aleksovska TA, Todorova KN, Georgieva MN, Lukanov TH. Anti-fibrillin-1 autoantibodies in normal pregnancy and recurrent pregnancy loss.,2011, 10(3): 131–136.
[29] Vogt L, Schmitz N, Kurrer MO, Bauer M, Hinton HI, Behnke S, Gatto D, Sebbel P, Beerli RR, Sonderegger I, Kopf M, Saudan P, Bachmann MF. VSIG4, a B7 family-related protein, is a negative regulator of T cell activation.,2006, 116(10): 2817–2826.
[30] Helmy KY, Katschke KJ, Gorgani NN, Kljavin NM, Elliott JM, Diehl L, Scales SJ, Ghilardi N, van Lookeren Campagne M. CRIg: A macrophage complement receptor required for phagocytosis of circulating pathogens.,2006, 124(5): 915–927.
[31] Kim DD, Miwa T, Kimura Y, Schwendener RA, van Lookeren Campagne M, Song WC. Deficiency of decay- accelerating factor and complement receptor 1-related gene/protein y on murine platelets leads to complement- dependent clearance by the macrophage phagocytic receptor CRIg.,2008, 112(4): 1109–1119.
[32] Mascarell L, Airouche S, Berjont N, Gary C, Gueguen C, Fourcad G, Bellier B, Togbe D, Ryffel B, Klatzmann D, Baron-Bodo V, Moingeon P. The regulatory dendritic cell marker C1q is a potent inhibitor of allergic inflammation.,2016, 10(3): 695–704.
[33] Girardi G. Complement inhibition keeps mothers calm and avoids fetal rejection.,2008, 37(5): 645– 659.
[34] Girardi G, Prohászka Z, Bulla R, Tedesco F, Scherjon S. Complement activation in animal and human pregnancies as a model for immunological recognition., 2011, 48(14): 1621–1630
[35] Teirilä L, Heikkinen-Eloranta J, Kotimaa J, Meri S, Lokki AI. Regulation of the complement system and immunological tolerance in pregnancy., 2019, 45: 101337.
[36] Sun J, Jin L. Trophinin, tastin, bystin complex binds to embryo initiation., 2005, 13(5): 113–114.孙虹, 靳镭. Trophinin, tastin, bystin复合体与胚胎起始黏附. 中国优生与遗传杂志, 2005, 13(5): 113–114.
[37] Oz HS, Ebersole JL, de Villiers WJS. The macrophage pattern recognition scavenger receptors SR-A and CD36 protect against microbial induced pregnancy loss.,2011, 60(1): 93–97.
[38] Silverstein RL, Febbraio M. CD36, a scavenger receptor involved in immunity, metabolism, angiogenesis, and behavior., 2009, 2(72): re3.
[39] Abumrad NA, Goldberg IJ. CD36 actions in the heart: Lipids, calcium, inflammation, repair and more?, 2016, 1861(10): 1442–1449.
[40] Wang JC, Li YS. CD36 tango in cancer: signaling pathways and functions.,2019, 9(17): 4893– 4908.
[41] Johnson GA, Burghardt RC, Bazer FW, Spencer TE. Osteopontin: Roles in implantation and placentation.,2003, 69(5): 1458–1471.
[42] Yu QB, Wang YX. Cell adhesion molecules to the embryo implantatio., 2005, 13(1): 6–8.余秋波, 王应雄. 细胞粘附分子与胚胎着床. 中国优生与遗传杂志, 2005, 13(1): 6–8.
[43] Nardo LG, Nikas G, Makrigiannakis A. Molecules in blastocyst implantation. Role of matrix metalloproteinases, cytokines and growth factors.,2003, 48(3): 137–147.
[44] Gonzalez I, Munita R, Agirre E, Dittmer TA, Gysling K, Misteli T, Luco RF. A lncRNA regulates alternative splicing via establishment of a splicing-specific chromatin signature,2015, 22(5): 370–376.
[45] Lieberman J. Tapping the RNA world for therapeutics., 2018, 25(5): 357–364.
[46] Pérez-Palacios R, Fauque P, Teissandier A, Bourc'his D. Deciphering the early mouse embryo transcriptome by Low-Input RNA-Seq., 2021, 2214: 189–205.
[47] Svensson V, Natarajan KN, Ly LH, Miragaia RJ, Labalette C, Macaulay IC, Cvejic A, Teichmann SA. Power analysis of single-cell RNA-sequencing experiments., 2017, 14(4): 381–387.
Related genes and characteristic analysis of trophoblast cells during early embryo developmental cessation
Yue Zhang1, Ying Feng2, Fang Ma1,3
Trophoblast cells play essential roles in the maintenance of normal embryo implantation, growth and development. The study of abnormal gene changes in trophoblastic cells from arrested embryos is helpful to understand the developmental mechanism of embryo developmental cessation or adverse pregnancy outcomes. In this study, we sequenced and analyzed the transcriptomes of the villi from ten women who have undergone abortion with either normal pregnancy or embryo development cessation. We found that there were 436 differentially expressed genes, of which 406 mRNA were significantly up-regulated and 32 mRNA were significantly down-regulated. Gene enrichment analysis showed that these genes were significantly enriched in immune-related functions and intercellular adhesion, such as lymphocyte activation, myeloid cell activation, extracellular matrix and collagen junction. And their potential regulatory pathways were enriched in terms of complement and coagulation cascade, extracellular matrix degradation. In addition, in this study the co-expression analysis of WGCNA was used to obtain the lncRNA with co-expression relationship with the differential genes. According to the different functions of the modules, two network diagrams were drawn, and four key genes were obtained, namelyand. These differential genes obtained in this study can be used as key molecules with potential effects on embryo development cessation. The enriched entries can provide a theoretical basis and new direction for further understanding of the etiology and mechanism of embryo development cessation or adverse pregnancy outcomes.
trophoblast; RNA-seq; enrichment analysis; genetic traits
2020-08-08;
2020-10-02
国家自然科学基金项目(编号:31771662)和国家科技重大专项(编号:2018YFC1002803-3)资助[Supported by the National Nature Science Foundation of China (No. 31771662), and the National Science and Technology Major Project (No. 2018YFC1002803-3)]
张悦,在读硕士研究生,专业方向:母婴医学。E-mail: zhangyue@stu.scu.edu.cn
马芳,教授,研究方向:糖生物学与生殖医学。E-mail: mafangmed@126.com
10.16288/j.yczz.20-144
2020/10/20 15:15:00
URI: https://kns.cnki.net/kcms/detail/11.1913.R.20201019.1300.003.html
(责任编委: 杜茁)
