突变型NDUFS7质粒的构建及其对神经细胞的影响
2020-10-29高向东
沈 杰,查 倩,高向东,陈 松
(中国药科大学生命科学与技术学院江苏省生物药物成药性研究重点实验室,南京211198)
线粒体是细胞内有氧呼吸的主要场所,参与了细胞代谢、信号传导、氧化应激等多种重要胞内活动[1-2]。呼吸链在线粒体中发挥着重要作用,线粒体复合体Ⅰ是呼吸链中结构最复杂、包含亚基最多的多蛋白复合体,由45种细胞核和线粒体基因编码的蛋白装配而成,相对分子质量约1 000 kD[3-4],它能够将NADH中的电子通过黄素单核苷酸传递给辅酶Q,并将质子传递出线粒体内膜进而产生能量[5-6],为生命体的生命活动提供必要的能量,参与调控细胞生长、信号转导和细胞凋亡等生命活动,在细胞能量代谢中发挥着重要作用[7-8]。
NDUFS7(NADH dehydrogenase(ubiquinone)Fe-S protein 7)是由细胞核内基因编码,人类NDUFS7基因定位于19号染色体,编码的蛋白质参与构成线粒体呼吸链复合体Ⅰ,相对分子质量约为20 kD,是复合体Ⅰ疏水亚基的重要组成部分[9-11]。线粒体复合体Ⅰ功能障碍可导致细胞功能发生障碍并退化凋亡,多种神经毒素例如MPTP和鱼藤酮等已经被证明能够抑制线粒体复合体Ⅰ的活性从而导致多巴胺能神经元的退化[12-13],线粒体功能发生障碍时,可能诱发细胞内线粒体膜电位水平异常从而导致细胞死亡。此外有研究证明神经退行性疾病也与复合体Ⅰ中亚基突变有着密切联系[11,14]。NDUFS7 基因作为线粒体复合体Ⅰ的重要组成部分,其突变可能导致多巴胺能神经元的退化。课题组前期基于线虫模型发现了线粒体复合体Ⅰ亚基NDUFS7(线虫NDUF7同源)突变导致多巴胺能神经元退化[15],但其对于人源多巴胺能神经细胞的影响仍需进一步验证。
本研究通过构建pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒,转染分化后SH-SY5Y细胞,考察转染NDUFS7基因突变质粒对多巴胺能神经细胞活力、凋亡情况以及细胞内Bax、Bcl-2蛋白表达量的影响,同时采用抗氧化剂进行干预,明确转染NDUFS7基因突变质粒后可能通过影响线粒体正常功能导致多巴胺能神经细胞凋亡。
1 材料
1.1 试剂
DMEM高糖培养基、胎牛血清(美国Gibco公司);DNA Marker(日本 TaKaRa公司);Lipofectamine 3000转染试剂、蛋白预染Marker、蛋白酶和磷酸酶抑制剂(美国Thermo公司);Bax、Bcl-2抗体、HRP标记的山羊抗兔IgG(美国Cell Signaling Technology公司);β-actin抗体(中国Abclonal公司);胰蛋白酶(美国Sigma公司);MTT、氨苄青霉素、链霉素、牛血清白蛋白(中国Biosharp公司);PVDF膜、ECL试剂盒(美国Millipore公司);BCA蛋白浓度检测试剂盒、RIPA细胞裂解液、一抗稀释液、Annexin V-FITC/PI双染细胞凋亡检测试剂盒、线粒体膜电位检测试剂盒、Hoechst 33342、碘化丙啶(propidium iodide,PI)(中国碧云天生物技术研究所);其他试剂均为市售分析纯。
1.2 仪器
高速冷冻离心机、全波长酶标仪、NanoDrop 2000C超微量分光光度计(美国Thermo公司);倒置相差显微镜、倒置荧光显微镜(日本Olympus公司);TDZ5-WS台式离心机(湘仪离心机仪器有限公司);电泳仪、转膜仪(美国Bio-Rad公司);化学发光成像系统(上海天能科技有限公司);流式细胞仪(美国Becton-Dickinson公司)。
1.3 菌株和细胞
TOP10菌株、神经母细胞瘤细胞SH-SY5Y细胞株购自美国菌种保藏中心(ATCC)。
2 方法
2.1 细胞培养及其诱导分化
SH-SY5Y细胞于含10%胎牛血清,1×105IU/L氨苄青霉素,100 mg/L链霉素的DMEM高糖培养基中,含5%CO2的细胞培养箱中37℃培养。3 d后,取生长状态良好的细胞按1∶3进行传代,于含有终浓度为10 μmol/L反式维甲酸的DMEM高糖培养基中分化,连续分化6 d,每2 d换液一次,第7天进行后续实验。
2.2 pcDNA3.1(+)-NDUFS7 Q208STOP质粒的构建
将人源NDUFS7基因208位谷氨酰胺密码子突变为终止密码子,与pcDNA3.1(+)质粒连接构建pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒,转化至TOP10菌株中,使用LB培养基对含有突变基因质粒的TOP10菌株进行扩增,接种于含100 mg/L氨苄青霉素的LB平板上,37℃培养过夜,挑取阳性单克隆,于LB液体培养基中扩增并制成甘油菌保存。
2.3 pcDNA3.1(+)-NDUFS7 Q208STOP质粒的鉴定
将含有pcDNA3.1(+)-NDUFS7 Q208STOP质粒的TOP10菌株接种于LB液体培养基中,37℃培养至A为2.0~3.0,使用无内毒素质粒小提中量试剂盒提取质粒。使用EcoRⅠ、XbaⅠ对质粒进行双酶切后制样,取样品溶液10 μL于1.0%琼脂糖凝胶中上样,90 V,30 min电泳,凝胶成像仪成像并拍照。
2.4 MTT法检测转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒对细胞活力的影响
实验分为空白对照组、pcDNA3.1(+)对照组、pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒转染组。收集生长状态良好的分化后SH-SY5Y细胞,以每毫升5×104个细胞的密度接种于96孔板中,每孔100 μL,在含5%CO2细胞培养箱中37℃培养过夜。待细胞汇合度达到80%左右,更换无血清opti-MEM培养基,2 h后进行细胞转染。按每孔Lipofectamine 3000 0.15 μL、P3000 0.2 μL、DNA 0.1 μg进行 pcDNA3.1(+)-NDUFS7 Q208STOP质粒的转染,共同孵育5 h后将培养基换为含1%胎牛血清的DMEM高糖培养基。培养48 h后,MTT法检测各实验组细胞活力:每孔加入MTT溶液10 μL,于含5%CO2细胞培养箱中37℃孵育4 h后吸出上清液,加入DMSO 150 μL并置于酶标板振荡器上500 r/min振荡10 min,以570 nm检测波长,630 nm参比波长于酶标仪中检测各孔吸收度。
2.5 AnnexinⅤ-FITC/PI双染结合流式细胞术检测转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒对细胞凋亡情况的影响
实验分组同“2.4”项。收集生长状态良好的分化后SH-SY5Y细胞,以每毫升5×104个细胞的密度接种于6孔板中,每孔1 000 μL,在含5%CO2的细胞培养箱中37℃培养过夜。待细胞汇合度达到80%左右,更换无血清opti-MEM培养基,2 h后进行细胞转染。每孔Lipofectamine 3000 3.75 μL、P3000 5 μL、DNA 2.5 μg 进 行 pcDNA3.1(+)-NDUFS7 Q208STOP质粒的转染,共同孵育5 h后将培养基换为含1%胎牛血清的DMEM高糖培养基。培养48 h后,AnnexinⅤ-FITC/PI双染结合流式细胞术检测各实验组中细胞凋亡情况。具体步骤为:将细胞培养液吸至EP管中,PBS洗涤细胞一次,加入适量0.25%胰酶消化液消化细胞,室温孵育1 min;加入收集的细胞培养液,把细胞轻轻吹打下来,转移至EP管中,1 500 r/min离心5 min,弃上清液,收集细胞,用PBS轻轻重悬细胞并计数;取10万个重悬细胞,1 500 r/min离心5 min,弃上清液,加入Annexin V-FITC结合液195 μL重悬细胞;加入Annexin V-FITC溶液5 μL混匀,再加入PI溶液10 μL混匀;室温避光孵育20 min,置于冰浴中,流式细胞仪检测各组细胞荧光值。
2.6 Western blot检测转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒对细胞内Bax、Bcl-2蛋白表达量的影响
实验分组同“2.4”项。按照“2.5”项中的实验方法进行分化后SH-SY5Y细胞铺板和pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒的转染。培养48 h后,提取细胞内总蛋白,Western blot检测各实验组中Bax、Bcl-2蛋白水平变化。具体步骤为:PBS洗涤细胞3次后置于冰上,每孔中加入RIPA细胞裂解液(按1∶100加入蛋白酶、磷酸酶抑制剂混合液)100 μL;使用细胞刮刀将细胞刮下并转移至EP管中,置于冰上保存;使用涡旋仪充分振荡裂解,每3 min 1次,共30 min;置于高速冷冻离心机中,4℃、12 000 r/min离心10 min收集上清液即为细胞内蛋白溶液。制样后进行SDS-PAGE电泳,使用半干法将蛋白转印至PVDF膜上,3%脱脂奶粉封闭1 h,TBST洗涤3次,每次10 min;一抗4 ℃孵育过夜,TBST洗涤5次,每次5 min;二抗室温孵育2 h,TBST洗涤5次,每次5 min,ECL显色成像并拍照。
2.7 JC-1探针检测抗氧化剂Trolox及转染pc DNA3.1(+)-NDUFS7 Q208STOP突变质粒对分化后SH-SY5Y细胞线粒体膜电位的影响
实验分为空白对照组、pcDNA3.1(+)对照组、pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒转染组、pcDNA3.1(+)-NDUFS7 Q208STOP+Trolox转染后给药干预组。按照“2.5”项下方法进行细胞铺板和突变质粒转染并在换液时使用终浓度为10 μmol/L的抗氧化剂Trolox进行给药干预。细胞培养48 h后,JC-1探针检测各实验组中细胞内线粒体膜电位水平变化情况。具体步骤为:取适量JC-1(200×)探针,按每50 μL 探针加入超纯水8 mL的比例进行稀释,剧烈涡旋使之混匀,再加入JC-1染色缓冲液(5×)2 mL充分混匀;吸去细胞培养液,使用PBS洗涤1次,每孔加入细胞培养基1 mL,再加入JC-1染色工作液1 mL,充分混匀,于37℃细胞培养箱中孵育20 min;吸去JC-1染色工作液,使用JC-1染色缓冲液(1×)洗涤2次,每孔加入无血清培养基2 mL,使用倒置荧光显微镜进行观察拍照。
2.8 Hoechst/PI双染检测抗氧化剂Trolox对转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒的分化后SH-SY5Y细胞凋亡情况的干预作用
实验分组同“2.7”项。按照“2.5”项下方法进行细胞铺板和突变质粒转染并在换液时使用终浓度为10 μmol/L抗氧化剂Trolox进行给药干预。细胞培养48 h后,PI/Hoechst双染进一步检测各实验组中细胞凋亡情况。具体步骤为:弃去6孔板中培养基,使用PBS洗涤细胞2次,每孔加入含有终浓度为7 mmol/L Hoechst 33342的DMEM高糖培养基1 000 μL于37℃培养箱中孵育25 min;PBS洗涤细胞2次,每孔加入含有终浓度为2 mmol/L PI的DMEM高糖培养基1 000 μL,室温下避光孵育15 min;染色完成后,PBS洗涤3次,荧光显微镜观察并拍照。
2.9 统计分析
实验数据采用GraphPad Prism 8.0统计软件进行处理,各项指标以xˉ±s表示,来源于至少3次独立实验,以One-way ANOVA检验进行组间比较,P<0.05时表明差异有统计学意义。
3 结果
3.1 pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒的构建和鉴定
构建pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒,采用EcoRⅠ、XbaⅠ双酶切,琼脂糖凝胶电泳验证质粒正确性。结果如图1所示,条带2中出现大小约为650 bp(NDUFS7突变基因条带)和5 400 bp的两个条带,说明质粒构建基本正确。进一步测序验证,结果与预期构建的序列完全一致,表明已成功构建pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒。
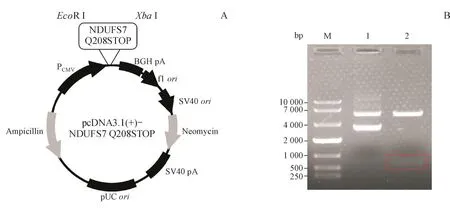
Figure 1 Plasmid profile(A)and the agarose gel electrophoresis of enzyme digested plasmids(B)Line M:Marker;Line 1:pcDNA3.1(+)-NDUFS7 Q208STOP;Line 2:pcDNA3.1(+)-NDUFS7 Q208STOP digested by EcoR I and Xba I
3.2 转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒对神经细胞活力的影响
转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒48 h后,MTT法检测各实验组神经细胞活力。结果如图2所示,与转染pcDNA3.1(+)实验组相比,转染突变质粒实验组细胞活力显著降低,说明转染NDUFS7突变质粒会导致分化后SH-SY5Y细胞活力下降。
3.3 AnnexinⅤ-FITC/PI双染结合流式细胞术检测转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒对细胞凋亡水平的影响
转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒48 h后,采用AnnexinⅤ-FITC/PI双染结合流式细胞术检测各实验组细胞凋亡水平的变化。结果如图3所示,与转染pcDNA3.1(+)实验组相比,转染突变质粒实验组神经细胞凋亡比例显著上升,说明转染NDUFS7基因突变质粒能够导致多巴胺能神经细胞的凋亡。
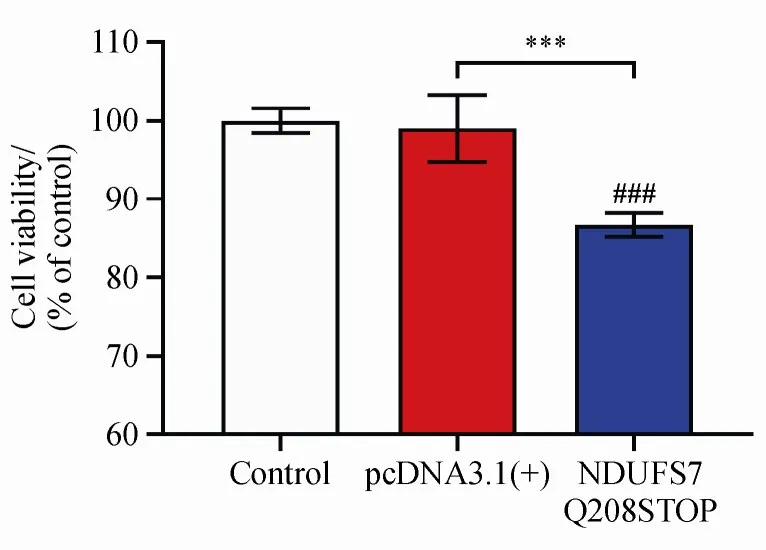
Figure 2 Cell viability after transfection with pcDNA3.1(+)-NDUFS7 Q208STOP mutant plasmid in differentiated SH-SY5Y cells was analyzed by the MTT assay(-x±s,n=10)
3.4 转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒对神经细胞内Bax、Bcl-2蛋白表达量的影响
转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒48 h后,采用Western blot检测各实验组细胞内Bax、Bcl-2表达量的变化。结果如图4所示,与对照组相比,转染突变质粒后,分化后SH-SY5Y细胞中促凋亡蛋白Bax表达量和抑凋亡蛋白Bcl-2表达量的比值显著上升,说明转染NDUFS7基因突变质粒后可以通过诱导多巴胺能神经细胞中凋亡相关蛋白Bax/Bcl-2的改变,对多巴胺能神经细胞的凋亡起到促进作用。

Figure 3 The cell apoptosis level after transfection with pcDNA3.1(+)-NDUFS7 Q208STOP mutant plasmid in differentiated SH-SY5Y cells for 48 h(-x±s,n=3)A:Analysis of the proportion of apoptotic cells in differentiated SH-SY5Y cells by flow cytometry;B:Quantification of apoptotic cell proportion

Figure 4 Effects of transfection with pcDNA3.1(+)-NDUFS7 Q208STOP mutant plasmid on the levels of Bax and Bcl-2 in differentiated SH-SY5Y cells(-x±s,n=3)A:Detection of Bax and Bcl-2 by Western blot;B:Quantitative analysis of Bax/Bcl-2
3.5 抗氧化剂Trolox及转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒对分化后SH-SY5Y细胞线粒体膜电位的影响
转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒并在换液时使用终浓度为10 μmol/L的Trolox进行给药干预,孵育48 h后,采用JC-1探针检测分化后SH-SY5Y细胞内线粒体膜电位水平。结果如图5所示,与对照组相比,转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒后绿色荧光增强,说明细胞内线粒体膜电位降低,而抗氧化剂Trolox给药干预后,出现较强的红色荧光,说明Trolox可缓解转染突变质粒导致的细胞内线粒体膜电位异常。结果表明NDUFS7突变质粒导致的神经细胞异常可被抗氧化剂Trolox缓解。

Figure 5 Effects of Trolox and transfection with pcDNA3.1(+)-NDUFS7 Q208STOP mutant plasmid on the mitochondrial membrane potential in differentiated SH-SY5Y cells
3.6 抗氧化剂Trolox对转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒的分化后SH-SY5Y细胞凋亡情况的干预作用
转染pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒并在换液时使用Trolox进行给药干预,孵育48 h后,采用PI/Hoechst双染法检测各组细胞凋亡情况并使用荧光显微镜观察进行拍照。结果如图6所示,与空白对照组相比,转染突变质粒后凋亡细胞数量明显增多,而使用Trolox给药干预后凋亡细胞数量显著降低,说明抗氧化剂Trolox能够改善转染突变质粒后导致的多巴胺能神经细胞凋亡。
4 讨论
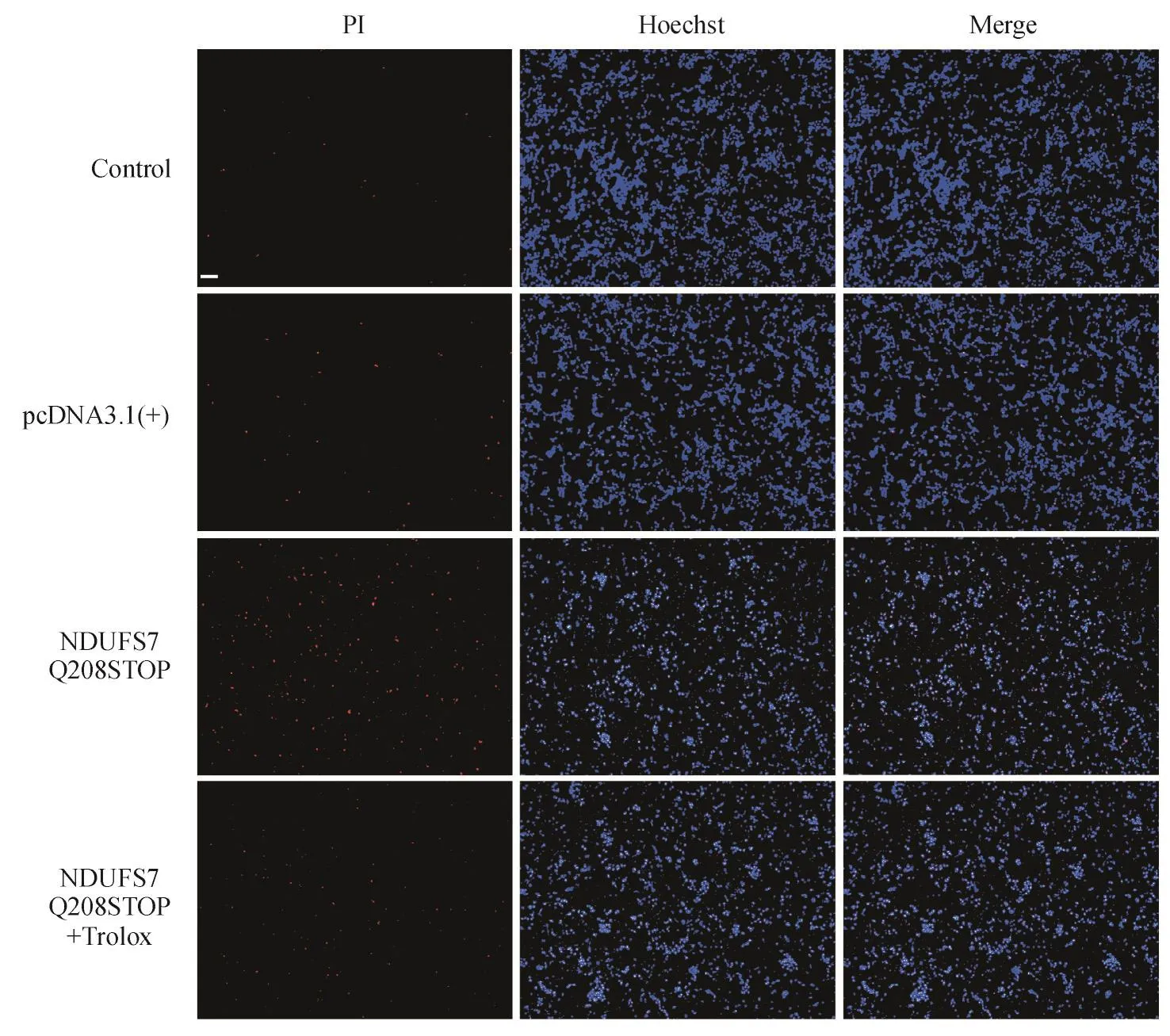
Figure 6 Effects of Trolox and transfection with pcDNA3.1(+)-NDUFS7 Q208STOP mutant plasmid on apoptosis in differentiated SH-SY5Y cells Scar bar:200 μm
多巴胺能神经元是以多巴胺作为神经递质的神经元,人类大脑中约有40万个多巴胺能神经元。多巴胺能神经元参与调节机体对环境的反应,对机体运动能力、认知能力都发挥着重要作用[16]。多巴胺能神经元与大脑学习能力密不可分[17],而且多种神经退行性疾病的发生发展与多巴胺能神经元之间有着密切的联系[18-19],其中帕金森病的主要病理特征即为中脑黑质多巴胺能神经元损伤导致的纹状体多巴胺严重缺失[20]。线粒体功能障碍是多巴胺能神经元退化凋亡的重要原因之一,与线粒体功能相关的多个蛋白(如LRRK2、ATP13A2等)与帕金森病有着显著的关联[21]。线粒体复合体Ⅰ是线粒体呼吸链的关键成分之一,复合体Ⅰ中亚基的突变与PD、Leigh综合征等神经退行性疾病有着密切联系[22]。例如Leigh综合征与线粒体复合体Ⅰ中23个基因的突变有关,包括NDUFS1、NDUFS2、NDUFS8等[23]。本课题组前期报道了线虫中NDUF7基因突变能够引起多巴胺能神经元特异性退化[15],进一步于本研究中证明了在哺乳动物细胞中NDUFS7(线虫NDUF7同源)基因突变与多巴胺能神经元凋亡之间的联系,并且揭示突变型NDUFS7质粒可能是通过诱导神经细胞线粒体功能异常进而促进细胞凋亡。
本研究设计并构建pcDNA3.1(+)-NDUFS7 Q208STOP突变质粒,转染分化后SH-SY5Y细胞,进而影响线粒体复合体Ⅰ的正常功能,证明了哺乳动物多巴胺能神经细胞内转染NDUFS7基因突变质粒后能够导致细胞凋亡。同时,本研究揭示了抗氧化剂给药干预后能够改善转染突变质粒导致的神经细胞线粒体膜电位异常,从而降低细胞凋亡水平。以上实验结果说明转染NDUFS7基因突变质粒后,通过引起细胞内线粒体功能异常导致多巴胺能神经元凋亡,证明了突变型NDUFS7质粒导致多巴胺能神经元凋亡的作用及机制,为与多巴胺能神经元退化凋亡相关的疾病和药物研究提供新的思路和理论依据。
