山区型和田羊毛囊KAP1.1基因表达载体构建及生物信息学分析
2020-10-29余路菲李树伟
余路菲 赵 军 李树伟*
(1塔里木大学生命科学学院,新疆 阿拉尔 843300)
(2新疆生产建设兵团塔里木盆地生物资源保护利用重点实验室,新疆 阿拉尔 843300)
毛囊作为真皮的衍生物,是一个结构和功能非常复杂的亚器官[1],是皮肤的主要附属器之一,具有高度自我更新能力,是机体内独特的可再生器官,毛囊细胞经增殖分化最终形成毛发。羊毛和绒纤维的主要成分是角蛋白,同时角蛋白是构成毛纤维的骨架[2],毛纤维角蛋白中间丝蛋白(keratin intermediate filament protein,KIF)和角蛋白关联蛋白(keratin-associated protein,KAP)占羊毛纤维的90%[2],具有高度的规律化组织结构[3-4]。角蛋白关联蛋白是组成羊毛纤维的主要结构蛋白之一[5],根据其蛋白质序列中的氨基酸含量,主要分为三大类型[6]。其中,高硫(high sulphur,HS)蛋白则为角蛋白关联蛋白超家族中的一个类型,包括KAP1、KAP2和KAP3三个家族,且大小约为151-181个氨基酸,Cys含量约为22%。据研究,角蛋白对毛纤维的理化性质(细度、长度、密度、颜色和光泽、氨基酸含量等)具有一定影响[7]。由于KAP是编码毛囊毛纤维结构蛋白的主要基因,因此,探索其对绵羊羊毛性状遗传变异的影响,对利用该基因改善羊毛密度、毛纤维直径、长度等品质性状有着非常重要的意义。
近年来,随着分子生物学、基因工程等技术的不断提升,对绵羊羊毛性状和品质的研究吸引了越来越多专家学者。利用基因技术探究角蛋白关联蛋白对羊毛纤维品质的影响,发现羊毛的角蛋白组成与羊毛纤维结构有着密切关系[8],由于遗传、生理、生活环境等因素,导致不同地区品种绵羊羊毛品质有较明显差异。朱建勋[9]在KAP11-1对5个中国绵羊群体的遗传变异的影响研究中,认为KAP11-1基因作为羊毛经济性状的主要候选基因之一,其核苷酸序列的变异导致其相应氨基酸的改变,最终可能会影响羊毛纤维的结构;徐从祥等[10]研究KAP6.1基因的多态性及其与羊毛性状的相关性,发现KAP6.1基因可作为绵羊污毛产量的候选基因之一,其中BB基因型可作为分子标记用于选择污毛产量高的个体;依明·苏来曼[11]研究了和田羊KAP7、KAP8基因遗传多样性及其与羊毛长度的关联性分析,其结果显示和田羊KAP8基因没有发现多态性,KAP7基因具有多态性,关联分析表明,和田羊不同基因型之间羊毛长度差异显著;刘晓军等[12]用绵羊KAP2基因对影响羊毛性状的表型差异进行了研究,推测出KAP2基因可能是影响羊毛性状的差异基因;李志刚等[13]用山区型和田羊毛囊KAP6.1、KAP7与KAP8基因进行克隆分析,成功在原核细胞中表达对山区型和田羊毛囊HGT蛋白3个家族的主要基因;武振辉等[14]探究了毛囊KIF2.9基因对半粗毛型地方品种绵羊羊毛品质和性状的影响,成功克隆出山区型和田羊毛囊KIF2.9基因;高建军等[15]研究了绵羊毛囊角蛋白基因对异质毛绵羊羊毛性状、品质的影响,并成功构建了和田羊毛囊角蛋白原核表达载体。
综上所述,尽管对于羊毛毛囊角蛋白关联蛋白基因有一些研究,但对高硫蛋白家族中的KAP1.1基因在粗毛羊、半粗毛羊羊毛品质方面的影响研究较少,对新疆南疆山区型和田羊品种(系)的羊毛毛囊发育相关基因的报道更少。因此,本试验对山区型和田羊毛囊KAP1.1基因进行克隆及其生物信息学分析,为进一步探讨角蛋白基因对羊毛性状的影响提供理论依据,对研究新疆南疆地方特色绵羊品种遗传资源具有重要意义。
1 材料与方法
1.1 材料
1.1.1 和田羊毛囊样品采集及组织保存
山区型和田羊来自新疆和田地区策勒县恩尼里克乡,于塔里木大学动物试验站饲养。将绵羊皮肤局部麻醉,体侧羊毛去除一部分,用直径为1 cm的取样器采集样品,保存于液氮中备用,后期对绵羊进行护理以至痊愈,手术程序严格遵循动物伦理福利要求。
1.1.2 主要试剂与仪器
真核表达载体pEGFP-N1购于上海迪奥生物科技有限公司,T4DNA连接酶、限制性内切酶HindIII、PstI均为宝生物工程有限公司产品;SanPrep‘柱式’质粒DNA小提抽提试剂盒购于生工生物工程(上海)股份有限公司;梯度PCR仪(Veriti)购自ABI公司;低速台式离心机(TDL-80-2B)购自上海安亭科学仪器厂;凝胶分析系统(GELDOC 2000)购自Bio-Rad公司;Motic显微镜(CX21)购自上海团结仪器厂。
1.2 方法
1.2.1 引物设计
参照GenBank中的绵羊KAP1.1基因组序列(登录号:HQ110109.1),利用DNAstar软件设计引物,引物序列如下:F:5′-AAGCTTATGGCCTGCTGTTCC ACC-3′(下划线为HindIII的酶切位点),R:5′-CTG CAGTCAGCAGGTGGGCTC-3′(下划线为PstI的酶切位点)。引物由上海生工生物工程技术服务有限公司合成。
1.2.2 总RNA提取及cDNA的合成
用Trizol法提取山区型和田羊皮肤组织总RNA,利用分光光度计检测样品浓度,参照反转录试剂盒说明书,以Oligo d(T)为引物,反转录获得样品的cDNA。
1.2.3 PCR扩增
以cDNA为模板进行PCR扩增。PCR反应体系共20 μL:10×Ex PCR 缓冲液(无Mg2+)2.5 μL,25 mM MgCl23 μL,dNTP 1 μL,DMSO 0.3 μL,Ex Taq 酶 0.1 mL,Bio-H2O 11.9 μL,上、下游引物各 0.5 μL,cDNA模板0.2 μL。PCR反应条件为:94℃预变性11 min;94℃变性45 s,60℃退火45 s,72℃延伸1 min,35个循环;72℃总延伸10 min。PCR扩增产物用1%的琼脂糖凝胶进行电泳检测。
1.2.4 重组质粒pMD18-T-KAP1.1的构建与鉴定
将电泳检测分析正确的绵羊毛囊KAP1.1基因用胶回收试剂盒回收目的片段连接pMD18-T载体,构建重组质粒pMD18-T-KAP1.1,将重组质转化大肠杆菌DH5α感受态细胞中,37℃培养过夜,利用蓝白斑挑选阳性菌,接种到氨苄抗性的LB液体培养基中,37℃恒温培养,取菌液,按质粒提取试剂盒操作步骤提取质粒pMD18-T-KAP1.1。对重组质粒进行PCR鉴定及PstI、HindIII双酶切鉴定,同时将鉴定正确的阳性菌送至公司进行测序。
1.2.5 重组质粒pEGFP-N1-KAP1.1的构建与鉴定
将pMD18-T-KAP1.1重组质粒和真核表达载体pEGFP-Nl分别用HindIII和PstI双酶切,37℃恒温水浴过夜,用1%琼脂糖凝胶电泳检测,观察结果并拍照保存。利用胶回收试剂盒回收KAP1.1基因目的片段和真核表达载体pEGFP-N1片段,将两者用T4 DNA连接酶16℃金属浴连接过夜,构建真核表达pEGFP-N1-KAP1.1重组质粒,转化大肠杆菌DH5α感受态细胞,37℃恒温培养在含卡那抗性的LB固体培养基上并过夜,挑选阳性菌,接种到卡那抗性的LB液体培养基中,取菌液用质粒提取试剂盒提取真核表达重组质粒pEGFP-N1-KAP1.1,对真核表达重组质粒进行PCR鉴定和双酶切鉴定,将鉴定正确的阳性菌送至公司测序。
1.2.6 生物信息学分析
采用MEGA6.0软件对KAP1.1基因序列进行分析;采用ProtParam在线软件对KAP1.1基因编码蛋白基本理化性质进行分析;采用SOPMA对KAP1.1蛋白进行二级结构预测;用ExPASy在线软件中的TMpred对KAP1.1基因编码蛋白跨膜区域及方向进行预测;利用ProtScate在线软件对KAP1.1基因编码蛋白亲疏水性进行分析;利用MEGA6.0软件对KAP1.1基因的同源性进行分析,并构建系统发育树。
2 结果与分析
2.1 和田羊毛囊KAP1.1基因PCR扩增结果
以山区型和田羊皮肤组织毛囊的cDNA为模板进行PCR扩增,经1%琼脂糖凝胶电泳检测,在519 bp处出现目的条带(图1),与预期片段大小一致。

图1 山区型和田羊毛囊KAP1.1基因PCR扩增结果
2.2 重组质粒pMD18-T-KAP1.1的鉴定
对重组质粒pMD18-T-KAP1.1进行HindIII、PstI双酶切鉴定,结果见图2。由图2可知,约在2 692 bp和519 bp处均出现目的条带,与理论条带大小相符,表明重组质粒pMD18-T-KAP1.1构建成功。

图2 pMD18-T-KAP1.1克隆质粒双酶切鉴定结果
2.3 真核表达重组质粒pEGFP-Nl-KAP1.1的鉴定
对重组质粒pEGFP-Nl-KAP1.1进行PCR和HindIII、PstI双酶切鉴定,结果见图3和图4。由图3可知,在约519 bp处出现目的条带,与KAP1.1基因大小相符;由图4可知,约在4 700 bp和519 bp处均出现目的条带,与理论条带大小相符。

图3 pEGFP-Nl-KAP1.1真核表达重组质粒的PCR鉴定

图4 pEGFP-Nl-KAP1.1真核表达重组质粒的双酶切鉴定
2.4 毛囊KAP1.1基因序列比对及分析
2.4.1 核苷酸序列比对
对山区型和田羊毛囊KAP1.1基因序列与Gen-Bank中KAP1.1基因序列进行比对,结果表明,山区型和田羊毛囊KAP1.1基因与GenBank中的美利奴羊KAP1.1基因序列同源性可达98.65%。第38位碱基T变为C、第39位碱基C变为T、第42位碱基T变为C、第394位碱基T变为C、第441位碱基C变为T、第461位碱基G变为T、第484位碱基A变为G(图5),说明KAP1.1基因表达载体构建成功。
2.4.2 氨基酸序列比对
与美利奴羊对比,山区型和田羊毛囊KAP1.1蛋白第13位Ile突变为Thr;第132位Tyr突变为His;第154位Cys突变为Phe、第162位Ile突变为Val。其氨基酸比对结果(图6)。

图5 美利奴羊和山区型和田羊毛囊KAP1.1基因序列比对结果(仅列出有差异的片段)

图6 美利奴羊和山区型和田羊毛囊KAP1.1基因氨基酸序列比对结果(仅列出有差异的片段)
2.5 KAP1.1基因编码蛋白的性质分析
2.5.1 基本理化性质分析
用在线ProtParam软件对绵羊KAP1.1基因编码蛋白的基本理化性质进行分析,结果显示:与Gen-Bank中美利奴羊对比,山区型和田羊KAP1.1基因编码蛋白的原子总数,平均疏水性和脂肪酸系数略低于美利奴羊。其中,山区型和田羊KAP1.1蛋白不稳定系数为71.73(>40),说明该蛋白不稳定;脂肪族氨基酸系数为35.70,理论等电点为7.13,为典型的中性蛋白。
2.5.2 KAP1.1蛋白的二级结构预测
利用SOPMA在线软件工具预测KAP1.1蛋白的二级结构,与GenBank中美利奴羊对,结果表明,和田羊与美利奴羊KAP1.1蛋白二级结构基本相同,其中无规则卷曲占大部分,α-螺旋、延伸链较少,无β-转角(表1)。无规则卷曲受侧链相互作用的影响很大,α-螺旋是手性结构,具有旋光能力,其稳定性与它的氨基酸组成和序列有极大关系。
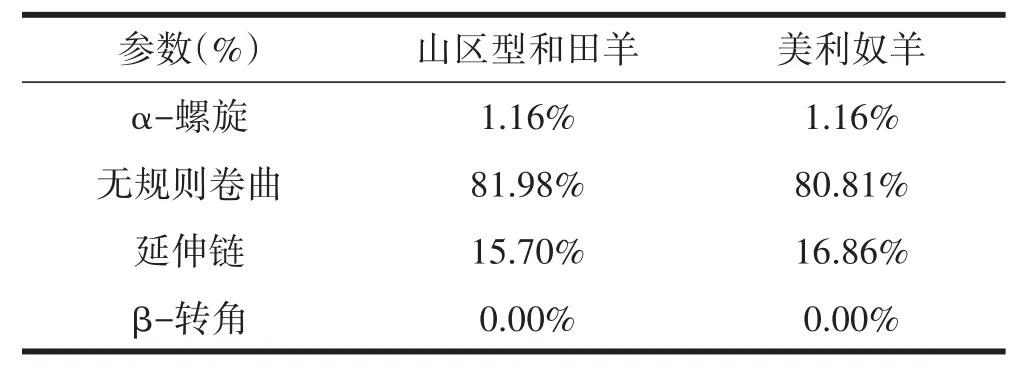
表1 毛囊KAP1.1蛋白二级结构预测
2.5.3 KAP1.1蛋白的跨膜区分析
利用在线TMpred工具对KAP1.1基因编码蛋白跨膜区和方向进行预测,结果显示,山区型和田羊KAP1.1基因编码蛋白由膜内向膜外可能存在3个跨膜区域,主要集中在第9、88、121位氨基酸处,由膜外向膜内可能存在3个跨膜区域,主要集中在第10、90、121位氨基酸处(图7)。由此可见,KAP1.1基因编码蛋白视为跨膜蛋白。

图7 KAP1.1蛋白跨膜结构预测
2.5.4 KAP1.1蛋白的亲疏水性分析
利用在线ProtScate工具对KAP1.1基因编码蛋白亲疏水性进行预测分析,结果显示,KAP1.1基因编码序列存在较多亲水性和疏水性区域,说明KAP1.1基因编码蛋白序列一部分蛋白表现为疏水性,一部分表现为亲水性(图8)。

图8 KAP1.1蛋白的亲疏水性分析
2.5.5KAP1.1基因的聚类分析
利用MEGA6.0软件对不同物种KAP1.1基因序列进行聚类分析,并构建系统发育树(图9)。结果表明,山区型和田羊与美利奴羊最先聚集在一起,表明其亲缘关系较近。

图9 KAP1.1基因与其他物种间聚类分析
3 讨论与结论
随着我国纺织行业的不断发展,羊毛在现代纺织工业中的作用日益显著。细毛羊在草食畜动物牧业发展中占有重要地位[16],是畜牧业重要的经济来源。新疆是我国绵羊主要生产地之一,和田羊作为南疆地方品种,独特的地理环境使和田羊具有被毛两型毛多,长且均匀的特点,羊毛富有弹性,且光泽和洁白度良好,是纺织工业的优质原料。但也存在体型较小、产毛量、产肉率和繁殖率低等缺点。
试验选取和田羊毛囊作为材料,通过基因克隆等分子生物学手段获得和田羊毛囊KAP1.1基因序列大小为519 bp,可编码172个氨基酸。利用BLAST软件将GenBank中美利奴羊(HQ110109.1)与山区型和田羊的KAP1.1基因测序结果进行序列比对。结果表明:山区型和田羊与GenBank中美利奴羊序列碱基同源性高达98.65%,氨基酸同源性达97.09%。其中有7个碱基发生突变,由于遗传密码的简并性,只是引起了4处氨基酸发生变异,其中,第162位Ile突变为Val,但对蛋白质的结构和功能影响不大,至于第13位的Ile变异为Thr、第132位Tyr变异为His、第154位Cys突变为Phe,对蛋白质的结构和功能造成的影响需要进一步的生物试验支持。
利用SOPMA在线软件对二级结构的预测可知,KAP1.1蛋白二级结构主要由无规则卷曲组成,此结构常与酶活性部位和蛋白质特异功能有关[17],由此推测无规则卷曲是构成该蛋白的主要结构元件。α-螺旋含量极少,α-碳是手性结构,具有旋光能力,其稳定性与它的氨基酸组成和序列有极大关系,脯氨酸是一个结构比较特殊的氨基酸,脯氨酸的α-碳参与R基吡咯的形成,环内的N-Cα建不能旋转,且脯氨酸的肽键不具有酰胺氢,不能形成氢键,因此,多肽链中只要存在脯氨酸,α-螺旋即被中断[18]。在水溶液中脯氨酸缺乏能与螺旋i-4位置[19]的羰基形成氢键的酰胺质子并且影响其前一位置氨基酸残基的扭转角[19],从而主要以伸展的构象存在。因此,在水溶性蛋白中脯氨酸被认为是螺旋结构的破坏者[20]。由于脯氨酸是影响α-螺旋的主要原因之一,由氨基酸序列比对结果可知,氨基酸序列中脯氨酸含量并不少,推测氨基酸序列中脯氨酸含量会影响α-螺旋形成,至于脯氨酸含量是否为影响α-螺旋结构的决定性因素,还需更进一步地试验加以验证。
跨膜区分析结果表明,KAP1.1基因编码蛋白由膜内向膜外、膜外向膜内各有3个跨膜区域,由此可推测KAP1.1蛋白为跨膜蛋白。亲疏水性分析结果显示KAP1.1蛋白一部分蛋白表现为疏水性,一部分表现为亲水性,结合跨膜区分析,KAP1.1蛋白为跨膜蛋白,跨膜蛋白包括外周蛋白和内在蛋白。因此,外周蛋白则表现为亲水性,内在蛋白则表现为疏水性。
山区型和田羊与不同物种间KAP1.1基因系统发育树[21]的结果反映了各物种间的亲缘关系和进化关系,遗传距离越小,亲缘关系越接近,同源性越高[22]。山区型和田羊与美利奴羊最先聚集在一起,证明亲缘关系最近,而野猪和犬与其他物种的差异特别大。
由于KAP含量可影响羊毛品质[23]且KAP含量变化和数量有可能是决定羊毛品质的一个重要因素,是编码羊毛的结构蛋白基因之一,对羊毛的细度,强度,长度,光泽等品质有重要作用,KAP1.1基因成熟蛋白编码序列高度保守,因此山区型和田羊KAP1.1基因可能是会影响羊毛的品质的因素之一。
试验以新疆特色动物山区型和田羊为研究对象,成功构建了毛囊KAP1.1基因的表达载体,并对该基因的核苷酸和氨基酸序列进行了生物信息学分析。该研究将为探究南疆地方品种和田羊羊毛品质提供一定的实验数据,毛囊KAP1.1基因表达载体的构建为进一步制备多克隆抗体提供了基础材料,为深入探索绵羊功能性蛋白的表达提供理论依据。
