小分子烷烃与烯烃在离子液体中的溶解性能
2020-10-27张睿董淑媛伍洛刘植昌徐春明刘海燕孟祥海
张睿,董淑媛,伍洛,刘植昌,徐春明,刘海燕,孟祥海
(中国石油大学(北京)重质油国家重点实验室,北京102249)
引 言
乙烯、丙烯等小分子烯烃是石油化工的基本原料,由其可生产出众多化工产品,市场对小分子烯烃的需求量逐年增加。小分子烯烃主要来源于蒸气裂解、催化裂解和催化裂化[1−2],近些年来甲醇制烯烃[3]、烷烃催化氧化脱氢制烯烃[4]等技术也越来越受到重视。而上述过程均得到小分子烯烃与烷烃的混合物,将其进行分离是高附加值烯烃合理利用的前提。
目前,小分子烯烃与烷烃的分离技术主要包括低温精馏、萃取精馏、吸收分离、膜分离、吸附分离等方法[5−8]。吸收是气体分离的重要手段,离子液体(ionic liquid,IL)作为一类新型的绿色溶剂,具有良好的热稳定性与极低的挥发性,且离子液体的极性可调、阴阳离子结构可设计,对众多气体表现出不同的选择性溶解能力,在气体吸收分离领域备受关注[9−12]。离 子 液 体 可 用 于 酸 性 气 体(CO2、SO2、H2S)[13−16]、小 分 子 烃 类(烷 烃、烯 烃、二 烯 烃、炔烃)[17−20]的吸收分离,并表现出良好的选择性分离效果。
众多学者在离子液体选择性溶解分离小分子烃类方面开展了大量高效的研究。Jacquemin等[21−22]考察了甲烷、乙烷、乙烯等小分子烃类在[Bmim][BF4]、[Bmim][PF6]离子液体中的溶解度,发现乙烯的溶解度显著高于甲烷和乙烷的溶解度,随着温度的降低和压力的升高,小分子烃类在离子液体中的溶解度增大。Lee 等[23]研究表明,丙烯、丁烯在离子液体中的溶解度比丙烷、丁烷的溶解度大。Fallanza等[24]用真实溶剂似导体屏蔽模型(COSMO−RS),分析了不同离子液体对丙烷和丙烯的溶解度及丙烯/丙烷的选择性,发现随气体在离子液体中溶解度的降低,溶解选择性会相应提高;对咪唑类、吡啶类、吡咯类离子液体,阳离子结构的不同对气体溶解度影响不大。
Kilaru等[25]研究了乙烯、丙烯、丁烯、丁二烯等气体在咪唑类、季磷盐类等离子液体中的溶解度,发现丁二烯在考察的多种离子液体中的溶解度均比其他几种烃类的溶解度大,其在[Emim][Tf2N]中的溶解度为0.0910 mol/mol,在[C6mim][Tf2N]中溶解度达到0.116 mol/mol。Palgunadi 等[26]研究发现咪唑类离子液体可用于乙炔和乙烯的分离,并表现出较好的乙炔/乙烯选择性,且离子液体的阴离子比阳离子对溶解度影响更大。Xing等[27]利用分子动力学模拟的方法探究了乙烯和乙炔在五种离子液体中的溶解机理,发现乙烯溶解时阳离子与乙烯之间的范德华力起着重要作用,而乙炔与阴离子间的氢键作用决定了其在离子液体中的溶解能力。
综合文献报道,可以发现小分子烃类在离子液体中的溶解度随烃类分子不饱和度的增大而增大,二烯烃和炔烃的溶解度显著高于同碳数的烯烃和烷烃的溶解度,烯烃的溶解度显著高于同碳数的烷烃的溶解度。对于乙烯/乙烷、丙烯/丙烷的吸收分离,尽管多种离子液体表现出了较好的实验结果,但是烯烃/烷烃的溶解选择性仍然不够高,大多在3以下[28]。
为了提升烯烃/烷烃的溶解选择性,研究者将含有Cu(Ⅰ)、Ag 的盐溶解到离子液体中形成复配溶剂,可以大幅提升溶解选择性[29−32]。Galan等[29,33]研究发现,在离子液体中溶解含Ag 的盐形成复配溶剂,能够显著增大乙烯或丙烯的溶解度,而对乙烷或丙烷的溶解度影响不大,进而能大幅提升乙烯/乙烷的溶解选择性。复配溶剂也能增大丙烯/丙烷的溶解选择性,在25℃和0.1 MPa 的条件下,丙烯/丙烷在[Bmim]SCN−CuSCN 复配溶剂中的溶解选择性可高达10以上[34]。
无论是报道的离子液体,还是离子液体与金属盐的复配溶剂,相比传统的分离溶剂都存在成本高的弊端。在溶解度和溶解选择性相近的情况下,降低离子液体的成本是其工业化的重要因素。鉴于此,本文针对成本相对较低的铵盐类离子液体,研究其对小分子烯烃与烷烃的溶解性能,以及离子液体的重复使用性能。
1 实验材料和方法
1.1 材料
实验所用原料包括盐酸三乙胺(Et3NHCl)、盐酸二乙胺(Et2NH2Cl)、盐酸乙胺(EtNH3Cl)、盐酸三甲胺(Me3NHCl)、盐酸二甲胺(Me2NH2Cl)等盐酸铵盐,纯度均≥99%;CuCl(≥99.8%)、AlCl3(≥98%)、FeCl3(≥98%)、FeCl2(≥99.9%)等Lewis 酸,购自阿拉丁试剂(上海)有限公司。1−丁基−3 甲基咪唑氯盐([Bmim]Cl,≥97%)与1−丁基−3−甲基咪唑四氟硼酸盐([Bmim][BF4],≥97%)购自上海成捷化学有限公司。乙烯、乙烷、丙烯、丙烷、异丁烷、异丁烯等小分子烃类,纯度均≥99.9%,购自北京市北温气体制造厂。气相色谱检测所用的高纯氮气、氢气、空气购自北京氦普北分气体工业有限公司。
1.2 气体溶解度与溶解速率的测定方法
利用体积法测量原理,设计了如图1 所示的实验装置,用于测量溶解度较小的气体在离子液体中的溶解度。该实验装置由原料气注入系统、气体溶解系统、抽真空系统、压力传感记录系统四部分组成。
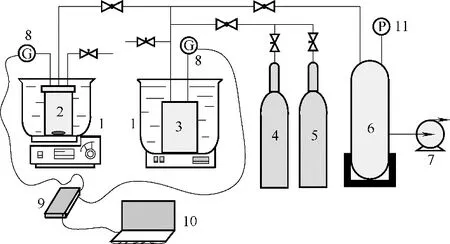
图1 气体溶解度测试装置Fig.1 Gas solubility testing equipment
溶解度的测定方法及操作步骤如下:向气体溶解器(110 ml)内加入一定量的离子液体后密封,将气体溶解器和气体罐(216 ml)放入恒温水浴(或油浴)中保持恒温。开启抽真空系统,将气体罐和气体溶解器抽真空,当真空度接近1.0×105Pa 时关闭抽真空系统。打开阀门向气体罐内注入一定量的气体后关闭阀门,开启压力传感系统。打开气体溶解器和气体罐之间的球阀,使气体罐内的气体进入气体溶解器,关闭阀门后开启磁力搅拌器,加快气体在离子液体中的溶解。为测定一定压力下气体的溶解度,需不断向气体溶解器内充入气体,直到压力不再变化,溶解达到平衡。根据实验前后气体罐与气体溶解器内的压力、体积以及离子液体加入量、系统温度,可以计算出该测试条件下气体在离子液体中的溶解度。根据压力传感器实时采集的数据,可以计算出气体在离子液体中的溶解速率。烃类溶解度为每摩尔离子液体溶解的烃类物质的量(mol/mol),可通过式(1)进行计算;烯烃/烷烃溶解选择性为烯烃溶解度与烷烃溶解度的比值,可通过式(2)进行计算;气体在离子液体中的溶解速率可通过式(3)进行计算。
利用上述实验装置也可测定烷烃与烯烃混合物在离子液体中的溶解性能。根据溶解前后的压力数据、容器体积数据、离子液体加入量、系统温度以及溶解前后气体的组成数据,可以计算出烷烃和烯烃在气相和离子液体相的分配吸收和分离选择性。

1.3 离子液体中溶解气体的解吸测定方法
当气体在离子液体中达到溶解平衡后,不断升高水浴温度,使溶解在离子液体中的气体逐渐解吸。开启抽真空系统,将缓冲罐和气体罐抽真空,当真空度接近1.0×105Pa 时关闭抽真空系统。打开球阀,使气体溶解器内已解吸出的气体进入已抽完真空的气体罐内。不断重复以上操作,直至气体溶解器内的气体压力不再变化,此时气体解吸达到平衡。根据实验前后气体罐与气体溶解器内的压力、体积以及离子液体用量、系统温度、溶解度数据,可以计算出该条件下离子液体中气体的解吸率。
2 实验结果与讨论
2.1 离子液体吸收剂的优选
根据实验材料部分列出的阳离子供体和阴离子供体,合成了一系列离子液体。在温度30℃、压力0.2 MPa 及转速800 r/min 的操作条件下,考察了离子液体对乙烯和乙烷的溶解性能,结果见表1。当离子液体的阴离子供体相同时,铵盐类和咪唑类离子液体对乙烯、乙烷的溶解性能比较接近,即两种阳离子供体的影响不大。因此从离子液体生产成本的角度考虑,选用价格相对较低的铵盐类作为离子液体的阳离子供体。当离子液体的阳离子供体相同时,CuCl 作为阴离子供体时合成的离子液体对乙烯/乙烷的溶解选择性最高,因此选择CuCl 作为阴离子供体进行后续研究。同时发现,当阴阳离子供体的摩尔比不同时,所合成的离子液体对乙烯、乙烷的溶解性能有着一定的影响,因此后续需要进一步考察离子液体阴阳离子供体配比的影响规律。
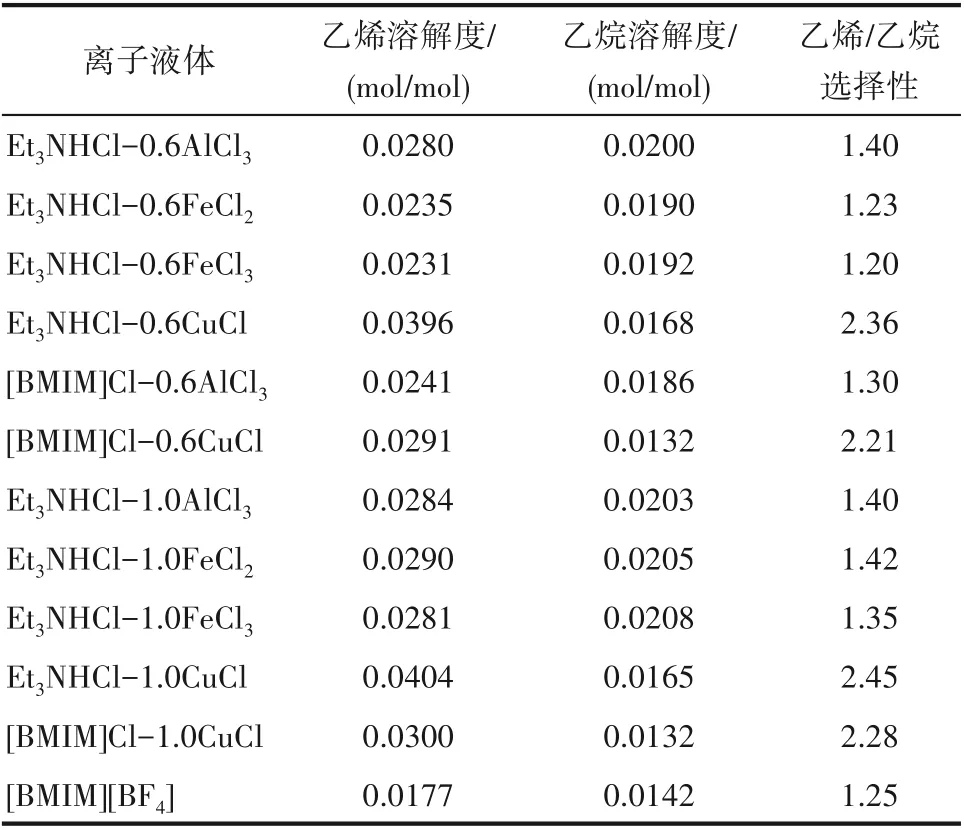
表1 离子液体种类对乙烯与乙烷的溶解度和溶解选择性的影响Table 1 Effect of ionic liquid types on solubility and solubility selectivity of ethene and ethane
针对优选出的铵盐类阳离子供体,固定阴阳离子供体的摩尔比为1∶1,选择具有不同烷基链长度和烷基个数的盐酸铵盐,与CuCl合成了一系列离子液体,之后筛选了5 种黏度和熔点相对较低的离子液体,在温度100℃、压力0.2 MPa 及转速800 r/min的操作条件下,考察了离子液体对乙烯和乙烷的溶解性能,结果见表2。当阳离子供体的烷基链长度相同时,烷基数增大,所合成离子液体对乙烯和乙烷的溶解度都增大,乙烯/乙烷溶解选择性也呈增大趋势。当阳离子供体的烷基数相同时,烷基链增长,所合成离子液体对乙烯和乙烷的溶解度略有增大,但是对乙烯/乙烷溶解选择性影响不大。从对乙烯 乙 烷 溶 解 的 角 度 考 虑,Et3NHCl−1.0CuCl 与Me3NHCl−1.0CuCl 两种离子液体的性能接近,但是后者的熔点(68℃)偏高,无法在低温下溶解烃类,因此优选盐酸三乙胺作为离子液体的阳离子供体。
实验发现离子液体中CuCl 的含量会影响小分子烷烃与烯烃的溶解性。调变Et3NHCl与CuCl的摩尔比合成了一系列离子液体,在温度30℃、压力0.2 MPa 及转速800 r/min 的操作条件下,考察了离子液体对乙烯和乙烷的溶解性能,结果见表3。对于Et3NHCl−xCuCl 离子液 体,当x<2.1 时,随着CuCl/Et3NHCl 摩尔比的增加,离子液体中乙烯的溶解度和乙烯/乙烷溶解选择性逐渐增大,乙烷的溶解度逐渐减小。但当2.1≤x≤2.4 时,CuCl/Et3NHCl 摩尔比对乙烯、乙烷的溶解度和乙烯/乙烷溶解选择性影响不大。在离子液体合成过程中,当x≥2.2 时,CuCl 并未完全溶解,因此CuCl 与Et3NHCl 的最佳摩尔比为2.1∶1,此时乙烯/乙烷的溶解选择性可达8.78。已有文献报道,含Cu(Ⅰ)或Ag 的离子液体或离子液体与Cu(Ⅰ)盐或Ag 盐的复配溶剂可以与烯烃的不饱和键之间有较强的相互作用,表现出对烯烃的溶解度较大[19,29,34]。Cu(Ⅰ)盐或Ag 盐与烯烃不饱和键之间的作用通过计算机模拟得到了验证和解释[35]。烯烃的双键能够与含有空轨道的Cu(Ⅰ)发生π 络合,使乙烯在离子液体中的溶解度增大,这是CuCl类离子液体对乙烯溶解度远高于其他Lewis 酸类离子液体的主要原因。综上,优选出的用于小分子烯烃和烷烃溶解分离的离子液体是Et3NHCl−2.1CuCl。该离子液体的密度(30℃)、黏度(30℃)和熔点分别是1.7361 g/ml、272 mPa·s和−66℃。
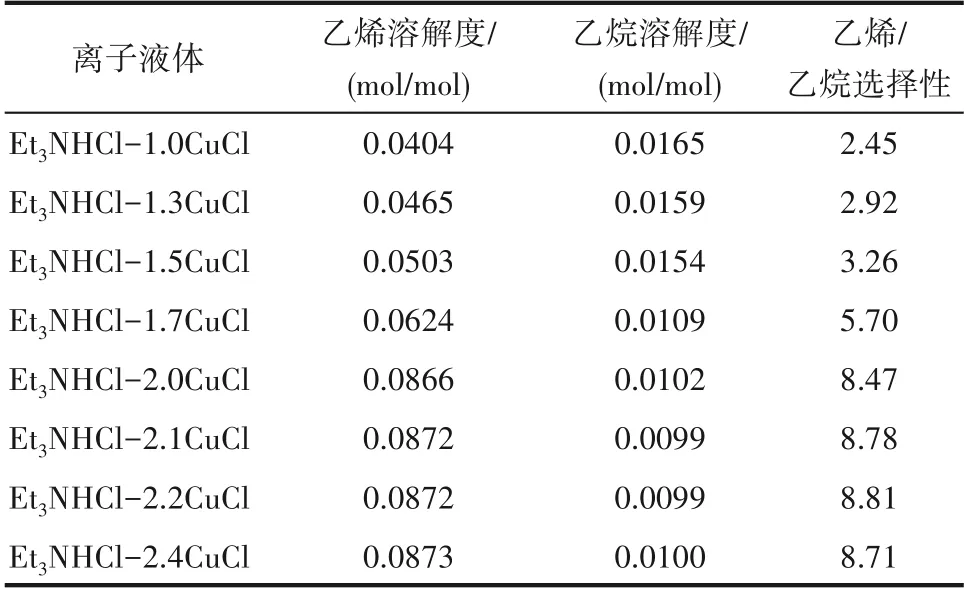
表3 CuCl/Et3NHCl摩尔比对乙烯与乙烷的溶解度和溶解选择性的影响Table 3 Effect of CuCl/Et3NHCl molar ratio on solubility and solubility selectivity of ethene and ethane
2.2 离子液体Et3NHCl-2.1CuCl 对小分子烷烃与烯烃的溶解规律
2.2.1 温度对小分子烷烃与烯烃溶解度的影响 针对优选出的Et3NHCl−2.1CuCl 离子液体,在压力0.2 MPa、转速800 r/min 的条件下,在30~70℃范围内考察了温度对小分子烷烃和烯烃溶解性能的影响规律,结果见表4。随温度的升高,小分子烃类在离子液体中的溶解度呈现减小的趋势,且烯烃溶解度的减小幅度比烷烃的明显。温度从30℃升高到70℃,烯烃/烷烃溶解选择性也呈现减小的趋势,且乙烯/乙烷溶解选择性与丙烯/丙烷溶解选择性减小幅度较大,分别达到了52%和49%;而异丁烯/异丁烷溶解选择性减小较为缓慢,降幅仅为16%。
烃类在离子液体中的溶解包括化学溶解和物理溶解,化学溶解为放热效应,升高温度不利于气体的溶解。以物理作用溶解在离子液体的烃类,分子的热运动速率随着温度的升高而加大,容易从离子液体的表面逸出。烯烃的双键能够与离子液体中的Cu(Ⅰ)络合,烯烃与离子液体之间的作用包括物理作用和化学作用,因此其溶解包括物理溶解和化学溶解。烷烃与离子液体之间的作用主要是物理作用,其溶解主要为物理溶解。烯烃双键Cu(Ⅰ)的络合作用不强,温度对其影响较大,表现为升温后烯烃溶解度的降幅较大,而烷烃溶解度的降幅相对较小。实验考察范围内最佳的溶解温度为30℃,此时具有最大的烯烃/烷烃溶解选择性和最大的烯烃溶解度。
2.2.2 压力对小分子烷烃与烯烃溶解度的影响 针对优选出的Et3NHCl−2.1CuCl 离子液体,在温度30℃、转速800 r/min的条件下,在0.2~0.81 MPa范围内考察了压力对小分子烷烃和烯烃溶解性能的影响规律,结果见表5。压力从0.2 MPa 升高到0.81 MPa,小分子烃类在离子液体中的溶解度呈现增大的趋势,且烷烃溶解度的增大幅度比烯烃的明显,乙烯和丙烯溶解度分别增加到初始的2.76倍和2.71倍,而乙烷和丙烷溶解度分别增大到初始的6.83 倍和4.27 倍;受此影响,烯烃/烷烃溶解选择性呈现减小的趋势,且乙烯/乙烷溶解选择性与丙烯/丙烷溶解选择性的降幅分别达到了60%和37%。受饱和蒸气压的影响,异丁烷和异丁烯的溶解度仅在0.3 MPa 以下进行测试,得到的溶解规律跟乙烷、乙烯、丙烷、丙烯是相似的。
由广义的亨利定律可知,在一定温度下,当气体溶解达到平衡时,气体在此溶液中的溶解度和气相中该气体的分压呈正比,而离子液体对气体的物理溶解在一定程度上符合广义亨利定律。伴随压力的升高,烃类在离子液体中的物理溶解和化学溶解都会增大,且物理溶解的增大幅度比化学溶解的大,因此物理溶解的作用比例在逐步增大。表现为烯烃溶解度随压力升高的增幅较小,而烷烃溶解度的增幅相对较大。实验考察范围内较为合适的压力为0.2 MPa,此时具有最大的烯烃/烷烃溶解选择性。
2.2.3 与文献报道的溶解性能对比 常规的离子液体对小分子烯烃/烷烃溶解选择性较低[28],将含Cu(Ⅰ)、Ag 的盐溶解到离子液体中形成复配溶剂可以大幅提升溶解选择性,本小节汇总了文献报道的一些较好的结果与本文的研究结果,如表6 所示。离子液体中溶解的Cu(Ⅰ)盐或Ag 盐越多,其对烯烃的溶解度和烯烃/烷烃选择性越高。离子液体中添加Ag盐得到的复配溶剂对小分子烃类表现出较高的溶解度和烯烃/烷烃选择性,这主要得益于Ag 盐中的阴离子对Ag+的作用。本文合成的离子液体在较为苛刻的条件下(较高的压力和温度)的丙烯/丙烷选择性,与文献报道的含有Cu(Ⅰ)盐的复配溶剂在较低的温度和压力下的丙烯/丙烷选择性相近,同时本文合成的离子液体具有更高的烯烃溶解度。
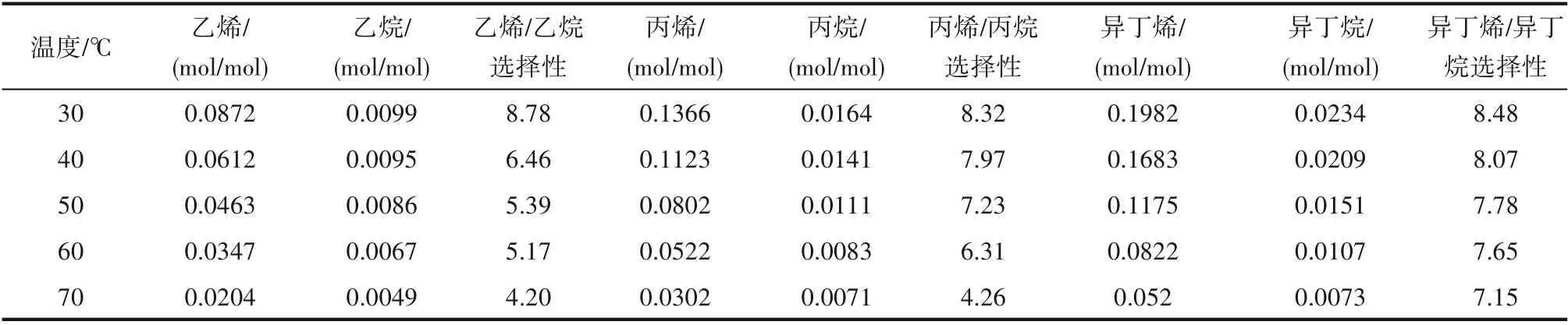
表4 温度对小分子烷烃与烯烃溶解度及溶解选择性的影响Table 4 Effect of temperature on solubility and solubility selectivity of alkanes and alkenes
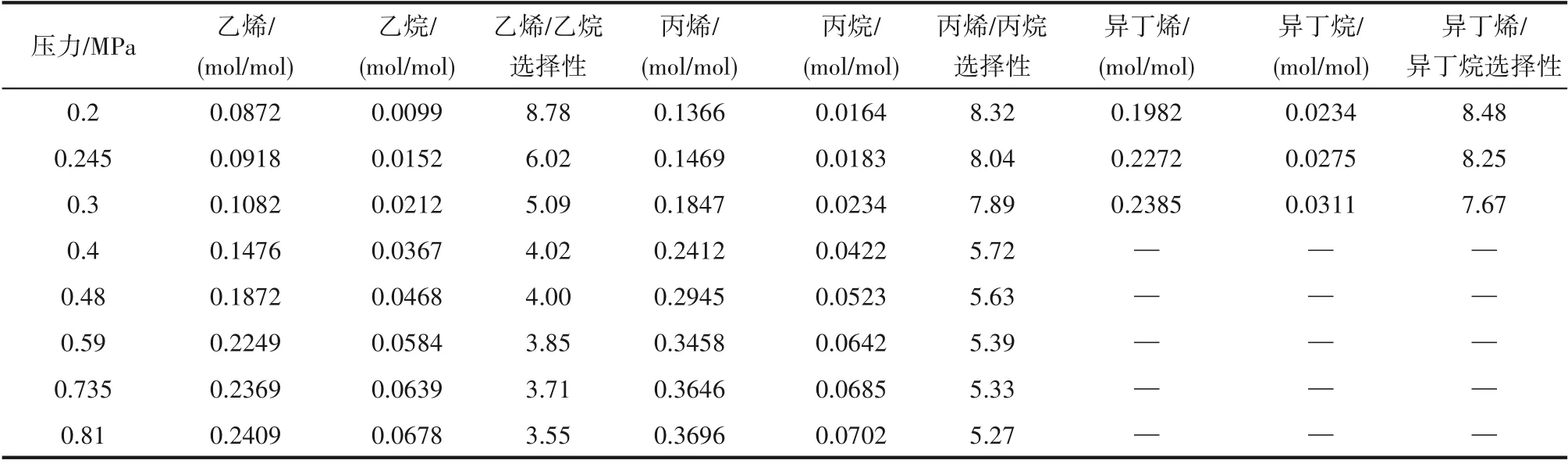
表5 压力对小分子烷烃与烯烃溶解度及溶解选择性的影响Table 5 Effect of pressure on solubility and solubility selectivity of alkanes and alkenes
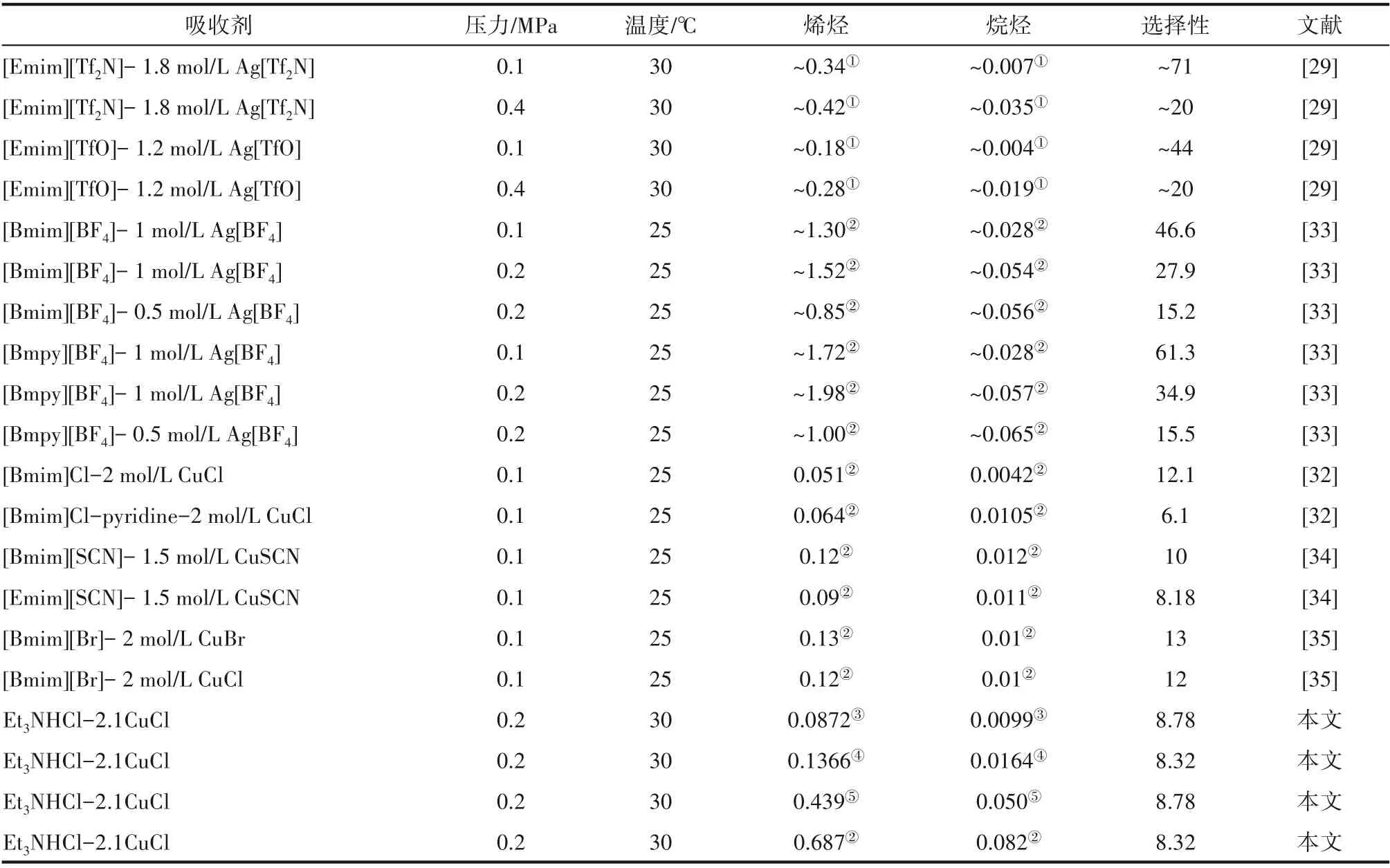
表6 小分子烷烃与烯烃在不同吸收剂中的溶解性能Table 6 Solubility of light alkanes and alkenes in different absorbents
2.3 离子液体中小分子烃类的溶解速率
对于气体吸收分离过程,溶解度和溶解速率是化工设计的重要参数,决定了操作过程和设备的效率。在初始压力0.2 MPa、离子液体加入量20 ml、转速为800 r/min 的条件下,研究了不同温度下丙烷、丙烯在离子液体Et3NHCl−2.1CuCl 中的溶解速率,结果如图2 所示。在温度30℃、转速为800 r/min 的条件下,研究了不同初始压力下乙烷、乙烯在离子液体Et3NHCl−2.1CuCl 中的溶解速率,结果如图3所示。
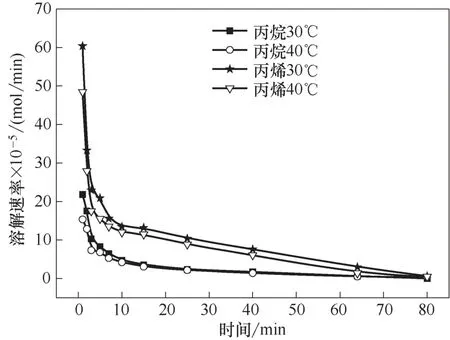
图2 不同温度下丙烷与丙烯溶解速率随时间的变化Fig.2 Dissolution rate of propane and propene as a function of time at different temperatures
随着溶解时间的延长,烯烃与烷烃的溶解速率均先快速减小,之后缓慢减小,最后接近于0。溶解的一开始,离子液体中没有烃类,气相中烃类的压力高,此时有较大的溶解推动力,溶解速率最大;伴随烃类在离子液体中的溶解,离子液体中烃类的浓度逐渐升高,气相中烃类压力逐渐减小,溶解推动力减小,溶解速率也减小。烯烃的溶解速率高于相应烷烃的溶解速率,但是烯烃达到溶解平衡所需的时间比相应的烷烃长。
在转速一定时,气体的溶解速率受温度和压力的影响。在较短的时间内,较低的温度和较高的压力有利于气体溶解;随着时间的延长,温度和压力对气体溶解速率的影响逐渐减小,当气体溶解接近平衡时,气体的溶解速率几乎为零。因此,为了提高离子液体对小分子烷烃和烯烃的分离效率,需要选择合适的操作温度和压力。
2.4 离子液体对小分子烷烃烯烃混合物的吸收分离
在温度30℃、压力0.2 MPa 的操作条件下,用离子液体Et3NHCl−2.1CuCl 对乙烷乙烯混合气、丙烷丙烯混合气进行吸收分离,混合气中烯烃体积分数为20%~80%。根据测试结果计算出了离子液体对混合气的烯烃/烷烃分离选择性,结果如图4 所示。随着烯烃在混合气中体积含量的增大,烯烃/烷烃分离选择性呈现下降趋势,且烯烃含量较低时下降幅度较大。在不同的原料配比下,烷烃与烯烃在离子液体中的平衡溶解量均随着其在混合气中含量的增加而增大,且烯烃的溶解量比烷烃的大。混合气中烯烃含量较低时,烯烃与Cu(Ⅰ)的络合比例较大,在离子液体相的分配系数较大,因此烯烃/烷烃的分离选择性较高。实验结果表明,离子液体对烯烃体积分数介于20%~50%之间的混合气具有良好的分离效果,不仅具有较高的烯烃/烷烃分离选择性,而且保证了对烯烃的溶解能力。
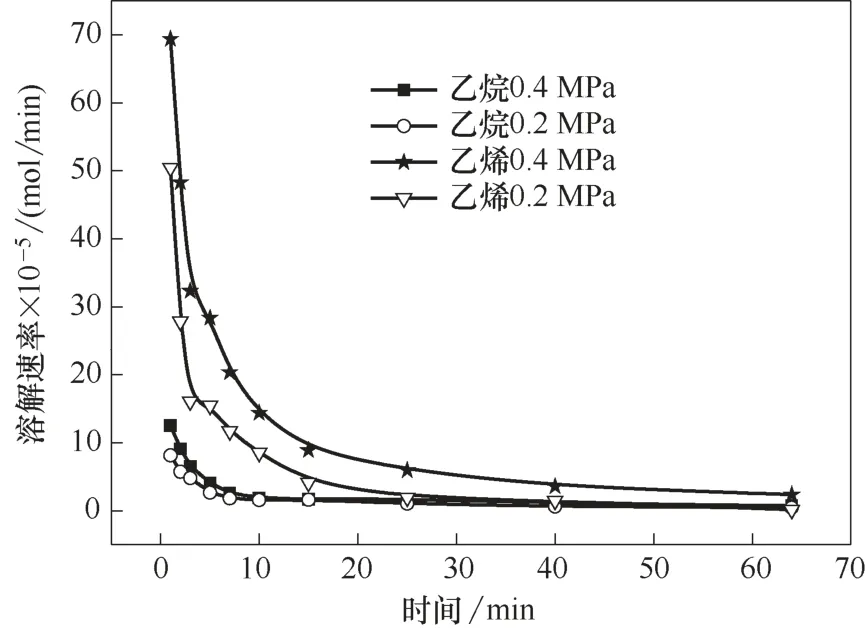
图3 不同初始压力下乙烷与乙烯溶解速率随时间的变化Fig.3 Dissolution rate of ethane and ethene as a function of time at different initial pressures
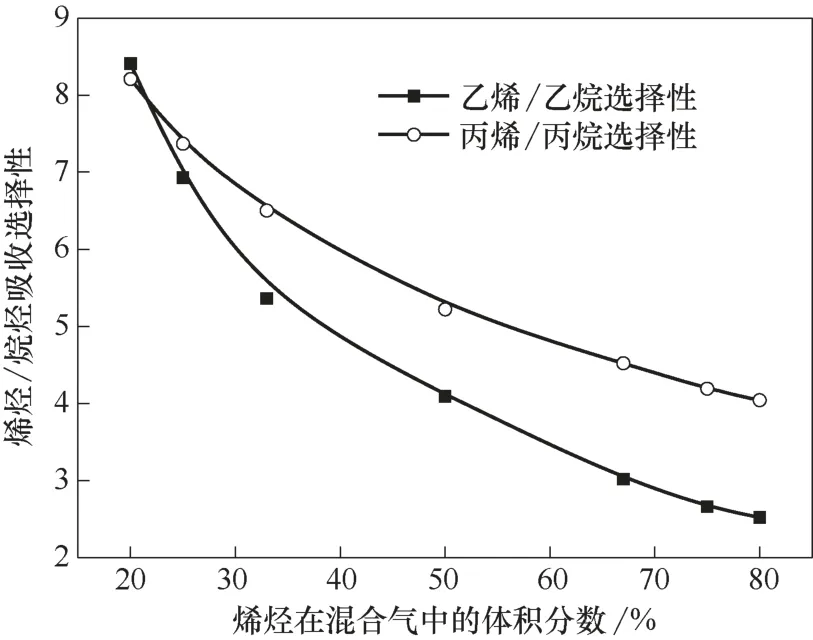
图4 不同原料配比下在离子液体中的烯烃/烷烃分离选择性Fig.4 Alkene/alkane separation selectivity in ionic liquid at different alkene contents
2.5 离子液体中小分子烃类的解吸
在适当条件下将离子液体中的烃类解吸出来,是离子液体循环利用的前提。烯烃在离子液体中的溶解主要是化学作用和物理作用的双重结果,而烷烃主要为物理溶解。烯烃双键与离子液体中的Cu(Ⅰ)发生的π 络合作用较弱,高温时络合作用容易被打破,释放出烯烃;在高温时物理溶解的烷烃和部分烯烃也容易释放出来。在温度30℃、压力0.2 MPa、转速800 r/min 的操作条件下,首先用Et3NHCl−2.1CuCl离子液体对气体进行溶解实验,当气体溶解达到平衡时开始对气体进行解吸,考察解吸温度和时间对解吸率的影响,结果见图5~图7。
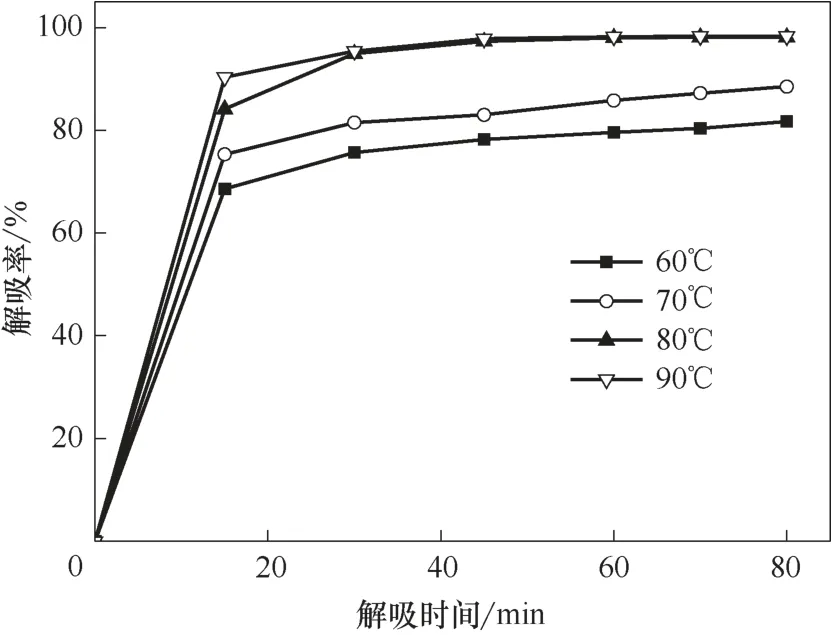
图5 不同温度下乙烷解吸率随解吸时间的变化趋势Fig.5 Desorption percentage of ethane as a function of desorption time at different temperatures
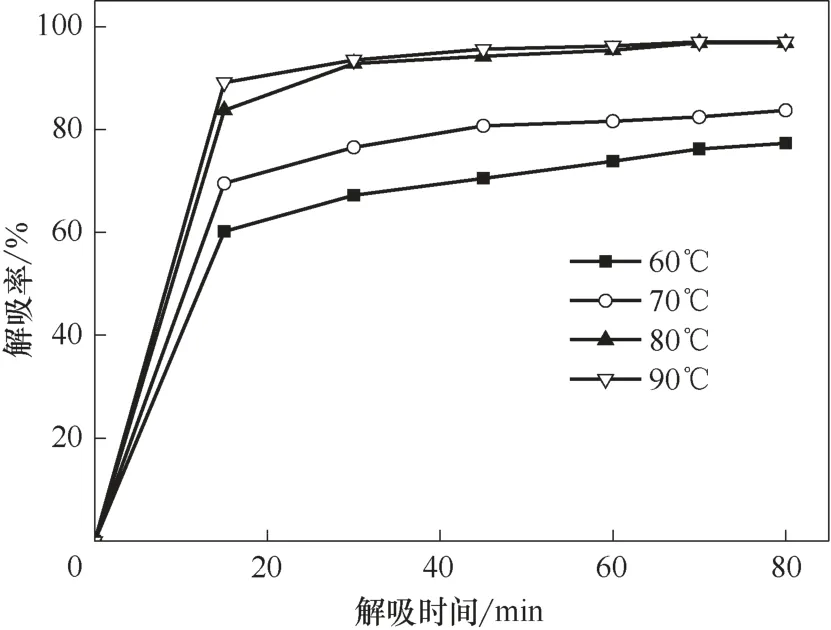
图6 不同温度下乙烯解吸率随解吸时间的变化趋势Fig.6 Desorption percentage of ethene as a function of desorption time at different temperatures
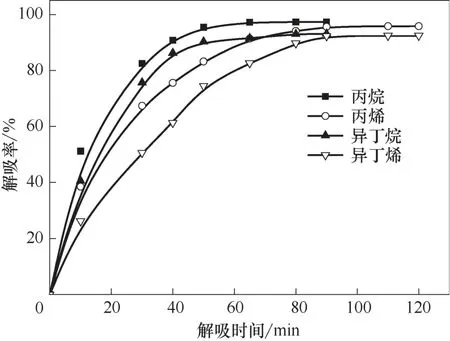
图7 80℃下丙烷、丙烯、异丁烷和异丁烯解吸率随解吸时间的变化趋势Fig.7 Desorption percentage of propane,propene,i−butane and i−butene as a function of desorption time at 80℃
无论烯烃还是烷烃,解吸率随解吸时间的延长先快速增大,在解吸一段时间后缓慢增大,直到解吸达到平衡。小分子的乙烷最容易解吸,较快达到解吸平衡;其次是乙烯,再次是丙烷和异丁烷,解吸最慢的是丙烯和异丁烯。相对来说,分子越小,解吸时间越短;烷烃比同碳数的烯烃容易解吸。温度对解吸率也有较大的影响,解吸率随温度的升高而增大,且随着解吸时间的延长,温度对解吸率的影响逐渐碱小。当温度高于80℃后,解吸率受温度的影响较小。
实验确定了小分子烃类较优的解吸条件和相应的解吸率,较优的解吸温度是80℃,乙烷在解吸时间40 min 的解吸率达97.2%,乙烯在解吸时间55 min的解吸率达95.4%,丙烷在解吸时间50 min的解吸率达94.8%,丙烯在解吸时间80 min 的解吸率为93.1%,异丁烷在解吸时间70 min 的解吸率为93.0%,异丁烯在解吸时间90 min 的解吸率为92.3%。分子越大,较优的解吸时间越长,相应解吸率也缓慢减小。
2.6 离子液体的重复利用
离子液体将溶解在其中的小分子烃类解吸之后,进一步考察其重复利用性能。将离子液体的第n 次重复利用效率定义为第n 次解吸后离子液体对烃类溶解度(或烷烃/烯烃选择性)与新鲜离子液体对烃类溶解度(或烷烃/烯烃选择性)的比值的百分数。
在温度30℃、压力0.2 MPa、转速800 r/min 的操作条件下,利用新鲜离子液体Et3NHCl−2.1CuCl 分别对小分子烷烃和烯烃进行吸收,当吸收达到平衡后,计算出溶解度;之后升高温度解吸溶解在离子液体中的气体直至解吸达到平衡。在上述相同的操作条件下,反复进行吸收−解吸实验,考察离子液体的重复利用性能,实验结果见表7。随着重复利用次数的增多,小分子烷烃和烯烃在离子液体中的溶解度均会缓慢减小,表现为离子液体重复利用效率缓慢减小;而烯烃/烷烃溶解选择性几乎没有变化。当离子液体重复利用5 次时,小分子烃类在离子液体中的溶解度相比其在新鲜离子液体中的溶解度的减小幅度基本在5%以内,说明离子液体的重复利用性能良好。
2.7 实验结果的量子化学计算解释
实验研究和文献报道均发现,离子液体的阴离子对小分子烯烃和烷烃的溶解性能影响较大,因此本节利用Gaussian 09 软件对前述离子液体的阴离子作用进行了分析计算。所有结构的优化和频率分析均在PBE0−D3 泛函结合自定义基组的水平下完成,所获得的结构为极小点结构,无虚频。自定义基组如下:对Al、Cl 选用6−311+G**基组,对Cu、Fe 选 用SDD 赝 势 基 组 和 赝 势,对C、H 选 用6−311G**基组。乙烯、乙烷与各种金属阴离子结合能的计算均在双杂化泛函RI−PWPB95−D3 结合ma−def2−QZVPP基组的水平下完成,通过ORCA 4.2[36]软件包实现。所有分子结构图的绘制通过Gaussian View 5.0.9实现,所有等值面图和平面图的得出和绘制由Multiwfn 3.7(dev)[37]和VMD 1.9.3[38]软件实现。
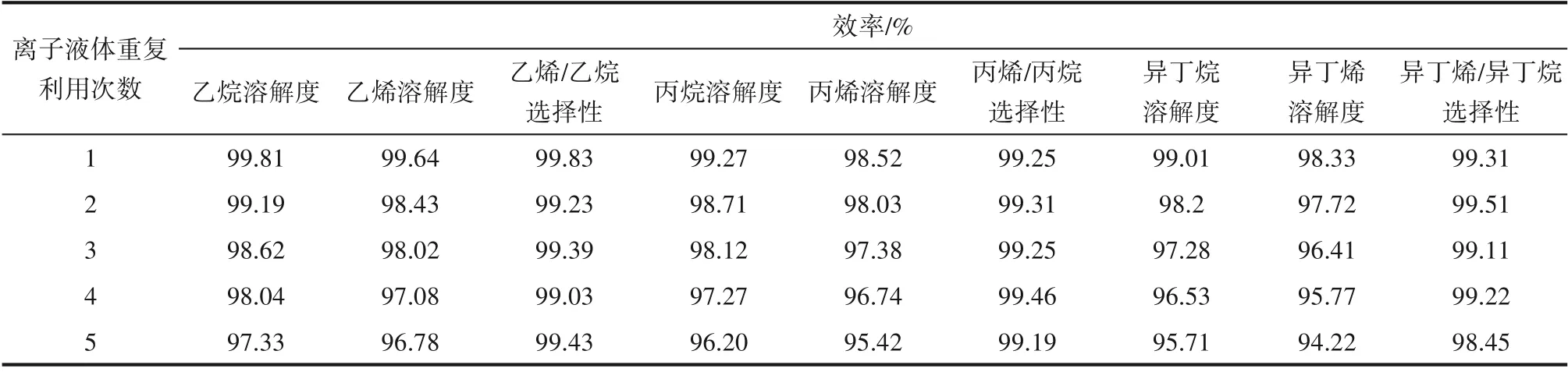
表7 离子液体对小分子烃类溶解的重复利用效率Table 7 Reusing efficiency of ionic liquid for dissolution of light hydrocarbons
在阳离子供体相同时,阴离子供体的不同对乙烯的溶解性有着显著影响,其中CuCl作为阴离子供体时合成的离子液体对乙烯/乙烷的溶解度最高。在离子液体中,当CuCl与阳离子供体的摩尔比小于1 时,其阴离子主要为[CuCl2]ˉ,当CuCl 与阳离子供体的摩尔比大于1 时其阴离子中[Cu2Cl3]ˉ随摩尔比的增大而逐渐增加,当CuCl与阳离子供体的摩尔比为2 时,阴离子主要为[Cu2Cl3]ˉ。那么当阴离子供体为AlCl3和FeCl3时,其对应的阴离子分别是[AlCl4]ˉ、[Al2Cl7]ˉ、[FeCl4]ˉ、[Fe2Cl7]ˉ。通过量化计算考察了上述六种阴离子与乙烯的作用结构及其结合能,结果如图8所示。
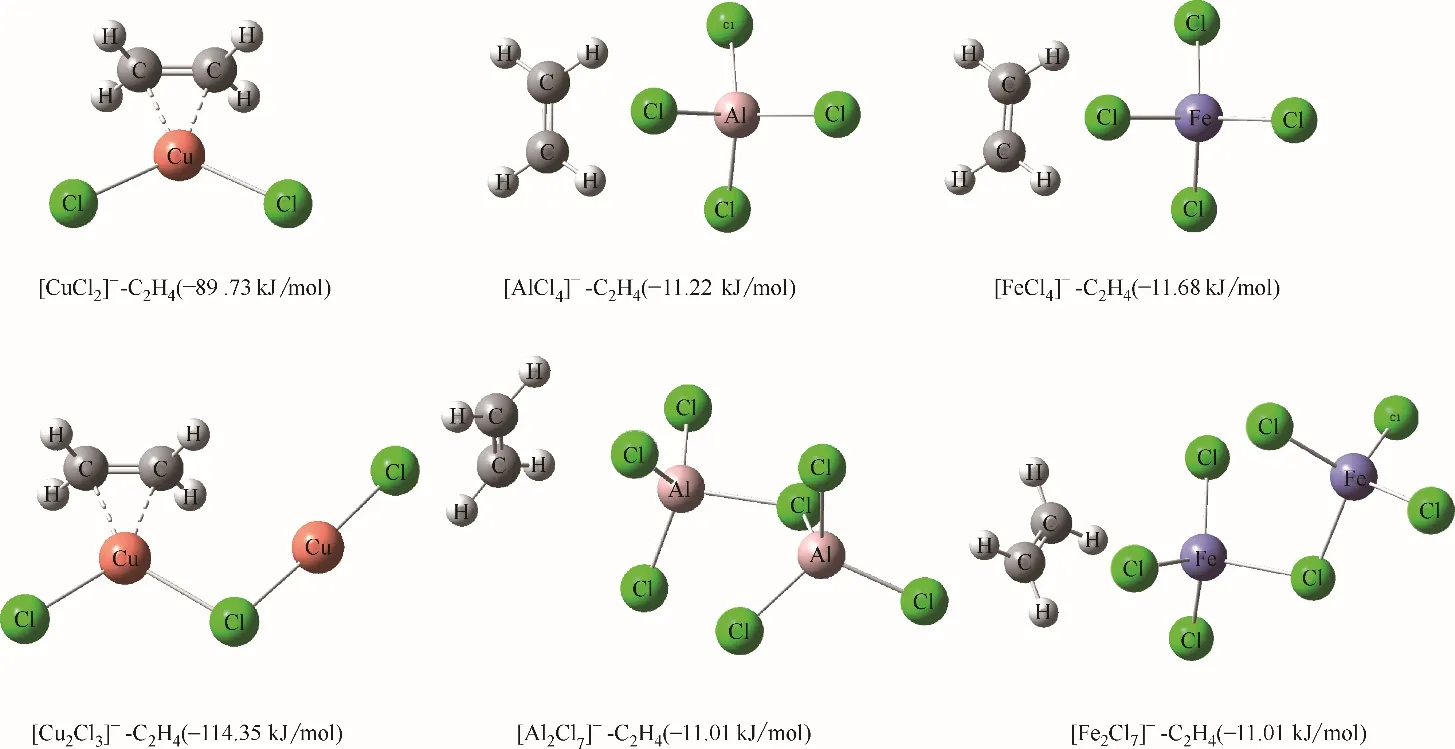
图8 六种阴离子与乙烯的作用结构及结合能Fig.8 Interaction structure and binding energy between C2H4 and various anions
从结合能来看,[CuCl2]ˉ和[Cu2Cl3]ˉ对乙烯的结合能显著大于[AlCl4]ˉ、[Al2Cl7]ˉ、[FeCl4]ˉ、[Fe2Cl7]ˉ的结合能,这说明[CuCl2]ˉ和[Cu2Cl3]ˉ对烯烃具有较强的络合作用,而[AlCl4]ˉ、[Al2Cl7]ˉ、[FeCl4]ˉ、[Fe2Cl7]ˉ与烯烃之间则为范德华作用和以静电作用为主导的Cl…H—Cl 弱氢键作用。因此,CuCl 作为阴离子供体时合成的离子液体对乙烯的溶解度最高。实际上[CuCl2]ˉ和[Cu2Cl3]ˉ与烯烃的相互作用即为Dewar−Chatt 模型[39]中π 络合作用。以[CuCl2]ˉ−C2H4络合物为例进行分析,对其产生的分子轨道按Pipek−Mezey方法[40]进行轨道定域化,得到有利于络合物形成的两个主要定域化分子轨道,如图9 所示。可以看出,一个定域化轨道[图9(a)]由于乙烯的π 轨道与Cu(Ⅰ)的sp2型杂化轨道重叠形成,也就是π 电子向Cu(Ⅰ)空轨道的馈赠,构成三中心两电子σ 键。而另一个定域化轨道[图9(b)]由烯烃的π*轨道与Cu(Ⅰ)的dxy轨道重叠形成,也就是d电子向乙烯的反向馈赠,构成三中心两电子π键,其对络合物的稳定起到重要作用。同样地,从π 电子密度分布[图9(c)],也可以看出π电子被束缚在Cu−C键上,烯烃的π电子密度减小,双键被削弱。电子定域化函数(electron localization function, ELF)[41]和定域化轨道定位函数(localized orbital locator, LOL)[42][图9(d)、(e)]经常被用来衡量电子的定域性,从络合物的ELF和LOL 平面图可以看出,无论是Cu−C 键还是Cu−Cl键的电子定域性都很弱,这是因为Cu−Cl和Cu−C 键均为强极性共价键,并有强离子性特征。
[CuCl2]ˉ和[Cu2Cl3]ˉ为何会对乙烯/乙烷、丙烯/丙烷实现高选择性的溶解呢?同样地,从结合能的角度进行定量分析,[CuCl2]ˉ和[Cu2Cl3]ˉ与乙烷、丙烯、丙烷的作用结构及其结合能如图10所示。结合图8和图10 可以看出,[CuCl2]ˉ和[Cu2Cl3]ˉ结合乙烯、丙烯的能力显著强于乙烷、丙烷,因此CuCl 离子液体能够通过化学作用实现高选择性地溶解乙烯、丙烯,而乙烷、丙烷则是通过物理作用溶解。
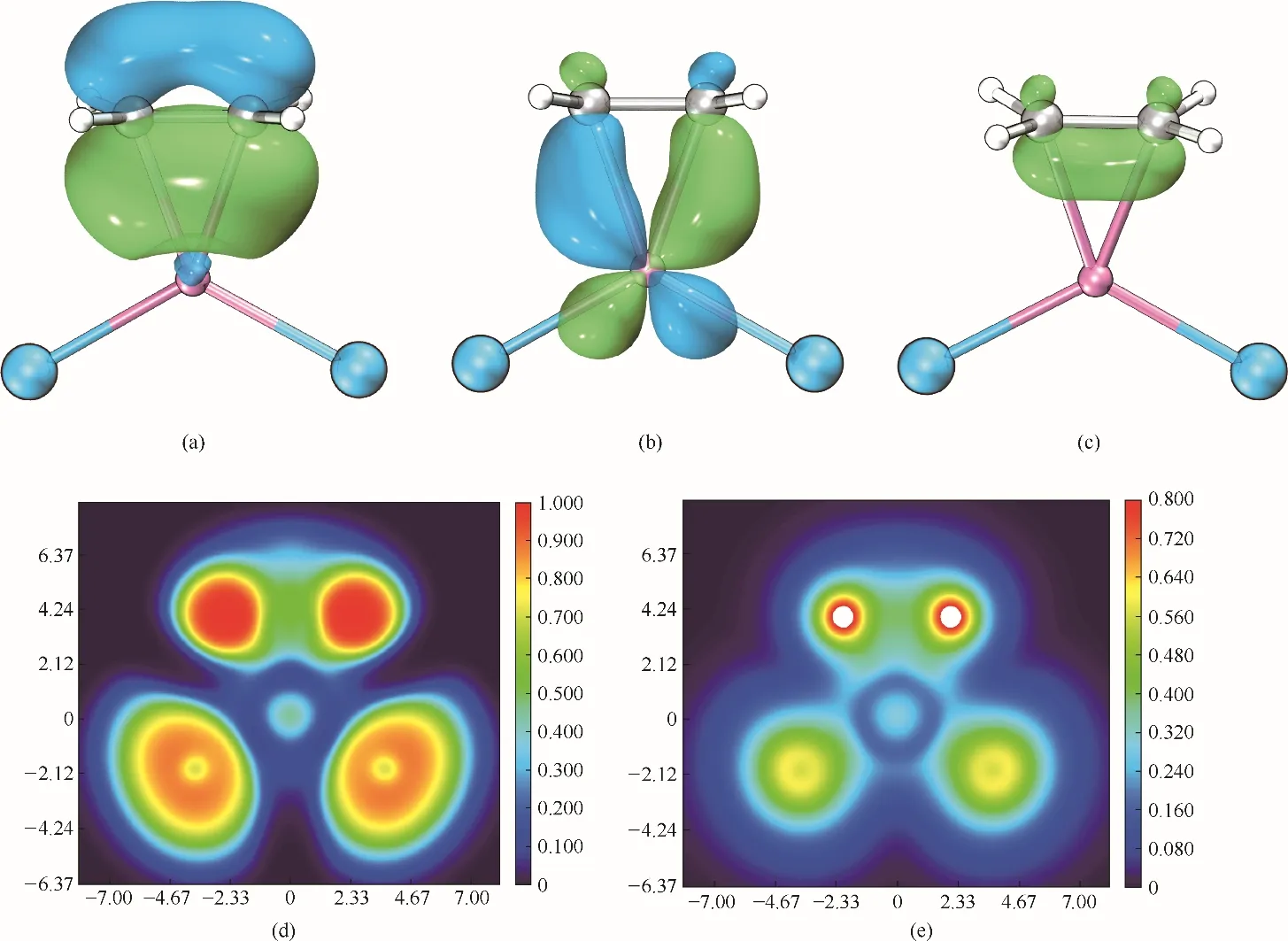
图9 [CuCl2]ˉ−C2H4络合物的定域化轨道[(a)、(b)];π电子密度等值面图(c)(等值面设为0.05);ELF和LOL平面图[(d)、(e)]Fig.9 LMOs[(a),(b)],π electron density isosurface map(isovalue=0.05)(c),ELF(d)and LOL(e)color filled map of[CuCl2]ˉ−C2H4complex
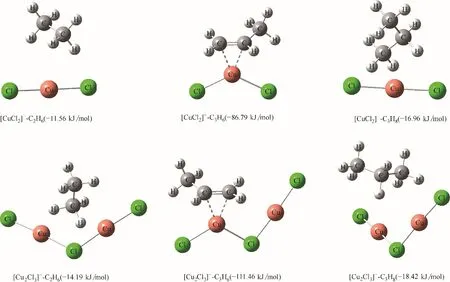
图10 [CuCl2]ˉ、[Cu2Cl3]ˉ与乙烷、丙烯、丙烷的作用结构及结合能Fig.10 Interaction structure and binding energy between[CuCl2]ˉ([Cu2Cl3]ˉ)and C2H6(C3H6,C3H8)
对比[CuCl2]ˉ和[Cu2Cl3]ˉ与乙烯、乙烷的结合能,不难发现[Cu2Cl3]ˉ与[CuCl2]ˉ更容易结合乙烯,实验结果表明,当CuCl 与阳离子供体摩尔比大于1 时,增加CuCl 的量也确实会提高离子液体对乙烯/乙烷的溶解选择性,实验与计算结果具有较好的一致性。从结构上来看,[CuCl2]ˉ−C2H4和[Cu2Cl3]ˉ−C2H4两个络合结构中,Clˉ具有价层满8 电子结构,其与Cu+结合时,Cu (Ⅰ)的三个sp2杂化轨道分别与两个Cl的p轨道重叠及乙烯的π轨道重叠形成3个σ键,呈平面三角形构型。所不同的是有一个Cl 所处的环境不同,[CuCl2]ˉ中是端Cl,而[Cu2Cl3]ˉ中是桥Cl,这使得Cu(Ⅰ)的配位环境不同,因而造成Cu(Ⅰ)络合烯烃的能力不同。具体体现在Cu(Ⅰ)对烯烃的静电作用和Cu(Ⅰ)周围电子的软度,整个过程可看作是亲核试剂对亲核位点的进攻,考虑引入Hirshfeld原子电荷[43]表征Cu(Ⅰ)的静电作用,引入概念密度泛函中的局部亲核指数[44]来表征Cu(Ⅰ)周围电子的软度,结果如表8 所示。显然,[Cu2Cl3]ˉ中Cu(Ⅰ)的正电性显著强于[CuCl2]ˉ中Cu(Ⅰ)的正电性,这意味着[Cu2Cl3]ˉ中Cu(Ⅰ)具有更强的长程静电作用,更容易将乙烯分子拉到Cu(Ⅰ)位点附近。而更高的亲核指数则表明[Cu2Cl3]ˉ中Cu(Ⅰ)更容易与其附近乙烯发生亲核反应。综合来看,[Cu2Cl3]ˉ比[CuCl2]ˉ更容易络合乙烯。
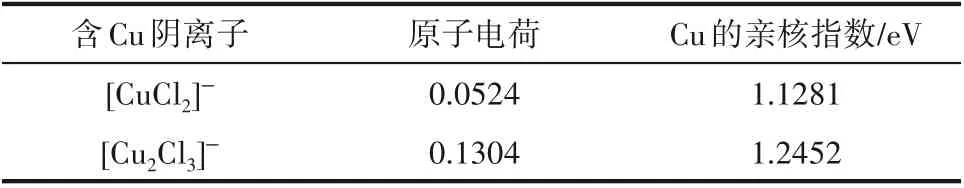
表8 两种含Cu阴离子中Cu的Hirshfeld原子电荷和亲核指数Table 8 Hirshfeld atomic charge and nucleophilicity index
仅从单分子乙烯结合能来看,两者之间的结合能的差距并非十分显著,无法解释含CuCl离子液体对乙烯/乙烷选择性的巨大提升(2.45~8.78)。实际上[Cu2Cl3]ˉ具有双Cu(Ⅰ)位点,并且其在结合一分子乙烯的情况下,另一Cu(Ⅰ)位点与另一分子乙烯的结合能仍能达到−110.91 kJ/mol[图11(a)],这意味着[Cu2Cl3]ˉ的活性位点明显多于[CuCl2]ˉ,因此能够结合更多分子的乙烯。实际上当CuCl 与阳离子供体的摩尔比为2.1 时,[Cu3Cl4]ˉ也有所增加,其具有两种Cu(Ⅰ)位点,中间的Cu(Ⅰ)位点与乙烯的结合能(−124.23 kJ/mol)相较于两端的Cu(Ⅰ)位点与乙烯的结合能(−117.07 kJ/mol)要高,更高于[Cu2Cl3]ˉ与乙烯的结合能(−114.35 kJ/mol)。这就解释了CuCl 与阳离子供体的摩尔比为2~2.1 时,含CuCl 离子液体对乙烯/乙烷选择性进一步提升(8.47~8.78)。上述分析都是基于一个Cu(Ⅰ)位点结合一个乙烯的情况,实际上一个Cu(Ⅰ)位点还能结合另一分子乙烯,以形成四配位的扭曲四面体空间构型。需要注意的是,[CuCl2]ˉ与另一乙烯分子的结合能会显著下降[−56.11 kJ/mol,图11(b)],这意味着乙烯会优先结合未被占据的Cu(Ⅰ)位点,对于[Cu2Cl3]ˉ也有着同样的结论[图11(c)],但−92.91 kJ/mol 的结合能仍然略大于[CuCl2]ˉ对C2H4的结合能,进一步说明了[Cu2Cl3]ˉ对乙烯结合的巨大优势。
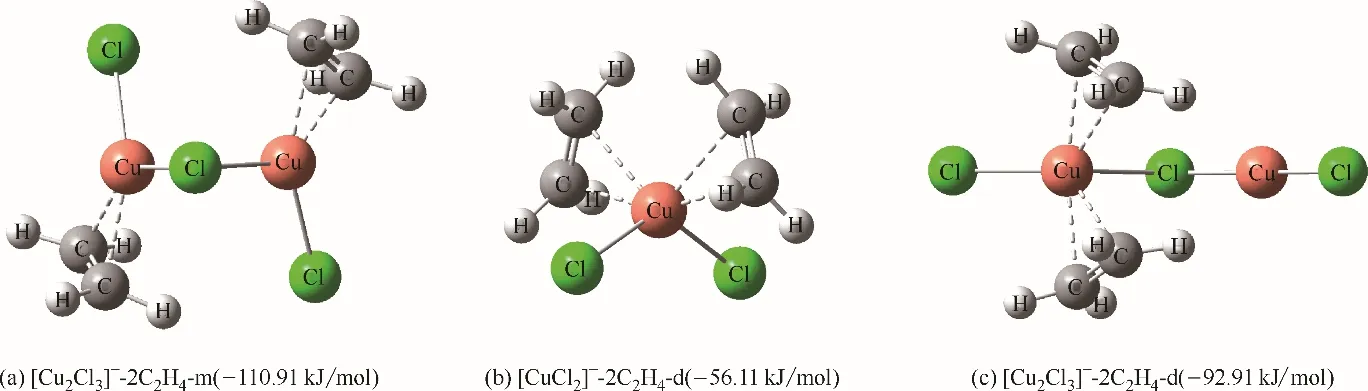
图11 [CuCl2]ˉ、[Cu2Cl3]ˉ与两分子乙烯的作用结构及结合能Fig.11 Interaction structure and binding energy between[CuCl2]ˉ,[Cu2Cl3]ˉand two ethylene molecules
3 结 论
(1)含有Cu(Ⅰ)的离子液体对小分子烃类呈现出较高的溶解度和烯烃/烷烃溶解选择性,优选出的离子液体是Et3NHCl−2.1CuCl。
(2)低温和高压有利于烃类在离子液体中的溶解,升高温度和压力会减小烯烃/烷烃溶解选择性;烯烃/烷烃溶解选择性在30℃和0.2 MPa的条件下均大于8.3。
(3)烃类在离子液体中的溶解速率在溶解初始时较大且随时间的延长快速减小,烯烃的溶解速率高于烷烃的溶解速率。烯烃与烷烃混合气中烯烃的含量越低,烯烃/烷烃分离选择性越大。
(4)升温可将小分子烃类从离子液体中解吸出来,恢复离子液体对烃类的溶解能力。烷烃比烯烃容易解吸,小分子烃类比大分子烃类容易解吸。在解吸温度80℃和一定时间下,解吸率可达92%以上。
(5)离子液体对小分子烷烃和烯烃的吸收分离具有良好的重复使用性能,重复利用5 次时溶解度的减小幅度不超过5%,且对烯烃/烷烃溶解选择性基本无影响。
(6)通过量子化学计算得到了离子液体中不同阴离子与小分子烃类的作用结构与结合能,解释了含CuCl 离子液体对烯烃溶解度高以及Et3NHCl−2.1CuCl离子液体具有高烯烃/烷烃选择性的原因。
符 号 说 明
MIL——离子液体的摩尔质量,g/mol
mIL——离子液体的质量,g
nH,nIL——分别为溶解的烃类、离子液体的物质的量,mol
nHi,nHi+1——分别为时间为ti和ti+1时溶解气体的物质的量,mol
Pg0,Pgf——分别为气体罐初始压力与溶解结束后的压力,Pa
Psi,Psi+1——分别为溶解时间为ti和ti+1时气体溶解罐的压力,Pa
Ps0,Ps——分别为气体溶解罐初始压力与溶解结束后的压力,Pa
R——气体常数,8.314 J/(mol·K)
r——烃类在离子液体中的溶解速率,mol/min
s——烯烃/烷烃溶解选择性
T——温度,K
ti,ti+1——分别为从溶解开始到i和i+1的时间,min
Vg,VIL,Vs——分别为气体罐、离子液体与气体溶解罐的体积,m3
x——烃类在离子液体中的溶解度,mol/mol
xO,xP——分别为烯烃与烷烃的溶解度,mol/mol
