利用磷化渣制备电池级磷酸铁
2020-10-27欧小菊李正科王威燕杨运泉
欧小菊,柴 琪,李正科,王威燕,杨运泉
(湘潭大学,湖南湘潭411105)
磷化是稀磷酸或酸性磷酸盐溶液与金属表面反应从而形成一层磷酸盐保护膜的过程[1]。磷化作用形成的磷化膜能有效地减少氧气与表面金属离子的接触,从而延缓了金属表面的氧化生锈[2]。磷化过程中的温度越高,生成的磷化渣会越多[3]。磷化技术在众多领域有广泛的应用,尤其是在钢铁行业。随着金属制品行业的发展,磷化渣的产量也日益增多,直接排放磷化渣会造成严重的水体污染及土壤污染[4]。
锂电池是目前电能储存和利用的重要手段,磷酸铁锂是锂电池常用的正极材料之一[5]。随着新能源电力汽车的快速发展,能源界对磷酸铁锂的消耗急剧增大,从而增大了磷酸铁锂的市场需求[6]。磷酸铁锂主要是以磷酸铁为铁源配以锂源化合物所制得[7],其具有较高的电化学性和较大的振实密度[8]。为获得优质的磷酸铁锂,工业上对电池用磷酸铁的质量提出了较高要求。目前,工业上主要以分析纯级的铁盐及磷酸或磷酸盐为原料来制备电池级磷酸铁[9-11]。但随着全球磷矿资源的日益减少,通过纯物质来制备磷酸铁会面临原料枯竭及成本上涨等问题。若能高效、经济地从废弃磷化渣中回收磷资源来制备磷酸铁,既可有效解决原料短缺问题同时也实现了资源的二次利用和环境保护。因此,研究利用废弃磷化渣来制备电池级磷酸铁具有重要意义[12]。
目前,固废磷化渣资源化利用主要是对其中的磷、铁及锌元素进行回收利用。铁元素的回收利用主要通过其与OH-反应生成氢氧化铁,再经过高温煅烧得氧化铁红而实现[13];磷元素的回收利用主要是制取羟基磷灰石[2];锌元素的回收利用则是通过氨水络合浸取得到较高纯度的磷酸锌。此外,还可通过添加一定配比的其他物质,使磷化渣转变为磷化液而得到利用[14]。当前,由于这些产物的附加值不高,或因产品的生产工艺较复杂难于工业控制,这些技术尚未在工业上得到广泛的应用[15]。
本文以钢铁制品磷化过程所产生的含锌磷化渣为原料,先将其用NaOH碱浸得到含微量锌离子的Na3PO4溶液,再对该溶液进行萃取,最后将净化液与FeCl3·6H2O进行复分解反应制备电池级磷酸铁,此法能有效利用磷化渣中的磷酸根且产物附加值高,适用于多种类型的磷化渣,生产过程对环境友好,工艺简单,便于工业化生产。
1 实验方法
1.1 原料分析
原料:某钢铁企业在钢铁制品磷化过程中所产生的含锌磷化渣。将其在100℃下干燥6 h。通过原子吸收分光光度法测定其金属元素含量,络合显色法测定磷酸根含量(GB/T 6913—2008《锅炉用水和冷却水分析方法 磷酸盐的测定》)。通过分析可得该磷化渣中PO43-质量分数为44.32%,Fe3+质量分数为27.44%,Zn2+质量分数为2.98%,还有少量其他金属离子。通过XRD对磷化渣组成进行分析,结果如图1所示。由图1可知,该磷化渣主要成分为FePO4·2H2O,杂质锌离子主要以Zn2Fe(PO4)2·2H2O的形式夹杂在磷化渣中,部分以Zn2(PO4)(OH)的形式存在,该形式的锌离子难以直接通过络合或酸浸的方法溶解分离。

图1 含锌磷化渣的X射线衍射谱图
1.2 磷酸铁的制备
取10 g磷化渣加少量水润湿,在50℃搅拌条件下向其中滴加质量分数为30%的氢氧化钠,反应2 h后加入一定量的水调节pH至12.5,继续反应1 h,抽滤得滤液;滴加磷酸调pH至7.25,按一定相比加入有机相及滤液,萃取10 min,静置10 min,分离得萃余液;85℃机械搅拌下加入质量分数为铁源质量3%的表面活性剂十六烷基三甲基溴化铵,按铁磷物质的量比加入一定量的质量分数为15%的六水合氯化铁溶液,用氢氧化钠溶液回滴控制其反应pH,反应2 h后抽滤、水洗多次,90℃下真空干燥8 h。工艺流程图如图2所示。

图2 磷化渣为原料制备磷酸铁的工艺流程图
2 实验结果与讨论
2.1 氢氧化钠用量对碱浸过程的影响
碱浸过程主要发生的化学反应如下:

从化学式可知,磷酸根能否从固体磷化渣中提取至磷酸钠溶液中与氢氧化钠用量直接相关,用碱渣比来表示氢氧化钠与磷化渣用量的质量比。根据磷化渣中磷酸根含量来计算理论所需氢氧化钠用量,假定磷酸根与钠离子按物质的量比为1∶3反应,则磷酸根浸出率达100%时,理论碱渣比应为0.6。研究了实际反应过程中碱渣比对磷酸根的浸出及浸出后溶液中杂质锌含量的影响,实验结果见图3。

图3 碱渣比对浸出液的影响
由图3可知,碱渣比对碱浸后的磷酸钠溶液中的杂质锌含量及磷酸根含量有较大的影响。随着碱渣比的增加,即氢氧化钠用量的增加,磷酸根的浸出率明显增加,溶液中杂质锌含量却快速减少。当碱渣比增加到0.65时,磷酸根的浸出率可达93.97%,溶液中杂质锌含量为938.1μg。碱浸过程中会生成氢氧化锌沉淀,氢氧化锌沉淀是两性化合物,在强碱溶液中生成锌酸盐,具体反应如下:

当碱渣比大于0.65后,溶液中氢氧化钠过量,已经开始形成锌酸钠盐,该盐可溶于水溶液中,导致溶液中锌含量增加,不利于后续高纯磷酸铁的制备。因此碱浸过程最优反应条件为:碱渣比为0.65,此时磷酸根的浸出率可达到93.97%,滤液中锌离子含量为938.1μg。
2.2 萃取剂对溶液中锌含量的影响
磷化渣通过碱浸过程可有效地浸出磷酸根,得到磷酸钠溶液,同时也发现该溶液中还存在微量的锌离子无法通过化学沉淀法去除。通过原子吸收测定可知溶液中锌含量为938.1μg,为进一步去除锌离子,本文考察了一种含单萃取剂(双硫腙或P204)及一种含双萃取剂(双硫腙和P204)的有机相对萃锌过程的影响,同时也考察了相比的影响,实验结果如表1所示。由表1可知,萃取可以有效地降低磷酸钠溶液中的锌含量,含双萃取剂的有机相的萃取效果优于单萃取剂,相比(有机相与水相体积比)越大,溶液中锌含量越小,但由于萃取剂P204浓度越高越容易乳化[16],应降低相比,防止P204乳化带来的不利影响,在相比=1∶5时,含双萃取剂的有机相对溶液中锌萃取率仍可达55.39%。

表1 不同萃取剂对产物中锌含量的影响
2.3 复分解反应pH对产物的影响
将含双萃取剂的有机相萃取后所得的磷酸钠溶液,按铁磷物质的量比为1∶1.3加入质量分数为15%的六水合氯化铁溶液,通过滴加氢氧化钠溶液来控制其反应pH,考察了其反应pH对产物磷酸铁的影响,实验结果如图4所示。由图4可知,当复分解反应的pH不断降低时,产物中锌含量随之降低,但铁磷物质的量比先增加后降低,当pH为2.0时,铁磷物质的量比可达0.95,最接近理论电池级磷酸铁的铁磷物质的量比1.0。复分解反应pH越低,磷酸锌越易溶于溶液中,从而降低了产物中锌含量。实验过程中发现复分解反应pH低于1.8后,生成的磷酸铁沉淀会开始溶解,导致产物磷酸铁收率降低且品质较差[17]。

图4 复分解反应pH对产物的影响
2.4 铁源加入量对产物磷酸铁的影响
铁源的加入量会直接影响产物磷酸铁的品质。铁源的加入量是根据浸出液中磷酸根的量来确定,实验结果如图5所示。从图5看出,随着加入的铁量增多,产物中的锌含量随之降低,但产物铁磷物质的量比却逐渐增大。当加入的铁磷物质的量比为1∶1.2时,产物中铁磷物质的量比为0.98,杂质锌含量为24.2μg/g,符合国家电池用磷酸铁技术指标(HG/T 4701—2014《电池用磷酸铁》)要求,此时磷酸根的回收利用率可达78.31%。

图5 加入铁源量对产物磷酸铁的影响
3 产物表征与分析
3.1 产物磷酸铁的红外光谱分析
图6 是产物磷酸铁的FT-IR图。由图6可知,在波数为3 440、1 635、1 066、532 cm-1处有强吸收峰,其中3 440 cm-1处为H—O—H的伸缩振动吸收峰、1 635 cm-1处为O—H的弯曲振动吸收峰,由此可证明产物中含有结晶水,1 066 cm-1处为PO43-中的P—O键的伸缩振动强吸收峰,532 cm-1处为P—O键的对称弯曲振动吸收峰[18],此出峰位置皆符合标准FePO4·2H2O的红外出峰位置。
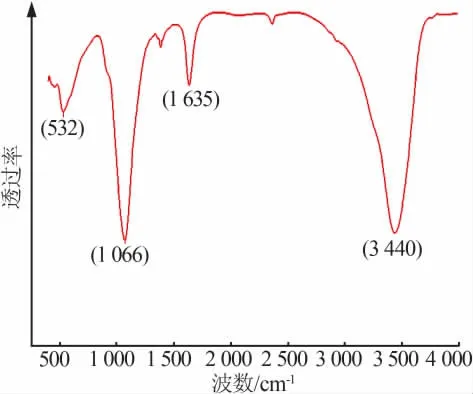
图6 产物磷酸铁的FT-IR谱图
3.2 产物磷酸铁的X射线衍射分析
对产物磷酸铁进行了XRD测试,结果如图7所示。从图7可以看出,100℃下干燥的FePO4(a)没有明显的特征峰,表明此温度下干燥的FePO4为无定形 态[19];620℃煅 烧 的FePO4(b)出 现 明 显 的 特 征峰,将所得的衍射谱图与标准卡(PDF#77-0094)进行对比,可知2θ为20.2、25.7、35.5、38.0、39.1、41.3、48.4、53.0、58.2、65.5、66.3、70.2、73.1°处出现尖锐的衍射峰,分别归属于FePO4的(100),(012),(110),(104),(112),(200),(114),(024),(212),(124),(032),(108)和(304)面的特征衍射峰,且各衍射峰尖锐清晰。从图7可以看出并无杂峰存在,表明该产物是由FePO4晶相构成,无其他杂质的晶相生成。

图7 产物磷酸铁的XRD图
3.3 产物磷酸铁的热重分析
图8 为产物磷酸铁升温速率为10℃/min的TG曲线。从图8可知,温度从30℃升高至90℃时,产物失重缓慢,当温度升高至90℃后,样品开始快速失重,升高至500℃时,总失重率约为19.02%,与电池级磷酸铁中结晶水质量分数19.26%近乎一致[20],后随着温度的继续上升,产物质量几乎不变。

图8 产物磷酸铁的TG曲线
3.4 产物磷酸铁的形貌分析
为观察及探究产物磷酸铁的形貌及颗粒大小,对产物进行粒度分析、SEM及TEM测试,测试结果见图9。从图9c粒度分布图可知,该方法所制备的磷酸铁d50为5.17μm,该产物粒度(d50)符合电池级磷酸铁行业标准,再根据其SEM(a)及TEM(b)图可知,该方法所制备的磷酸铁由球状或类球状的颗粒组成,且初级粒子的平均粒径非常小,大约为40 nm,说明该法所制备的磷酸铁颗粒可达纳米级。

图9 产物磷酸铁的SEM(a)、TEM(b)图及粒度分布图(c)
4 经济效益分析
磷化渣经碱浸、抽滤后的沉淀物主要成分为氢氧化铁,其质量分数>99.51%,煅烧后即为氧化铁。计算表明,1 t磷化渣经碱浸后可获得0.54 t氢氧化铁沉淀,煅烧后可得0.41 t氧化铁,该氧化铁可以直接作为炼铁原料返回铁矿石烧结过程进行利用,亦可作为颜料应用于涂料方面。磷酸钠溶液与铁源反应后可制得1.09 t磷酸铁。按磷化渣处理规模为800 t/a,年运行按300 d计,其主要原材料消耗、成本及产品产值初算如表2所示。
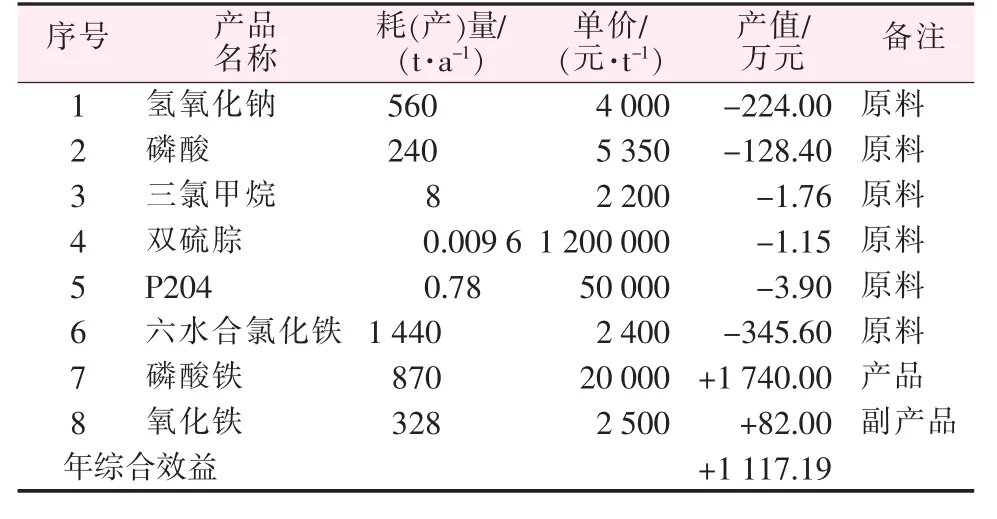
表2 原材料消耗、成本及产品产值估算
5 结论
1)以含锌固废磷化渣为原料,先用强碱液浸取,再用双硫腙或P204对其进行萃取,最后与铁源反应,可制得电池级磷酸铁。该法能适用于多种类型的磷化渣的回收利用和处理,产物附加值高,经济效益可观,生产过程对环境友好,便于工业化生产。2)通过碱浸-萃取-复分解反应3个步骤能有效地回收磷化渣中的磷酸根,浸取过程磷酸根的浸取率可达93.97%,磷酸根的总回收利用率可达78.31%。3)采用双硫腙和P204萃取剂对浸取液进行萃取,其混合萃锌效果明显优于它们相应的单种萃取剂效果。在相比=1∶5时,锌的单级萃取率可达55.39%,产品磷酸铁中锌含量可降低至24.2μg/g,铁磷物质的量比接近1∶1,磷酸铁产品质量符合HG/T 4701—2014的要求。4)以含锌磷化渣为原料制备电池级磷酸铁的最优工艺条件为:浸取过程中,碱渣质量比为0.65;萃取过程中,双硫腙在体积分数为10%的P204+CHCl3的有机相中的质量浓度为1.2 g/L,相比=1∶5;复分解反应过程中,加入铁源的量为铁磷物质的量比为1∶1.2,通过回滴氢氧化钠至pH=2.0来控制复分解反应终点。
