化学农药和木霉菌株抑制石榴果实干腐病病菌的效果评估
2020-10-26胡婕罗玉端毛林夏李恒鲁海菊
胡婕 罗玉端 毛林夏 李恒 鲁海菊

摘要:为做好出口石榴鲜果产地检疫和病原防治工作,以石榴果实干腐病病菌(Zythia versoniana)和木霉菌株(Trichoderma spp.)作为供试菌株,采用菌丝生长速率法和对峙培养法,测定8种常用化学农药和18株木霉菌株对石榴果实干腐病病菌的抑菌率。结果表明,450 g/L咪鲜胺、250 g/L丙环唑、30%苯醚甲环唑、10%氟硅唑、20%三唑酮、40%百菌清等6种化学农药对石榴果实干腐病病菌的抑制效果最好,抑菌率为100.0%,是理想的备用化学农药。在各供试木霉菌株中,木霉菌株PZ1对石榴果实干腐病病菌的抑菌率为63.5%,有望作为防治石榴果实干腐病的生防菌种资源。
关键词:石榴干腐病病菌;鲜果;产地检疫;木霉菌株;化学农药
中图分类号: S436.67+9 文献标志码: A 文章编号:1002-1302(2020)17-0116-05
石榴干腐病病菌可以通过气流、雨水传播,不仅危害石榴树的枝干、新梢、花、叶片,更重要的是侵染石榴果实。石榴幼小果实可被侵染携带病原,具有潜伏侵染的特性,在贮藏后期造成鲜果变褐腐烂。石榴干腐病病菌是我国石榴鲜果出口风险分析中的重要真菌病原之一,在韩国[1]、希腊[2]也有相关报道,其有效防治措施是我国石榴鲜果出口种植基地检疫监管的一项重要内容。我国报道引起石榴干腐病的病原菌有石榴鲜壳孢(Zythia versoniana)[3-4]和石榴垫壳孢(Coniella granati)[5]。从菌落形态特征和培养性状来看,石榴鲜壳孢和石榴垫壳孢差异不明显,在马铃薯葡萄糖琼脂(PDA)培养基中菌丝均呈放射状扩展,同心轮纹状,后生黑褐色的分生孢子器[3-5],鉴定结果不一致的原因可能與石榴产地地理环境差异有关。云南省蒙自市是我国石榴鲜果出口的主要产地之一,1999年随着周又生等对石榴干腐病进行较全面系统地研究,该病得到了有效的控制[3]。直到2011年,蒙自产地石榴干腐病再次大暴发[3],迄今石榴干腐病仍然是出口种植基地较为严重的病害,特别是在6月上中旬至7月上中旬间,若连续降雨或时晴时雨的高温高湿条件下,病菌生长繁殖迅速,中等成熟度的果实5~7 d内发病果达20%~30%,严重的达 40%~50%[3-5]。
适时使用化学农药仍是控制石榴果实干腐病的主要措施,常用的化学农药包括波尔多液[3]、多菌灵[6-7]、百菌清[3,7]、代森锰锌[3]、甲基托布津[3,6]等。另一方面,病原菌对化学农药产生的抗药性,伴随而来的农药残留和食品安全问题,使得在产地检疫和监管措施中,不但有必要检监测化学农药措施的有效性,对生物防治的稳定性与成效评估也越来越重要[8-10]。李永庆等利用芽孢杆菌属(Bacillus)菌株防治石榴干腐病病菌,抑菌率在30%左右[11]。马耀华等利用解淀粉芽孢杆菌(Bacillus amyloliquefaciens)防治石榴干腐病病菌,抑菌率达31.27%~81.89%[12]。鲁海菊等利用木霉(Trichoderma)菌株防治石榴干腐病菌,抑菌率可达93%,可见木霉菌株对石榴干腐病病菌的拮抗作用显著[13]。鉴于此,本试验将测定8种出口种植基地常用的化学农药和18株木霉菌株对石榴果实干腐病病菌的抑菌率,以期为产地检疫和监管进一步开展化学和生物防治评价提供数据支撑。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 石榴果实干腐病病原菌(Zythia versoniana)分离自云南蒙自产地的石榴干腐病病果果实;木霉(Trichoderma spp.)菌株:PZ1、抗三唑酮PZ1、抗氟硅唑PZ1、GM6、抗三唑酮GM6、抗氟硅唑GM6、Y2、抗三唑酮Y2、GD1、抗三唑酮GD1、J1、J2、J3、J4、J5、JD3、GD3、GD5,均保存于红河学院生命科学与技术学院植物病理学实验室。
1.1.2 供试化学农药 供试化学农药相关信息详见表1。
1.1.3 供试培养基 PDA培养基:200 g马铃薯、16 g葡萄糖、20 g琼脂粉、1 000 mL蒸馏水。上述培养基配好后在121 ℃高压灭菌30 min。材料均购自农贸市场及试剂公司,试剂均为分析纯。
1.2 试验方法
1.2.1 试验时间与地点 于2018年8月25至26日前往云南蒙自石榴种植基地采集石榴干腐病病果并进行供试病原菌分离鉴定;于2018年9月25日至11月25日在红河学院生命科学与技术学院植物病理学实验室和蒙自海关综合技术中心植物检疫实验室开展抑菌效果评估试验。
1.2.2 菌株扩繁与菌块制备 将分离、保存的石榴果实干腐病病菌、木霉菌株接种到PDA培养基平板中,于28 ℃恒温扩繁培养7 d后,采用直径为5 mm的打孔器在培养基同一半径周围取菌块备用。
1.2.3 测定常用化学农药对石榴果实干腐病病菌的抑菌率 采用菌丝生长速率法[7,11],将450 g/L咪鲜胺、250 g/L丙环唑、30%苯醚甲环唑、10%氟硅唑、20%三唑酮、40%百菌清、80%多菌灵、70%甲基硫菌灵等8种杀菌化学农药按供货说明书的使用浓度(表1)配制后,加入PDA培养液中,摇匀后倒入已灭菌的培养皿中备用。将石榴果实干腐病病菌菌块接种于含药PDA培养基平板中心位置,以石榴果实干腐病病菌菌块接种到不含药的PDA平板中心位置为对照。每个处理重复3次,于28 ℃恒温培养7 d后,用十字交叉法[14]测定菌落直径,计算抑菌率。
1.2.4 测定木霉菌株对石榴果实干腐病病菌的抑菌率 采用对峙培养法[15],将直径为5 mm的木霉菌块与石榴果实干腐病病菌菌块两两组合,接种到距离平板中央相等的2个点上,以不接种木霉菌块作为对照。每个处理重复3次,于28 ℃恒温培养 7 d 后,测定菌落直径,计算抑菌率。
1.2.5 抑菌率计算公式
抑菌率=dCK-dBdCK×100%。
式中:dCK表示对照病原菌菌落直径,mm;dB表示含药平板病原菌菌落直径,mm。
1.2.6 数据统计 所有试验数据均采用SPSS 19.0统计软件Duncan's多重比较法进行统计分析,计算处理间的差异显著性。采用Excel进行数据汇总并计算平均值。
2 结果与分析
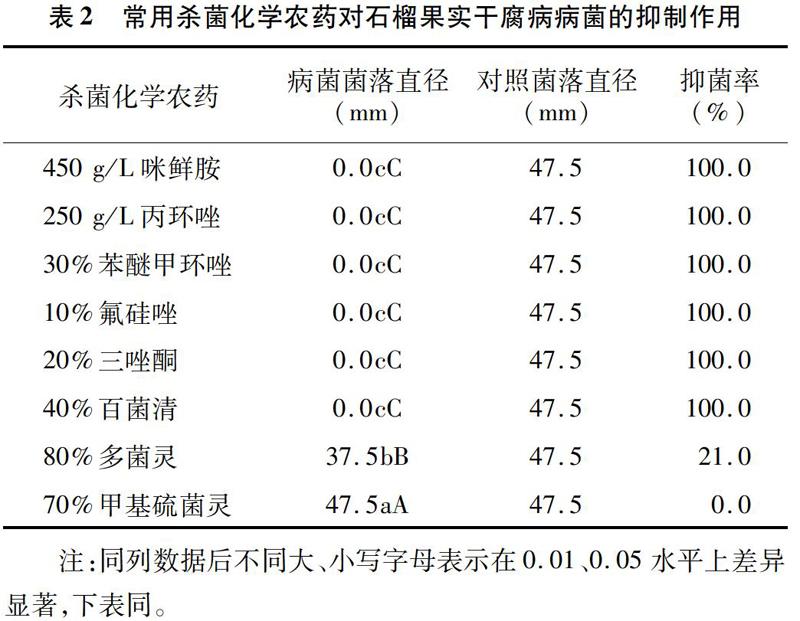
2.1 常用杀菌化学农药对石榴果实干腐病病菌的抑制效果
由表2可知,经Duncan's多重比较发现,450 g/L 咪鲜胺、250 g/L丙环唑、30%苯醚甲环唑、10%氟硅唑、20%三唑酮、40%百菌清等6种化学农药的病菌菌落直径差异不显著,对石榴果实干腐病病菌的抑菌率均达到100.0%,与其他2种药剂的菌落直径间差异极显著(P<0.01)。80%多菌灵和70%甲基硫菌灵菌落直径间差异极显著(P<0.01),抑菌率分别为21.0%、0.0%。结果表明,450 g/L咪鲜胺、250 g/L丙环唑、30%苯醚甲环唑、10%氟硅唑、20%三唑酮、40%百菌清等6种化学农药对石榴果实干腐病病菌的抑制效果最好;80%多菌灵的抑制效果不理想,抑菌率小于50.0%;70%甲基硫菌灵对石榴果实干腐病病菌无抑制效果。
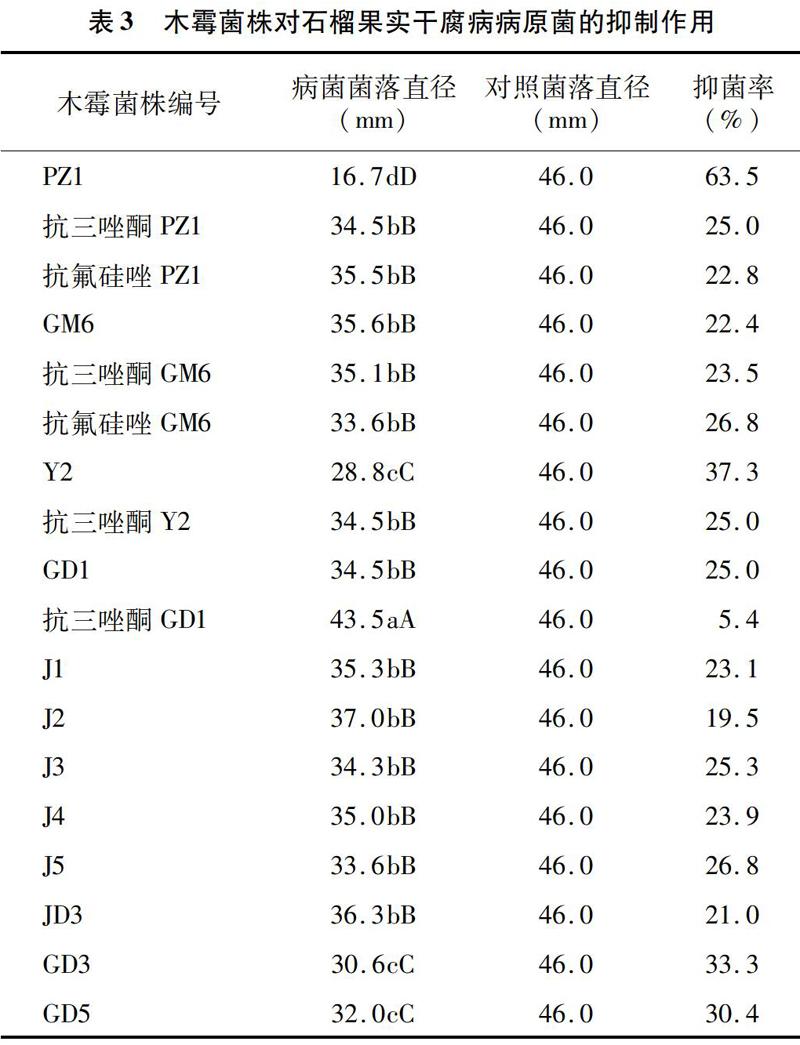
2.2 木霉菌株对石榴果实干腐病菌的抑制效果
由表3可知,经Duncan's 多重比较发现,PZ1菌株与其他17株木霉菌株(GM6、Y2、GD1、J1、J2、J3、J4、J5、JD3、GD3、GD5、抗三唑酮PZ1、抗氟硅唑PZ1、抗三唑酮GM6、抗氟硅唑GM6、抗三唑酮Y2、抗三唑酮GD1)病菌的菌落直径间差异极显著(P<0.01),抑菌率为63.5%,其他17株木霉菌株的抑菌率在5.4%~37.3%之間。结果表明, 在18株木霉菌株中,原始木霉菌株PZ1对石榴果实干腐病病菌的抑制效果较好;其他11株原始木霉菌株和6株抗药性木霉菌株对石榴果实干腐病病菌的抑制效果均不理想。
在6个抗药性木霉菌株中,抗三唑酮PZ1、抗氟硅唑PZ1菌株与PZ1菌株处理间病菌菌落直径差异极显著(P<0.01),抗三唑酮PZ1、抗氟硅唑PZ1菌株对石榴果实干腐病病菌的抑制效果均明显低于PZ1菌株,说明木霉菌株PZ1与药剂混用抑菌效果不理想;抗三唑酮GD1、抗三唑酮Y2菌株与GD1、Y2菌株处理间病菌菌落直径差异极显著(P<0.01),抗三唑酮GD1、抗三唑酮Y2菌株对石榴果实干腐病病菌的抑制效果均明显低于GD1、Y2菌株,说明木霉菌株GD1、Y2与药剂混用抑菌效果不理想;GM6菌株的抑菌率为22.4%,抗三唑酮GM6、抗氟硅唑GM6菌株抑菌率分别为23.5%、26.8%,说明抗三唑酮GM6、抗氟硅唑GM6菌株对石榴果实干腐病病菌的抑制效果相对于GM6菌株有一定的增效作用,但木霉菌株GM6与药剂混用增效作用不显著。
3 讨论
目前选择在石榴坐果后、套袋前喷洒杀菌化学农药,仍是出口种植基地防治石榴果实干腐病、防止出口石榴鲜果携带病原菌的主要措施,操作简便且成效直接[16-19]。本次试验筛选出口种植基地防治石榴干腐病常用的8种化学农药做室内抑菌效果评估,结果表明,450 g/L咪鲜胺、250 g/L丙环唑、30%苯醚甲环唑、10%氟硅唑、20%三唑酮、40%百菌清等6种化学农药对石榴果实干腐病病菌的抑制效果最好,抑菌率均达100.0%,是防治石榴果实干腐病的理想化学药剂。本次评估试验结果表明,80%多菌灵对石榴果实干腐病病菌的抑制效果较差,而70%甲基硫菌灵对其无抑制效果。80%多菌灵、70%甲基硫菌灵的效果与鲁海菊等的研究结果[7]相比,抑菌率分别偏低33.9%、25.8%。可能由于本次试验采用的石榴干腐病病原菌分离自同年石榴产地发病的果实中,菌株活性和致病力均较强,相反使用保存时间较长的供试菌株容易出现衰退现象,表现出药剂高抑制作用,因此本次评估结果显得更可靠。
既防治病虫害,又防止抗药性和化学农药剂量加大引起的农药残留问题,是生物防治的重要意义之一[20-27]。木霉菌株对多种植物病原菌表现有拮抗活性,目前我国已用木霉菌剂成功防治玉米小斑病[28]、柑橘绿霉病[29]、黄瓜枯萎病[30]、人参锈腐病[31]、香蕉枯萎病[32]、葡萄灰霉病[33]等多种农作物病害,有望用于防治石榴果实干腐病。本次试验的各供试木霉菌株中,PZ1菌株对石榴果实干腐病病菌的抑制效果较好,抑菌率为63.5%,有望作为防治石榴果实干腐病的生防菌种资源。本次试验评估的18株木霉菌株,除PZ1菌株评估结果较好,其他17株菌株抑菌效果均不理想。其中,Y2、J1、J2、J3、J4、J5、JD3、GD3、GD5、GM6菌株与鲁海菊等的研究结果相比,抑菌效果相对偏低22.2%~36.2%[15,34];Y2菌株与鲁海菊等研究的木霉菌对万寿菊叶斑病、枇杷根腐病P3.1、P3.5菌株的抑制效果一致,与鲁海菊等研究木霉菌对枇杷根腐病P3.6菌株的抑制效果相对偏低19.3%,与鲁海菊等研究的木霉菌对石榴枯萎病病菌的抑制效果相对偏高18.5%[34];抗三唑酮Y2菌株与鲁海菊等的抗扑海因Y2菌株对石榴枯萎病病菌的抑制效果一致,与鲁海菊等的抗扑海因Y2菌株对万寿菊叶斑病菌、枇杷根腐病菌P3.6、P3.5、P3.1菌株的抑制效果相对偏低12.7%~16.8%[34]。在6个抗药性木霉菌株中,除抗三唑酮GM6、抗氟硅唑GM6菌株与GM6菌株抑菌作用相比有一定的增效作用外,抗三唑酮PZ1、抗氟硅唑PZ1、抗三唑酮Y2、抗三唑酮GD1等4个抗药性菌株相对其原始菌株均无增效作用。这与吴石平等利用木霉菌株与杀菌化学农药混用防治西瓜枯萎病、黄瓜和草莓灰霉病、苹果轮纹病等研究结果[35-39]有明显差异。这些差异可能与生防菌株对病原菌抑制基因的遗传稳定性[40],以及与化学农药的交互抗性有关。目前生物防治技术因其稳定性问题使大规模应用于生产实际还存在一定的局限和障碍。鲁海菊等通过对木霉菌株的多次转接培养促使菌株的耐药性遗传稳定,以及紫外诱导改良木霉菌株、优化木霉菌株与化学农药间的交互抗性[41-42],这些方法是否能够解决木霉菌株对石榴果实干腐病病菌抑制效果的稳定性问题,还有待进一步研究。
参考文献:
[1]Kwon J H,Park C S. Fruit rot of pomegranate (Punica granatum) caused by Coniella granati in Korea[J]. Research in Plant Disease,2002,8(4):215-219.
[2]Tziros G T,Tzavella-Klonari K. Pomegranate fruit rot caused by Coniella granati confirmed in Greece[J]. Plant Pathology,2008,57(4):783.
[3]周又生,陆 进,朱天贵,等. 石榴干腐病生物生态学及发生流行规律和治理研究[J]. 西南农业大学学报,1999,21(6):551-555.
[4]孙德茂. 陕西石榴干腐病发生规律与防治研究[D]. 杨凌:西北农林科技大学,2008.
[5]宋晓贺,孙德茂,王明刚,等. 陕西石榴干腐病发生及病原菌鉴定[J]. 植物保护学报,2011,38(1):93-94.
[6]温铁汉,刘素玲. 石榴干腐病发生规律及防治研究[J]. 中国果树,1998(3):36.
[7]鲁海菊,李 河,史淑義,等. 云南省石榴干腐病病菌生物学特性及其防治药剂筛选[J]. 江苏农业科学,2017,45(1):99-102.
[8]王维华,林何燕. 浅谈大花蕙兰有害生物防治及其检疫监管措施[J]. 植物检疫,2006,20(6):379-381.
[9]胡学难,马 骏,周健勇,等. 6种化学农药及其复配对扶桑绵粉蚧的室内毒力测定[J]. 植物检疫,2010,24(3):26-28.
[10]杨海霞,陈红印,李 强. 浅谈马铃薯甲虫的生物防治[J]. 植物检疫,2007,21(6):368-372.
[11]李永庆,成玉良,陈学君. 济南地区石榴干腐病的发生及内生拮抗菌的筛选[J]. 山东林业科技,2014(5):7-11.
[12]马耀华,谭小艳,黄思良,等. 石榴干腐病生防菌株Z2的鉴定及其培养条件的优化[J]. 植物病理学报,2015,45(4):425-437.
[13]鲁海菊,全舒舟,李香香,等. 枇杷内生真菌中拮抗石榴干腐病菌菌株的筛选[J]. 热带农业科学,2013,33(7):58-62.
[14]毛忠顺,黄 琼,王云月,等. 化学杀菌剂对石榴枯萎病菌的室内抑制作用[J]. 吉林农业大学学报,2005,27(2):137-139,143.
[15]鲁海菊,江 涛,胡金碧,等. 抗枇杷根腐病病菌的内生木霉菌株篩选[J]. 江苏农业科学,2018,46(10):99-102.
[16]Adaskaveg J E,Frster H,Gubler W D,et al. Reduced-risk fungicides help manage brown rot and other fungal diseases of stone fruit[J]. California Agriculture,2005,59(2):109-114.
[17]Mari M,Leoni O,Bernardi R,et al. Control of brown rot on stonefruit by synthetic and glucosinolate-derived isothiocyanates[J]. Postharvest Biology and Technology,2008,47(1):61-67.
[18]郭娟华,涂起红,陈楚英,等. 拮抗微生物防治柑橘采后病害研究进展[J]. 食品科学,2013,34(23):351-356.
[19]凡先芳,王宝刚,曾凯芳. 采后果实褐腐病防治技术研究进展[J]. 食品工业科技,2015,36(12):390-394.
[20]Robert A S,Cervantes L A,Timothy J F. Integrated control of brown rot of sweet cherry fruit with a preharvest fungicide,a postharvest yeast,modified atmosphere packaging,and cold storage temperature[J]. Postharvest Biology and Technology,2002,24(3):251-257.
[21]Casals C,Elmer P G,Vias I,et al. The combination of curing with either chitosan or Bacillus subtilis CPA-8 to control brown rot infections caused by Monilinia fructicola[J]. Postharvest Biology and Technology,2012,64(1):126-132.
[22]Pusey P L. Postharvest biological control of stone fruit brown rot by Bacillus subtilis[J]. Plant Disease,1984,68(9):753.
[23]Janisiewicz W J,Jeffrey S B. Culturable bacterial microflora associated with nectarine fruit and their potential for control of brown rot[J]. Canadian Journal of Microbiology,2010,56(6):480-486.
[24]Zhou T,Schneider K,Li X. Development of biocontrol agents from food microbial isolates for controlling post-harvest peach brown rot caused by Monilinia fructicola[J]. International Journal of Food Microbiology,2008,126(1/2):180-185.
[25]Janisiewicz W J,Jurick W M,Ivana V,et al. Culturable bacteria from plum fruit surfaces and their potential for controlling brown rot after harvest[J]. Postharvest Biology and Technology,2013,76(2):145-151.
[26]Yao H J,Tian S P. Effects of a biocontrol agent and methyl jasmonate on postharvest diseases of peach fruit and the possible mechanisms involved[J]. Journal of Applied Microbiology,2005,98(4):941-950.
[27]Giobbe S,Marceddu S,Scherm B,et al. The strange case of a biofilm-forming strain of Pichia fermentans,which controls Monilinia brown rot on Apple but is pathogenic on peach fruit[J]. FEMS Yeast Research,2007,7(8):1389-1398.
[28]马 佳,范莉莉,傅科鹤,等. 哈茨木霉SH2303防治玉米小斑病的初步研究[J]. 中國生物防治学报,2014,30(1):79-85.
[29]王男麒,黄建国,彭良志,等. 哈茨木霉发酵液对柑橘采后绿霉病的防治效果研究[J]. 中国南方果树,2014,43(3):5-9.
[30]谷祖敏,毕 卉. 长枝木霉THLJ菌株防治黄瓜枯萎病影响因素分析[J]. 农药,2016,55(1):58-60.
[31]陈书华,李 梅,蒋细良,等. 防治人参锈腐病木霉菌的筛选及防治效果[J]. 中国生物防治学报,2016,32(2):265-269.
[32]杜婵娟,付 岗,潘连富,等. 木霉制剂对土壤微生物数量和香蕉枯萎病的影响[J]. 西南农业学报,2013,26(3):1030-1033.
[33]王承芳,陈 娟,旷文丰,等. 复合木霉菌制剂防治葡萄灰霉病的效果研究[J]. 生物灾害科学,2015,38(4):333-338.
[34]鲁海菊,谢欣悦,张海燕,等. 抗药性木霉与原始木霉菌株抑菌活性差异[J]. 江苏农业科学,2019,47(2):83-87.
[35]吴石平,燕嗣皇,陆德清,等. 木霉菌与三唑酮配合对西瓜生长的影响和对枯萎病的防效[J]. 西南农业学报,2002,15(2):65-68.
[36]田连生,冯树波. 耐药性木霉菌株的筛选及其对灰霉病的防治[J]. 生物技术,2005,15(5):26-28.
[37]田连生. 抗药性木霉菌株的选育及其与多菌灵的协同作用[J]. 核农学报,2008,22(1):32-35.
[38]田连生,陈 菲. 木霉菌剂与多菌灵协同防治灰霉病试验[J]. 江苏农业科学,2013,41(12):132-133.
[39]任凤山,王 燕,翟一凡,等. 木霉与几种化学杀菌剂协同防治苹果轮纹病[J]. 北方园艺,2015(16):111-115.
[40]袁 扬,王胤晨,韩玉竹,等. 木霉菌在农业中的应用研究进展[J]. 江苏农业科学,2018,46(3):10-14.
[41]鲁海菊,刘云龙,张云霞,等. 哈茨木霉多菌灵耐药性菌株的筛选[J]. 云南农业大学学报,2005,20(3):436-437.
[42]田连生. 紫外光诱导哈茨木霉产生对多菌灵抗药性的菌株[J]. 农业环境科学学报,2007,26(1):318-321.
