基于深度神经网络的肿瘤细胞分类器的研究
2020-10-23孙运文徐秀林
孙运文 徐秀林
摘 要:近年来随着深度神经网络(Deep Neural Networks, DNN)的模型不断完善,DNN在肿瘤的数字图像识别方面精度越来越高,DNN受到了国内外医学界的广泛研究和重视,DNN为识别良性肿瘤与恶性肿瘤的临床诊断提供了客观、准确、快速、经济的解决方案。本文主要综述了DNN技术在识别良性肿瘤与恶性肿瘤方向上使用的几种常见分类器:卷积神经网络、生成对抗网络、深度残差网络和深度信念网络。分析了这几种分类器的原理及其应用的效果,分析了基于不同神经网络分类器的精准度和性能,提出了DNN的各种分类器在识别良性肿瘤与恶性肿瘤领域中面临的问题及未来发展的趋势。
关键词:深度神经网络;人工智能;分类器;肿瘤
中图分类号:TP301 文献标识码:A
Research of Tumor Cell Classifier based on Deep Neural Network
SUN Yunwen, XU Xiulin
(School of Medical Instrument and Food Engineering, University of Shanghai for Science and Technology, Shanghai 200093, China)
sunyunwen@foxmail.com; xxlin100@163.com
Abstract: In recent years, with the improvement of deep neural networks (DNN) models, the accuracy of digital image recognition of tumors has been improved continuously. DNN provides an objective, accurate, fast and economic solution for the clinical diagnosis of benign and malignant tumors. This technology has been widely studied and paid attention to by the medical community at home and abroad. This paper reviews several DNN classifiers (Convolution Neural Network, Generative Adversarial Network, Deep Residual Network, and Deep Belief Network), analyzes the accuracy and performance of these neural networks based on different classifiers, and forecast the future development trend of DNN classifiers.
Keywords: deep neural network; artificial intelligence; classifier; tumors
1 引言(Introduction)
腫瘤按照生长方式的不同划分为良性肿瘤与恶性肿瘤,两者对人体的危害性和手术治疗方法有非常大的区别,因此准确识别良性肿瘤与恶性肿瘤有着巨大的临床意义,恶性肿瘤发病例预计在2030年将达到2220万例[1],恶性肿瘤毫无疑问已经是人类的头号大敌。
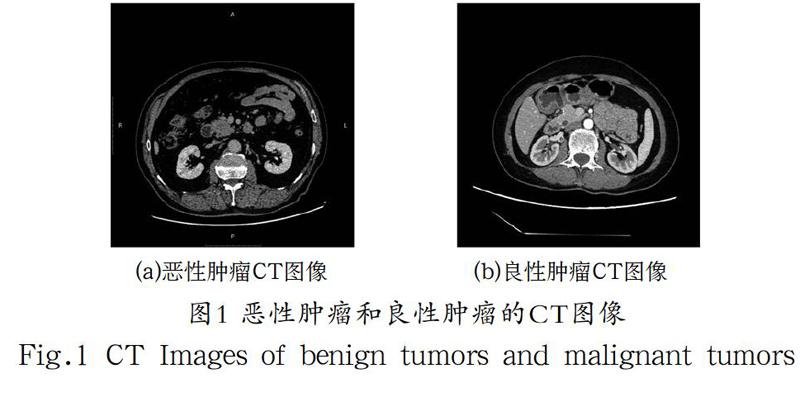
早期体检筛查是最常见的发现恶性肿瘤的方法也是最有效预防恶性肿瘤的方法,目前诊断识别一个肿瘤是良性肿瘤还是恶性肿瘤的主要方法有如下两种:病理诊断和影像诊断,病理诊断即活体组织检查,活体穿刺对身体具有一定的伤害性,并且诊断时间较长。影像诊断良性肿瘤与恶性肿瘤的判断依赖医生的经验,观察良性肿瘤和恶性肿瘤的电子计算机断层扫描图片(Computed Tomography, CT),两者具有比较高的相似性,如图1所示。不同的医生得出的结论也有可能不同,耗费患者大量的时间与精力。因此使用深度神经网络(Deep Neural Networks, DNN)区分和诊断良性肿瘤与恶性肿瘤不仅节省了患者和医生的时间,提高了医疗资源的效率,随着识别的准确度越来越高对临床的意义也越来越重大,在医学上的应用具有很大潜力。分类器的选择对于恶性肿瘤识别的准确度有着很大的影响,本文将对近几年常见的分类器进行综述。
2 DNN模型与应用(DNN models and its application)
判断一个肿瘤是否为恶性肿瘤是一个典型的二分类问题,在深度学习神经网络领域中,期望计算机对于问题的答案能够正确地回答,但是计算机通常不能给出直接正确的答案,所以通常采用0和1之间的识别率来计算。对于医生来说,判断CT图片中的肿瘤是否为恶性肿瘤并不是一个确定的答案,医生判断恶性肿瘤不仅依赖CT图片的清晰度和准确度,还依赖于医生个人的经验,但是DNN判断恶性肿瘤则简单的多,DNN可以读取图片的数字特征(如图像的大小、通道数等),区分出良性肿瘤与恶性肿瘤CT图片的区别。使用不同的DNN模型有着不同的优势和效果。
2.1 卷积神经网络
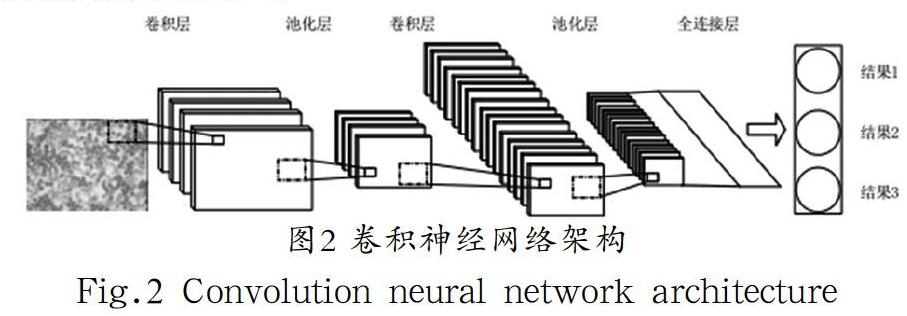
Hubel和Wiesel在1962年发现猫和其他哺乳动物的大脑视觉皮层中包含了多层细胞,每部分的细胞都有着不同的感知作用,通过电刺激不同部分的细胞会产生不同的视觉反应,这是计算机视觉的基础,Lecun等[2]对Hubel和Wiesel的研究加以改进,在神经网络中创造性的代入了传播算法,并以此基础构建了卷积神经网络(Convolutional Neural Networks, CNN)。2012年后Krizhesky等[3]利用图形处理器(Graphics Processing Unit,GPU)强大的图片处理性能开发了更为深层次的神经网络AlexNet,使CNN框架得到了进一步的强化,如今CNN已经有很多应用在医学影像的识别和处理上。并且经过不断的迭代优化,已经构成很多以CNN为架构的变化分类器[4]。CNN一般由三种不同类型的层组成:卷积层、池化层与全连接层。以LeNet-5CNN为例,LeNet-5CNN是由LeCun于1998年设计的卷积神经网络,这个卷积神经网络基于梯度并且加入了反向传播算法进行了反监督训练,这是最早的卷积神经网络原型。在常见的卷积神经网络中第一层卷积层的作用是从输入的数据中抽象并利用设计好的算法提取数据的不同特征值。第一层卷积层的功能很简单,主要提取形状、线条、颜色等较为简单的低层特征值,接下来需要更深的层次才能从低层特征中迭代提取更复杂的特征。第二层池化层(Pooling)从形式自上向下采样,池化层提高了模型泛化能力,对图像的识别范围有了大大提高。全连接层的位置与普通神经网络中全连接层的位置相同,全连接层将上一层池化层自上向下采样的神经元信息与当前的层进行全连接生成全局特征信息,全连接层通常使用N维向量作为输出,最终分类器或回归方程分析N维向量并输出最后的结果。
任湘等[5]在做关于乳腺癌分子分型預测时采用了新的方法,借助了深度卷积神经网络进行了预测实验,并且取得了很好的实验效果。在实验中他们依据乳腺癌分子分型为Luminal A、Luminal B、HER-2、Basal-like四种,他们使用了原始乳腺癌病灶区域的核磁共振成像(Magnetic Resonance Imaging,MRI),提取了这些MRI图像以后他们对这些MRI又进行了二次加工处理,使得CNN可以提取MRI的特征信息,随后他们选择CNN对其进行卷积运算,通过对CNN参数的优化不断提高了模型的精度。最后,他们使用训练集完成了最终的训练并对训练集的预测结果进行了分析。实验结果表明,通过CNN对乳腺癌MRI进行处理、提取特征和学习,最后对乳腺癌的预测结果吻合度大于70%,实验表明CNN基本完成了预测任务。
CNN擅长多层分类,在多分类任务中CNN的准确度明显比其他分类器有更高的准确度,CNN特有的多层堆叠、局部连接、权值共享和池化等特性其他分类器并不具有。所以一般的医学图像分类任务,通常首选分类器为CNN。CNN的网络构架如图2所示[6]。
2.2 生成对抗网络
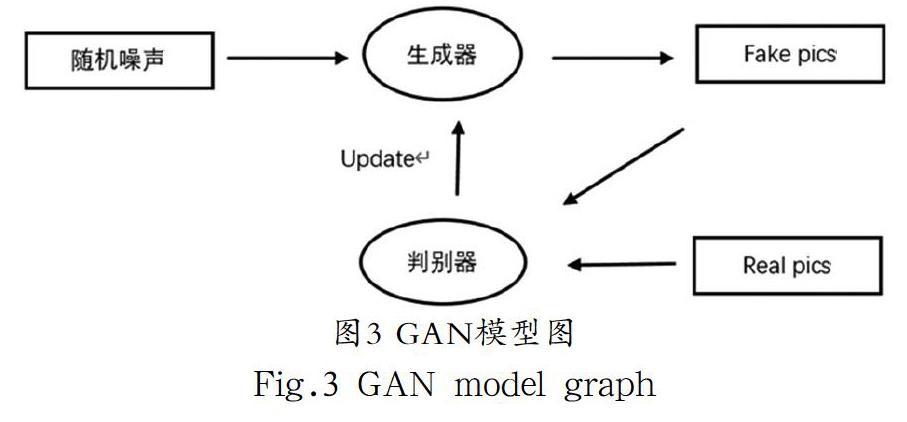
2014年,Goodfellow等人[7]提出了生成对抗网络(Generative Adversarial Networks, GAN)。GAN的结构由生成器和判别器组成,是在一个复杂分布上无监督学习的分类器,虽然GAN拥有比较清晰和完善的逻辑架构,但是在一开始GAN对多层分类任务的识别准确度并不高,此后研究人员的研究重点一直在提高GAN的准确度[8],目前通过研究人员的不断努力GAN已经到达了一个比较高的完成度,GAN已经是二分类任务中最有潜力的方法。
如图3所示,GAN由两大核心部分组成,分别为生成模型和判别模型,生成模型在不断读取数据源中的特征数据,同时不断学习数据源中的特征信息,然后生成伪样本,伪样本的功能是混淆判别模型。而判别模型通过学习真实样本和伪样本的差异,分析出规律。生成模型和判别模型不断交流的过程就是数据不断生成和对抗的过程。GAN的优势在于训练样本不足的情况下,仍然能有效分辨出原有数据的分布规律。
GAN的判别率很大程度上依赖样本集的数量和质量,其中样本集的数量尤其重要,数据量很大的样本集即使质量不是很高,GAN也可以慢慢自我学习强化,达到训练的目的,数量的优势可以大大弥补样本集质量的不足。一般普遍认为在处理图像分类任务的时候使用GAN相比于其他分类器并没有展现出很大的优势,但是在图像生成、图像优化方面GAN时相比于其他分类器具有独一无二的价值。所以在分辨肿瘤细胞是否为恶性肿瘤的时候GAN是一个绕不开的分类器,当现有的肿瘤CT图片清晰度不高的时GAN无疑是一个很好的选择。GAN可以弥补图像质量不高的特性还使得GAN在图像超分辨率领域成为首选分类器,Lin等[9]提出了由密集连接的深卷积层发生器网络和鉴别器组成生成对抗网络框架的SR无监督学习方法,该方法的正确运行证明了无监督学习的单图像SR算法的可行性和有效性。
GAN分类器在按种类分辨图像方面略显劣势,但其学习图像、图像优化方面远远领先其他分类器,在临床上也占据了一席之地。判别肿瘤是否为恶性肿瘤是一个典型的二分类问题,GAN的判别模型也是一个典型的二分类模型,所以非常适合使用GAN来诊断和识别良性肿瘤与恶性肿瘤。
2.3 深度残差网络
将候选区域方法与CNN方法结合起来可得到精细的分割边界,并可以进行端到端训练。在Caesar等人[10]方法的基础上,结合HE Kaiming等人[11]提出的深度残差网络(Deep Residual Networks, DRN),得出一种基于区域和DRN的语义分割方法。DRN在候选区域使用生成算法在原始数据的基础上生成了数量庞大的候选数据,然后通过DRN特有的自由形状ROI池化层,抽象数据并分类最终提取多维度的特征数据,并在最终阶段进行融合。然后使用带扩张卷积的DRN进行特征提取,并使用全局平均池化层对每一个像素分类,得到最终的分割结果。
图4是一种结合区域和深度残差网络的语义分割模型[12]。网络分为三个部分,第一部分生成候选区域,第二部分是全卷积网络,该部分使用残差网络模型中前部分卷积层作为基础网络,利用扩张率的不同在最后卷积层得到特征图。第三部分为分割网络,输入第一部分生成的候选区域和第二部分得到的特征图,输出分割图像。
DRN在复杂的临床任务中较好地解决了梯度爆炸、梯度消失等问题,在分辨肿瘤细胞是否为恶性肿瘤时把DRN作为基础的分类器是一个不错的选择,同时DRN特殊的框架对其他DNN模型具有指导意义,研究人员正在致力于将DRN框架扩展到其他DNN模型,如果成功其他DNN模型将得到更为精确的预测结果。
2.4 深度信念网络
2006年,Hinton[13]提出了一种用多层网络限制Boltzmann机器(Restricted Boltzmann Machine,RBM)堆栈降维的方法,实现了无监督的自动特征学习。Hinton[14]又在此基础上增加线性分类器,无监督特征学习加上线性分类器,就形成了我们现在一般认为的深度信念网络模型(Deep Belief Network, DBN)的前身,现在一般DBN是一个由若干个RBM和一个BP(Back Propagation, BP)神经网络组成的分类器。DBN对输入的数据进行数据化处理,然后将RBM提取的特征信息输入到BP神经网络,通过有监督的BP神经网络将误差反向传播,自上向下微调整个DBN模型[15]。DBN的模型图如图5所示[16]。
DBN训练一般分为两个阶段[17],分别是逐层预训练阶段和自上向下精调阶段。在逐层预训练阶段,DBN从最底层开始自下而上训练每一层RBM网络,这种自下而上的方法可以慢慢地在每一层起到堆栈降维的作用,预训练使分类器可以更多的提取数据的特征值,特征值的提取质量越好对预测结果越有帮助。在整体自上向下精调阶段,分类器在BP神经网络中输入在上一层池化层中抽象提取的特征信息和特征向量,利用BP神经网络进行有监督的训练,最后根据结果加入参数代入计算,使预测结果变得最准确。
DBN具有高度灵活性,临床上的应用也十分靈活,相比于其他分类器,DBN拥有更快的训练速度和更少的学习时间,在分辨良性肿瘤与恶性肿瘤的方面具有很大的潜力。
3 结论(Conclusion)
随着计算机技术和人工智能技术的发展,硬件的物理速度不断提高,神经网络的模型不断完善,借助DNN对良性肿瘤和恶性肿瘤进行区分已经是势不可挡的趋势。目前DNN分类器在分辨良性肿瘤和恶性肿瘤方面存在两个主要问题:(1)由于硬件条件和计算资源的限制,DNN的训练时间过长,学习速度比较慢。(2)由于训练样本和模型深度的限制,DNN的精确度和识别率还不够贴近真实样本,不同的图像质量也对识别率有着很大的影像。
如何解决这两个问题是应用DNN在肿瘤识别领域的关键,根据摩尔定律,计算机硬件的飞速发展将极大减少DNN的训练时间,第一个问题将得到解决。解决第二个问题的关键是分类器的深度和成熟度,目前研究人员的主要研究方向是研究和开发新的层次模型并优化算法来得到更精确的识别率。相信随着网络层次的加深,分类器的构架变得完善,模型的精度将会不断提高,DNN在区分良性肿瘤和恶性肿瘤方面将拥有更好的识别率。
应用DNN分类器对肿瘤进行提前筛查,做到早预防、早治疗,不仅能提高患者的生存质量和生存率,而且大大提高了医生的效率,防止了患者病情的恶化,为病人提供了准确的治疗方案,降低了误诊率,缓解了医疗资源不足的问题,具有重要的临床意义。
参考文献(References)
[1] ALLEMANI C, MATSUDAT. Analysis of individual records for 37513025 patients diagnosed with one of 18 cancers[J]. Lancet, 2018, 391(17): 1023-1075.
[2] LECUNY, BENGIOY, HINTONG. Deep learning[J]. Nature, 2015(521): 436-444.
[3] KRIZHESKYA, SUTSKEVERI, HINTONGE. Image Net classification with deep convolutional neural networks[C]. 2012: 1097-1105.
[4] KUMARAN, VERMAR. Convolutional neural networks for wavelet domain super resolution[J]. Pattern Recognit Lett, 2017(90): 65-71.
[5] 任湘,张朋,范明,等.基于卷积神经网络的乳腺癌分子分型预测研究[J].杭州电子科技大学学报(自然科学版),2018,38(05):66-71.
[6] ZHANG J J, SHAO K. Small sample image recognition using improved convolutional neural network[J]. J Vis Commun Image Represent, 2018(55): 640-647.
[7] GoodfellowIJ, PougetAbadieJ, MirzaM, et al. Generativeadversarialnets[C]. Proc of the 27th Int Confon Neural Information Processing Systems. Cambridge, MA: MITPress, 2014(06): 2672-2680.
[8] Salimans T, Goodfellow I. Zaremba W, et al. Improved techniques for training gans[J]. arXivpreprint, 2016(01): 2226-2234.
[9] LING M, WU QX. Deep unsupervised learning for image super resolution with generative adversarial network[J]. Signal Process: Image, 2018(08): 88-100.
[10] CAESAR H, UIJLINGS J, FERRARI V. Region-based semantic segmentation with end-to-endtraining[C]. Proceedings of the 14th European Conference on Computer Vision 2016, Amsterdam, The Netherlands, 2016(01): 381-397.
[11] HE Kaiming, ZHANG Xiangyu, REN Shaoqing, et al. Deep residual learning for image recognition[C]. Proceedings of 2016 IEEE Conference on Computer Vision and Pattern. Recognition, LasVegas, USA, 2016, 39(6): 770-778.
[12] Luo Huilan, Lu Fei, Kong Fansheng. Image semantic segmentation based on region and depth residual network[J]. Journal of electronics and information, 2019, 41 (11): 2777-2786.
[13] Hinton G E, Salakhutdinov R R. Reducing the dimensionality of data with neural networks[J]. Science, 2006, 313(5786): 504-507.
[14] Hinton G E, Osindero S, Teh Y W. A fast learning algorithm for deep belief nets[J]. Neural Comp, 2006, 18(7): 1527-1554.
[15] Aliya. Aierken, Halidan. Abudureyimu, et al. A Uyghur span classification method based on deep belief networks[J]. Computer Engineering & Science, 2016, 10(10): 2134-2139.
[16] Shi Ke, Lu Yang, Liu Guangliang, Bi Xiang, et al. Deep belief network training method based on multi hidden layer Gibbs sampling[J]. Acta automatica Sinica, 2019, 45(05): 975-984.
[17] 赵文迪,陈德旺,卓永强,等.深度神经模糊系统算法及其回归应用[J/OL].自动化学报,2020,46(8):1557-1570.
作者简介:
孙运文(1996-),男,硕士生.研究领域:医学信息学.
徐秀林(1957-),女,博士,教授.研究领域:康复设备与骨科器械,医学信息学.