桦木酸提取、合成及药理作用的研究进展*
2020-10-22李美秋寇晓涵
王 悦 张 强 李美秋 寇晓涵 郑 健
(东北林业大学生命科学学院 黑龙江哈尔滨 150040)
桦木酸(betulinic acid,BA)又称白桦脂酸,是一种羽扇豆烷型五环三萜类化合物,为一种三萜烯,E 环为五元碳环,C-3 位上的羟基为β-OH,28位为羧基,其结构如图1所示。桦木酸易溶于吡啶、四氢呋喃,溶于甲醇、乙醇、乙醚、丙酮、氯仿等溶剂中,不溶于水。桦木酸具有广泛的药理作用,包括抗肿瘤、抗氧化应激、抗艾滋病病毒、抗菌、抗炎、抗寄生虫,并在改善免疫力、调节血糖方面也有一定功效,且安全性高。虽然桦木酸广泛存在于桦树(图2)等多种植物中,但含量较低,水溶性差,因此,桦木酸提取及合成的相关研究,对肿瘤等疾病的治疗及生物活性利用都具有重要的意义。
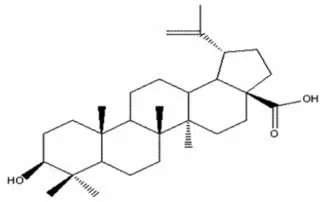
图1 桦木酸结构

图2 桦树
1 桦木酸提取及合成
桦木酸广泛存在于桦木属植物白桦中,桉树球、胡芦巴、桑白皮、酸枣仁、杜仲、柿蒂、睡菜叶、迷迭香、匙萼金丝桃及苹果等植物中也发现桦木酸的存在。近年来,在其他植物中也检测到桦木酸。徐凌玉等[1]采用多种柱色谱技术对薄荷提取得到的天然产物进行分离纯化,利用波谱分析方法鉴定,分离得到11 个化合物,其中包括桦木酸。王丽华等[2]检测暴马丁香中桦木酸的含量发现,枝条中桦木酸质量分数最高,树皮中次之,叶片中最低。王宇等[3]利用超声辅助提取工艺从泽兰中提取并测定了桦木酸含量为(5.31±0.04)mg/g,高于酸枣仁。
桦木酸的制备方法已取得一定进展,获得方式一般有直接提取法、化学合成法及生物合成法。
1.1 直接提取法 直接提取法即以甲醇、乙醇、氯仿等有机溶剂作为溶剂进行提取,再将获得的粗品纯化,从而获得纯品的方法。例如,从乌骨藤中提取桦木酸时,用数量倍的70%乙醇将乌骨藤加热回流2~3 次,将提取液减压蒸干,依次通过石油醚、乙酸乙酯、饱和正丁醇萃取剂进行萃取,再将萃取液减压蒸干,经柱层析梯度洗脱,再经液相色谱仪纯化,即可得到桦木酸纯品。Djamen 等[4]在真空中浓缩黄花苜蓿小枝的甲醇提取物,然后通过硅胶柱色谱分离,得到3 种新的五环三萜类化合物和14 种已知的代谢物,其中包括桦木酸。目前,直接提取法包括以下方式:加压液体萃取法、超临界萃取法、亚临界水提取、超声波提取法。
1)加压液体萃取法。加压液体萃取法是在较高的温度和压力下,用溶剂对固体或半固体样品进行萃取的技术,其萃取是在一个加压并配备溶剂控制器的萃取系统内进行。Pinilla 等[5]依次用甲醇、乙酸乙酯作为萃取剂萃取,经过多次阶梯式升温得到萃取液,最后利用旋转蒸发仪蒸干得到桦木酸粗品。此方法提取过程自动化,极大缩短萃取时间,节约人力,明显降低萃取溶剂使用量,成本较小,且萃取过程在密闭系统中进行,减少溶剂挥发和对人体的危害,减少环境污染,但是样品收率低。
2)超临界萃取法。超临界萃取法具有萃取和分离的双重作用,目前,此技术在去除有害成分、提取有效成分的研究上,已取得明显的成果。Krasutsky 等[6]利用超临界萃取法,从桦树皮中提取桦木酸,纯度可高达95%。Plander 等[7]将超临界流体超高性能收敛色谱系统与蒸发光散射检测器结合,从梧桐树树皮中提取出桦木酸。超临界萃取法环保高效,成本低,应用前景十分广泛。
3)亚临界水提取。亚临界水提取技术是通过改变萃取温度改变水的极性、表面张力和粘度,进而从桦树皮中选择性地萃取桦木酸。Liu 等[8]利用亚临界水提取法从桦树皮中提取桦木酸,收率高于传统提取方法,且提取物中的杂质更少。此方法通常用于萃取难萃取的天然产物,在短时间内完成,并可连续处理。由于提取时间短、成本低、无污染,又称为“绿色的处理法”。
4)超声波提取法。超声波提取法可从植物中提取生物活性物质,将化学试剂与原料按一定的比例混合,置于已设定频率和温度的超声容器内,在一定的温度下,内容物释放,并溶解于化学试剂中。Hossain 等[9]以悬铃木树皮为原料,将乙酸乙酯与树皮混合后置于超声容器中,获得桦木酸。Song 等[10]从枣果中使用超声法提取了总三萜类化合物,其中包括桦木酸。超声波提取法高效节能,制备工艺简单,应用也较广泛。
1.2 化学合成法 化学合成法包括直接合成法和半步合成法。
1)直接合成法。直接合成法是在利用乙醇等有机溶剂提取桦木醇的同时,将四甲基哌啶等氧化剂附着在固体载体上,在50℃下氧化提取物,即可得到桦木酸。由于直接合成法同时提取桦木醇和制备桦木酸,杂质种类及含量较多,由此影响桦木酸纯度,产率也很低,产业化应用困难。
2)半步合成法。半步合成法有2 种方式,一种是以桦木醛为中间体制备桦木酸,另一种以桦木酮酸为中间体制备桦木酸。Pichette 等[11]采用第1种方式,将氧化剂CrO3吸附在硅胶上,在SiO2的催化下,桦木醇氧化为桦木醛,再以高锰酸钾作为氧化剂、丙酮作为溶剂将桦木醛氧化为桦木酸。此方法产物复杂,难以分离纯化,且产率较低,因此,基本不使用这种方法。第2 种方式是用琼斯试剂作为氧化剂、丙酮作为溶剂,将桦木醇氧化为桦木酮酸,再以硼氢化钠作为还原剂、THF 作为溶剂,将桦木酮酸还原得到桦木酸[12]。此方法操作简便,反应条件较温和,适用于大规模生产。Hossain 等[9]用IBX作为氧化剂,在DMSO 和THF 混合溶剂中,桦木醇氧化为桦木酮醛,然后在四丁基高锰酸铵作用下,将桦木酮醛氧化为桦木酮酸,最后,桦木酮酸在硼氢化钠的作用下还原为桦木酸。此方法操作简单,桦木酸的收率较高。谢洋等[13]以桦木醇作为原料,在丙酮溶液中与K2CrO7-H2SO4进行催化氧化成桦木酮酸,再以NaBH4为还原剂合成桦木酸。陶冉等[14]对桦木醇C-28 和C-29 位进行修饰,引入醛基,得到C-28 位和C-29 位桦木酸。此法相比于桦木醇半合成法工艺更简单,转化率和桦木酸纯度都较高,应用前景较好。
1.3 生物合成法 桦木酸广泛分布于多种植物中,虽然化学合成法是获取桦木酸的主要方法,但存在收率低、高耗能等问题。三萜酸类化合物的生物合成途径过程一般有3 个阶段,分别为中间体异戊烯基焦磷酸(IPP)和异构体二甲基丙烯基焦磷酸(DMAPP)的生成、基本前体物质鲨烯的生成,以及三萜酸类化合物的生成。在某些植物细胞中,羽扇豆醇合成酶(LUP)催化2,3-环氧鲨烯生成羽扇豆醇,再由CYP716A 亚家族C-28 氧化酶及其还原伴侣(CPR)催化羽扇豆醇在C-28 位发生3 次连续氧化,依次转化成桦木醇、桦木醛,最后生成桦木酸[15]。
Chen 等[16]发现桦木酸可能通过微生物降解,经氧化后可生成桦木酸或其他代谢产物,经实验,他们从8 个菌株中筛选出桦木酸收率最好的菌株——臭曲霉菌;Feng 等[17]将小克银汉霉菌和蜜环菌在含有桦木醇的培养基上培养,在这2 种菌的代谢产物上都分离得到了桦木酸;Li 等[18]发现,酿酒酵母可通过平衡脂肪酸和桦木酸生物转化机制提高桦木酸产率。王冬[15]首先在三萜底盘细胞BYT3 的rDNA 多拷贝位点引入来自乌拉尔甘草的羽扇豆醇合酶基因,以及MVP 途径限速酶3-羟基-3-甲基戊二酰辅酶A 还原酶基因,从而获得桦木酸前体羽扇豆醇的底盘细胞BY-LUP02,经过筛选7 种细胞色素P450 还原酶,得到效果最佳的拟南芥细胞色素P450 还原酶2,最终获得高产桦木酸的细胞工厂BY-BA42。黄嘉键[19]将拟南芥中的羽扇豆醇合成酶基因AtLUPs及RoCYP-34445,导入至酿酒酵母BY4741 细胞中,在酵母体内构建了桦木酸生物合成途径。从目前研究来看,虽然生物转化机制较为复杂,但成本低,反应条件温和,安全环保,因此受到人们关注,仍需进一步研究。
除了以上几种获取桦木酸的方法之外,还有一些新兴方法,例如,通过生物活性引导的分级分离法等。
2 桦木酸的药理活性
桦木酸具有多种药理活性,主要包括抗肿瘤、抗氧化应激、抗菌消炎等,对于治疗艾滋病及改善免疫力等方面也有显著效果。
2.1 桦木酸抗肿瘤的研究 最早Pisha 等[20]发现桦木酸会诱导细胞凋亡进而抑制黑色素瘤生长。目前,已取得的研究结果显示,桦木酸及其衍生物对多种肿瘤细胞具有广泛的作用,例如,对乳腺癌、前列腺癌、卵巢癌、食道癌、肝癌、成胶质瘤、骨肉瘤及横纹肌肉瘤等均有抑制作用。桦木酸有一定的毒性,但毒性极低,研究发现即使剂量高达500 mg/kg 时,小鼠也并未出现任何毒性反应,且对多种肿瘤细胞有较强的抑制毒杀效应,而目前临床上常用的肿瘤药物细胞毒性较大,因此,桦木酸用做抗肿瘤药物具有广阔的应用前景。研究发现,桦木酸抗肿瘤作用的机理包括改变染色体的特征、直接作用于DNA、增强免疫机制及钙泵活性、抑制酶类及影响细胞周期,以发挥其抗肿瘤的作用。
对于头颈癌,桦木酸是通过增强caspase 的活性,抑制前细胞凋亡蛋白进而毒杀瘤细胞。研究表明,桦木酸作用于神经内胚层瘤的线粒体,使其释放凋亡因子,进而诱导肿瘤凋亡[21]。由于桦木酸对人肺癌A549 和Lewis 肺癌小鼠有明显的抗肿瘤作用,闵雨[22]通过体外实验,以抑瘤率为指标,研究桦木酸的最佳剂量。化疗药物通常会产生耐药性,Zhan 等[23]研究了桦木酸对紫杉醇抗性肺癌细胞系(H460)的抗癌潜力,结果表明,桦木酸可能是治疗耐药性肺癌的有用药物。Yang 等[24]评估桦木酸在体外和体内对人肾癌细胞的抗癌活性,证明了BA 在人肾癌细胞中的抗癌潜力是通过触发细胞凋亡并抑制其迁移和侵袭实现的。
2.2 桦木酸抗氧化应激的研究 自然界有很多天然活性物质能调控机体的氧化应激和免疫反应,保障机体稳态及正常的生理机能。研究表明,桦木酸对机体具有抗氧化应激作用。黄淑贤等[25]发现桦木酸能提高大鼠胃粘膜组织中SOD、GSHPx活性,降低MAD 含量,说明桦木酸能保护胃黏膜损伤、增强胃粘膜抗氧化能力及抑制自由基。地塞米松(Dex)是一种有效的抗炎及免疫抑制剂,已被证明可诱导氧化应激反应,Zhu 等[26]发现BA可有效减轻Dex 诱导的氧化损伤。这些保护作用可能部分通过JNK-P38 MAPK 信号转导途径介导,BA 可能由于其抗氧化特性而成为潜在的治疗剂。易想炼等[27]通过实验发现,桦木酸能改善环磷酰胺引起的小鼠免疫器官的氧化应激反应,且对环磷酰胺诱导的氧化损伤有预防性的保护作用。
2.3 桦木酸抗艾滋病的研究 艾滋病又称获得性免疫缺陷综合征,目前临床治疗方法主要是应用逆转录酶抑制剂和蛋白酶抑制剂。但有60%的患者由于药物毒性和耐药性而导致治疗失败,因此,研制新的抗病毒药物十分迫切。研究表明,桦木酸类衍生物抗艾滋病主要有3 种方式:桦木酸抑制病毒与细胞膜融合过程中的后结合、作为HIV 成熟抑制剂,以及同时作为HIV-1 融合和成熟抑制剂。与目前所使用的抗HIV-1 药物相比,桦木酸针对性更强,不良反应较小,有很大的应用前景。
2.4 桦木酸免疫调节的研究 桦木酸最主要的作用还包括免疫调节。Freysdottir 等[28]发现桦木酸可调节人单核细胞衍生的树突细胞,使其与T 细胞相互作用,进而发生免疫作用。易金娥等[29]在体外测定了小鼠腹腔巨噬细胞能量代谢水平、吞噬能力、肿瘤坏死因子分泌量与谷胱甘肽过氧化物酶活性、胞外NO 释放量及SOD 与溶菌酶活性的影响,对比结果发现,桦木酸能激活巨噬细胞,提高其吞噬能力和能量代谢水平,增强抗氧化能力,提高机体的免疫力。
2.5 桦木酸抗菌、抗炎的研究 研究发现,桦木酸在体外能降低微生物的活性,例如,枯草杆菌、大肠杆菌、微球菌、金黄色葡萄球菌、表皮葡萄球菌及结核分支杆菌等,但对橘青霉无任何毒性作用[30]。桦木酸对血清素和角叉菜胶所引起的大鼠足底肿胀也有明显的抑制作用[31]。桦木酸还可减轻银屑病症状和炎性皮肤病变[32]。除了对实验性炎症模型有明显的抗炎作用之外,桦木酸与其他天然产物还有协同抗炎的作用[33]。
2.6 桦木酸抗寄生虫的研究 桦木酸能在体外抑制恶性疟原虫,且对红细胞期的疟原虫抑制效果更强,桦木酸C-3 和C-28 衍生物可在体外抗疟原虫,并表现出较强的活性[34],但体内试验并无明显作用。研究发现用乙酸乙酯提取的桦木酸培养蠕虫7 d,其死亡率高达98%,效果十分明显[35]。
2.7 其他药理活性的研究 桦木酸具有很高的抗糖尿病活性,通过激活电生理机制刺激胰岛素的分泌,并诱导与代谢生化作用相关的细胞去极化,进而激活PKC 并确保胰岛素的分泌[36]。众所周知,糖尿病会导致许多并发症,其中糖尿病引起的肝脏病变最为常见,包括非酒精性脂肪肝及肝纤维化。刘妙娜等[37]对四氯化碳诱导雄性大鼠肝纤维化的小鼠进行桦木酸干预治疗,并以秋水仙素作为对照,结果发现桦木酸具有抗肝纤维化的活性。最新研究表明,桦木酸还有可通过保护微循环,减轻炎症反应和上调BDNF 表达而在老年性痴呆(AD)的治疗中发挥作用[38]。血管性痴呆(VaD)是老年性痴呆的第2 种最常见形式,桦木酸能保护神经,并具有恢复认知障碍和海马神经化学的能力[39]。此外,桦木酸还具有镇痛、抗焦虑、驱蠕虫、抗溃疡、抗HSV-1 的作用。
3 展望
桦木酸的合成及其药理作用一直是研究的热点,桦木酸及衍生物对于抗肿瘤、抗艾滋、抗菌、抗炎、抗寄生虫等具有较强的生物活性,且毒性低,安全性高,应用前景广阔。随着研究的深入和科学技术的发展,桦木酸制备方法也在不断优化,这为桦木酸药理作用的应用也起到了推动作用。目前,研究人员利用纳米技术,不仅保留桦木酸的生物活性,还解决了桦木酸水溶性差的缺点;此外,人们也致力于合成多种桦木酸的衍生物,以改善桦木酸的缺点,提高其应用前景。虽然桦木酸研究广泛,但桦木酸在抗炎抗菌等药理方面应用还很少,具有进一步研究的价值。
