不同氨基聚糖对巨噬细胞极化的影响
2020-10-20尹玉韩硕王国锋王琦金元哲
尹玉,韩硕,王国锋,王琦,金元哲
(中国医科大学附属第四医院心内科,沈阳 110032)
透明质酸 (hyaluronic acid,HA) 和硫酸软骨素(chondroitin sulfate,CS) 是2种不同的氨基聚糖,且已证实均是可靠的细胞移植可降解生物支架材料[1]。巨噬细胞可极化为M1和M2型,研究[2]显示巨噬细胞对组织的炎症反应起重要作用。M1型巨噬细胞促进炎症反应[3-4],M2型巨噬细胞起抗炎作用[5-6]。白细胞介素-1β (interleukin-1β,IL-1β)、肿瘤坏死因子-α (tumor necrosis factor,TNF-α) 及诱导性一氧化氮合酶 (inducible nitric oxide synthase,iNOS) 为M1型巨噬细胞特征性细胞因子[3,7-9];而精氨酸酶-1(arginase-1,Arg-1) 是M2型巨噬细胞特征性细胞因子[3,7,9-11]。本研究通过实时qPCR检测IL-1β、TNF-α、iNOS、Arg-1mRNA表达,分析HA和CS对巨噬细胞极化的影响,旨在选择更好的支架材料,减少细胞移植的炎症反应和炎症损伤。
1 材料与方法
1.1 HA及CS水凝胶支架材料制成
按照已知方法[1]合成CS-N羟基琥珀酰亚胺 (N hydroxysuccinimide,NHS)及HA-NHS。将HA/CS-NHS加入到磷酸盐缓冲液 (phosphate buffer saline,PBS) 中制成10%混合液,再将混合液和胎牛血清 (体积比为1 ∶1) 制成HA/CS-血清水凝胶。其中CS-血清水凝胶制成中,先在胎牛血清中加入Bobine血清白蛋白(20 g/dL),然后再与CS混合以促进CS-FBS 水凝胶凝固。
1.2 巨噬细胞提取及培养
1.2.1 骨髓源性巨噬细胞 (bone marrow derived macrophage,BMDM )提取与分化[12-13]:6~8周龄小鼠分离出股骨和胫骨,用25G针头和10 mL注射器吸取冷PBS液冲洗骨髓,并用70 μm细胞过滤器除去杂质 (骨质、毛发和其他细胞组织)。在滤过的溶液中加入1×红细胞裂解液 (10 mL),在37 ℃水浴中培养5 min除去血红细胞,然后室温条件下 500g离心5 min,在离心管底部获得所需细胞,抽吸出上层清液,用BMDM生长液轻轻溶开离心管底部细胞团,放入37 ℃ 5%CO2培养箱中培养 (24孔板,2×105/孔),每3 d更换新鲜BMDM生长液[12-13],7 d后获得BMDM。选用未经组织培养处理的细胞培养皿培养BMDM以便于细胞分离和收集。将BMDM培养皿自培养箱中取出,放冰面0.5 h,然后轻轻敲弹皿底使细胞脱离培养皿,用移液管吸出[13]。
1.2.2 BMDM水凝胶植入与培养:将BMDM细胞(8 000/μL) 混入胎牛血清中,再与10% CS/HA-NHS的PBS混合液 (体积比 1 ∶1) 混合制成HA/CS-血清水凝胶。在凝胶凝固过程中快速抽取凝胶液放入培养板中,凝胶凝固后 (30~60 s) 将IMDM培养液注入培养板内 (12孔培养板,细胞2×105/孔,水凝胶50 μL/孔)。HA和CS 2组均25个水凝胶标本。
1.3 实时qPCR检测
分别在细胞培养0、4、24、48、72 h各组收取5个标本进行实时qPCR分析 (美国Applied Biosystems QuantStudio公司)。使用高纯度RNA提取试剂 (荷兰Roche公司) 提取mRNA。使用 iScript cDNA合成试剂 (荷兰Bio-Rad公司) 合成cDNA。将cDNA+引物+sensiMix SYBR Hi-ROX (比利时Bioline公司) 共同加入试管制成20 μL溶液。引物[3,7-11]包括M1极化基因IL-1β、TNF和iNOS和M2极化基因Arg-1,内参为GAPDH。引物序列为:IL-1β,F,5’-GGCAACCGTACC TGAACCCA-3’;R,5’-CCACGATGACCGACACCAC C-3’。TNF,F,5’-CCCTCACACTCAGATCATCTTC T-3’;R,5’-GCTACGACGTGGGCTACAG-3’。iNOS,F,5’-CCGAAGCAAACATCACATTCA-3’;R,5’-GGTCTAAAGGCTCCGGGCT-3’。Arg-1,F,5’-TGTCCCTAATGACAGCTCCTT-3’;R,5’-GCATCCACCCAAATGACACAT -3’。GAPDH,F,5’-ATACGGCTACAGCAACAGGG-3’;R,5’-GCCTCTCTTGCTCAGTGTCC-3’。
1.4 统计学分析
2 结果
结果显示,与0 h比较,48 h HA水凝胶巨噬细胞中的TNFmRNA和iNOSmRNA增加 (P< 0.05)。与0 h比较,48 h CS水凝胶巨噬细胞中的Arg-1mRNA增加 (P< 0.05)。见表1、2。
3 讨论
巨噬细胞可分为经典激活的M1型和替代激活的M2型,它们对炎症反应的作用完全不同。M1型巨噬细胞促进炎症反应,破坏细胞外基质[3-4],M2型巨噬细胞起抗炎作用,促进细胞外基质重建,促进细胞增殖和血管再生[5-6]。研究已经证实M1型巨噬细胞加重器官和机体损伤[3-4],M2型巨噬细胞可以减少损伤[4,14]。
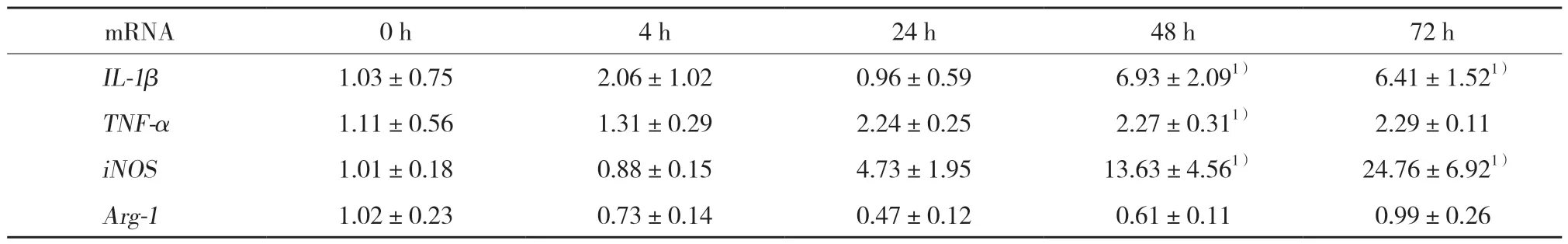
表1 实时qPCR检测HA水凝胶中细胞培养不同时间IL-1β、TNF、iNOS、Arg-1 mRNA结果Tab.1 mRNA expression of IL-1β,TNF-α,iNOS,and Arg-1 in the context of an HA-based hydrogel at different time points by RT-qPCR
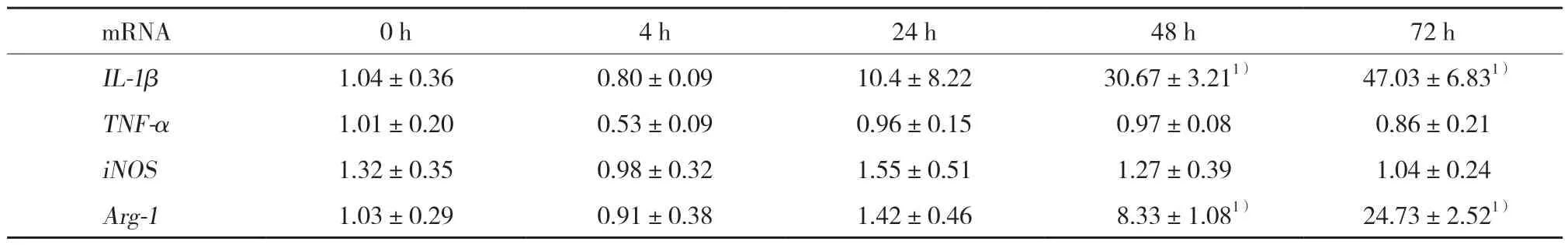
表2 实时qPCR检测CS水凝胶中细胞培养不同时间IL-1β、TNF-α、iNOS、Arg-1 mRNA表达结果Tab.2 mRNA expression of IL-1β,TNF-α,iNOS,and Arg-1 in the context of a CS-based hydrogel at different time points by RT-qPCR
有研究[15-16]发现,M1诱导因子LPS/IFN-γ促进HA与巨噬细胞结合;而M2诱导因子IL-4促使CS与巨噬细胞表面的CD44受体结合。因此,HA和CS很可能对巨噬细胞表型的转换起不同的作用,即HA使巨噬细胞极化为具有促炎作用的M1型,而CS使巨噬细胞极化为具有抗炎作用的M2型。本研究结果显示,HA水凝胶中培养的巨噬细胞TNF-αmRNA和iNOSmRNA增加,TNF-α为M1型巨噬细胞分泌的特征性细胞因子,iNOS为M1型巨噬细胞的特异基因,因此表明HA培养的巨噬细胞很可能向M1型极化;而CS水凝胶培养的巨噬细胞中Arg-1mRNA增加,Arg-1为M2型巨噬细胞的特异基因,表明CS中培养的巨噬细胞很可能向M2型极化。HA和CS对巨噬细胞极化的不同影响可以解释目前已经存在的一些研究结果,即HA和 CS 在炎症反应中有相反的作用。细胞移植过程中,HA被组织中和细胞分泌的蛋白酶水解为低聚糖的过程中产生促炎作用[17-18],而CS则具有抗炎作用[19-20]。本研究中HA和CS对巨噬细胞极化的不同影响证实了它们在细胞移植过程中对组织的不同影响,为临床医生选择更优质的细胞移植支架材料提供了参考方案。
本研究HA或CS水凝胶培养48 h的巨噬细胞中均检测出IL-1βmRNA表达增加,这可能与实验操作导致细胞损伤,致使其出现炎症应答,释放IL-1β有关;此外,水凝胶支架材料的触碰和挤压也会使细胞损伤,从而释放IL-1β。本研究不足之处:(1) 检测的细胞因子种类较少,对不同表型巨噬细胞其他的特征性细胞因子尚未检测,并且对氨基聚糖极化巨噬细胞过程中启动的信号通路缺乏验证;(2) 样本较小,结果仍需扩大样本量进一步证实。
综上所述,HA可能使巨噬细胞极化为具有促炎作用的M1型,而CS可能使巨噬细胞极化为具有抗炎作用的M2型。因此,与HA比较,CS可以减少组织细胞炎症损伤,更适合作为细胞移植的支架材料。
