硫化氢对大鼠基底动脉血管平滑肌细胞迁移、增殖及舒张作用的影响
2020-10-13陈锦花陈志武
陈锦花,陈志武
硫化氢(hydrogen sulfide,H2S)是继一氧化氮(nitric oxide, NO)和一氧化碳(carbon monoxide, CO)后发现的体内第3种气体信号分子[1]。血管内皮来源的H2S可通过舒张血管平滑肌细胞(vascular smooth muscle cells,VSMCs)调节血管张力和器官血流量[2]。血管内皮生长因子受体2(vascular endothelial growth factor receptor-2,VEGFR2)介导了VEGF(vascular endothelial growth factor, VEGF)的大部分生物学效应,是内皮细胞中VEGF驱动反应的主要调节因子。VEGF作为促进因子,通过激活血管VEGFR2产生级联反应促进血管内皮细胞的存活、增殖、迁移[3]。最近,有文献[4]报道H2S通过断裂内皮细胞靶分子VEGFR2中Cys1045-Cys1024之间新的S-S键发挥内皮细胞的增殖、迁移等作用。但是,H2S对VSMC的迁移、增殖及舒张作用是否与VEGFR2有关,尚未见报道。因此,该实验以VEGFR2为研究对象,应用VEGFR2受体阻断剂SU5416[5],探讨H2S对VSMC迁移、增殖及舒张的影响,并揭示其与VEGFR2的关系,进而阐明H2S促进VSMC舒张作用的具体机制。
1 材料与方法
1.1 实验材料
1.1.1主要试剂 NaHS实验前用蒸馏水溶解后避光保存,购自美国Sigma公司;SU5416购自美国MCE公司;重组大鼠VEGFA/VEGF164购自无锡Novopeotein公司;alpha SMA抗体(1 ∶200)购自常州Affinity公司;DMEM培养基购自美国Hyclone公司;胎牛血清购自美国Sigma公司;DAPI染色液购自上海碧云天生物技术研究所;胰酶购自南京维森特生物技术有限公司;CCK-8试剂盒购自美国Sigma公司;其余试剂均为国产分析纯。
1.1.2仪器 电子天平(FA1004)购自上海天平仪器厂;连续变倍体式显微镜(XTS-20)购自北京泰克仪器有限公司;全自动活细胞成像仪(Celldiscoverer 7.0)购自德国蔡司公司。
1.1.3动物 清洁级健康SD大鼠20只,体质量180~220 g,雌雄各半,6~8周龄,由安徽医科大学实验动物中心提供[合格证号:(皖)scxk2017-001],饲养温度为(22±3)℃。动物实验均符合安徽医科大学动物伦理委员会规定。
1.2 方法
1.2.1VSMC的培养与鉴定 取2只大鼠,麻醉后无菌状态下断头取脑,在冰的无菌PBS中,显微镜下,小心剥离基底动脉的周围组织,将基底动脉剥离干净,置于另一有冰的无菌培养基小皿中转移至超净台。将BAs转移至含少许培养液(20 %的胎牛血清)的0.5 ml EP管中,用眼科镊将BAs剪碎至约0.5 mm长的组织块。最后将剪碎的组织块吸出,Z字形铺于小皿中(提前包被),静置于含 5% CO2细胞培养箱(37 ℃)培养。约2 h后组织块贴壁,加入4 ml培养基,4~5 d后待细胞长出后小心换液,之后可视细胞生长情况逐步换液。消化细胞方法如下:PBS清洗2~3遍;加入含0.25% Trypsin和0.02% EDTA的胰酶细胞消化液,待细胞变圆且未飘起时(显微镜下观察)吸去胰酶,加入含20 %胎牛血清的培养液终止消化,轻轻吹打细胞并移入新的培养皿中加4 ml 培养液(20 %胎牛血清)继续培养。之后按细胞的生长情况进行传代和鉴定。① 形态学鉴定:倒置显微镜下观察细胞的生长状态、大小及排列方式。② 免疫荧光鉴定:在24孔板中放入多聚赖氨酸处理的无菌盖玻片并接种VSMC悬液,2 d后进行免疫荧光鉴定。实验步骤如下:吸去原培养液,PBS洗3遍;4%的多聚甲醛固定15 min;PBS洗3遍;0.1%的Triton室温孵育10 min,3% BSA室温孵育1 h,吸去。加入单克隆抗α-actin抗体(1 ∶200),4 ℃孵育过夜;PBS液洗4遍(每次5 min),加入荧光二抗室温避光孵育1 h,PBS洗4遍,方法同上;DAPI核染10 min,PBS洗3遍,每次5 min;细胞爬片上滴加抗荧光淬灭封固液,置于荧光显微镜下避光观察并拍照。
1.2.2细胞划痕实验 将VSMC接种至6孔板,90%以上融合后,用黄色无菌枪头在培养板单层VSMC的相同位置画直线,造成“伤口”,PBS洗去脱落细胞,分为对照组、NaHS(100 μmol/L)组、NaHS+SU5416[5]组、VEGF(10 ng/ml)[4]组,孵育24 h,活细胞成像仪观察VSMC从划痕处向中央生长的距离,距离用于衡量细胞迁移能力,随机取5个视野(每孔)观察并拍摄,Image-J图像软件测量细胞迁移距离并计算平均值,进行3次独立实验。
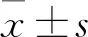
1.2.3VSMC收缩幅度的测定 将上述培养的VSMC接种至6孔培养板,分别加入PBS、SU5416(10-5mol/L)、VEGF(10 ng/ml)后置于37 ℃、5% CO2培养箱中预孵6 h,弃去培养基,并用PBS清洗2遍,加入900 μl培养基和100 μl NaHS(10-3mol/L),60 s后,用Image-Pro Plus 6.0图像分析软件测量并记录细胞长轴的长度,每孔随机选取10个细胞计算平均长度。细胞的舒缩用细胞给药前后的长度变化百分数来表示,正值为舒张,负值为收缩。
细胞变化百分数=(实验组细胞的平均长度-对照组细胞的平均长度)/对照组细胞的平均长度×100%。
1.2.4CCK-8增殖试剂盒检测VSMC增殖活力在96孔板中接种细胞悬液(100 μl/孔),每孔约2 000个细胞,将实验分为对照组、NaHS组、NaHS+SU5416组、VEGF(10 ng/ml)组,每孔细胞在给药24 h后加入10 μl CCK-8溶液,37 ℃细胞培养箱中孵育3 h,酶标仪检测吸光度(optical density, OD)值。
2 结果
2.1 大鼠BAs VSMC原代培养与鉴定组织贴壁法培养SD大鼠BAs VSMC,培养第5天,显微镜下可观察到有少量类长梭形或纺锤状细胞从组织块周围爬出,约15 d后细胞生长较多,以组织块为中心形成类似同心圆状的细胞晕,部分重叠,表现为典型的 “峰”、“谷”状生长。图1A所示培养5、10、14 d的细胞状态。应用细胞免疫化学染色(抗α-actin抗体)鉴定VSMC,结果如图1B显示,第一张为细胞核(蓝色),第二张细胞胞质内均能观察到阳性绿色荧光并呈长梭形,第三张为Merge图片。以上结果提示大鼠BAs VSMC原代培养成功。
2.2 免疫化学方法鉴定VSMCs中VEGFR2表达使用抗VEGFR2抗体,应用免疫化学方法鉴定SMCs中VEGFR2表达。结果如图2所示,可见VEGFR2在VSMC中显著表达,这为研究VEGFR2是否参与H2S介导的细胞迁移提供了基础。
2.3 H2S促进VSMCs迁移如图3,与对照组相比,100 μmol/L NaHS可显著提高VSMC的迁移能力(P<0.05);SU5416(10-5mol/L)处理组可明显降低NaHS对VSMC迁移能力的影响;与NaHS对VSMC迁移能力的作用相似, 10 ng/ml VEGF同样显著促进大鼠BAs VSMC的迁移。以上结果表明,H2S可显著提高VSMC的迁移能力,且与VEGFR2有关。
2.4 H2S对脑基底VSMC增殖的影响用CCK-8法检测H2S是否促进脑基底VSMC增殖,增殖能力用OD值表示(图4),VSMC用NaHS(10-4mol/L)刺激后,24 h后,NaHS组OD值均高于对照组(P<0.05),提示H2S可促进VSMC的增殖;SU5416预处理组OD值明显降低NaHS对细胞增殖的促进作用(P<0.05),该结果表明阻断VEGFR2抑制剂能够降低H2S促进VSMC增殖的作用,提示H2S氢介导的VSMC增殖可能与VEGFR2有关。
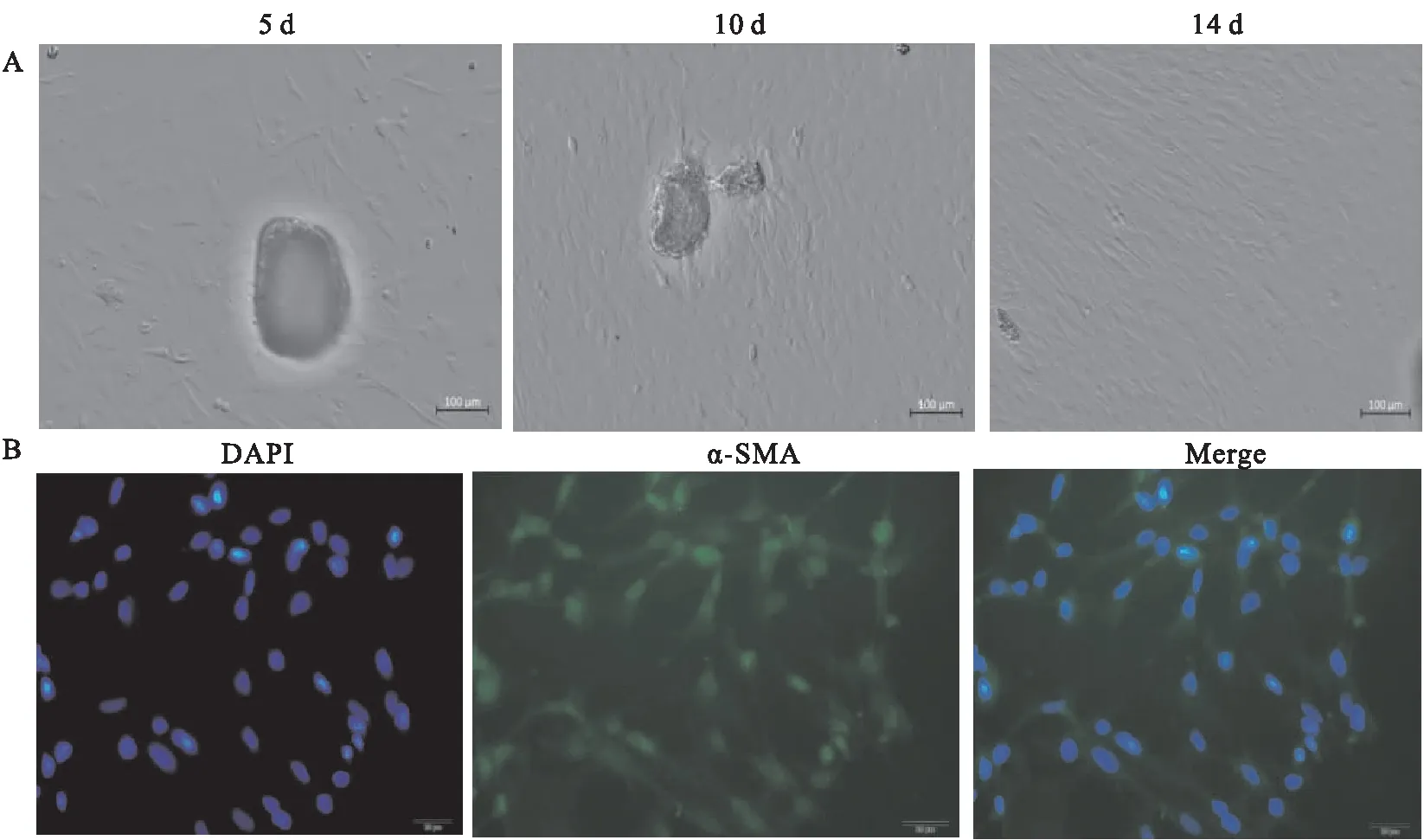
图1 原代大鼠脑基底VSMC的培养及鉴定 ×100

图2 大鼠脑基底VSMC VEGFR2 的鉴定 ×100

图3 NaHS 对VSMC迁移能力的影响
2.5 H2S对脑基底VSMC舒张的影响NaHS可显著提高VSMC的舒张作用(P<0.05),如图5,SU5416预处理组明显降低NaHS对细胞的舒张作用(P<0.05)。以上结果表明H2S对大鼠脑基底VSMC的舒张作用可能与激动VEGFR2有关。

图4 NaHS 对VSMC增殖能力的影响

图5 NaHS对VSMC舒张能力的影响
3 讨论
作为除NO和CO之外的第三种气体信号分子,H2S参与调节血管张力和血压[1,6],且在体内起着重要的生理作用:保护肺纤维化[6]、心肌缺血再灌注损伤[7]等等。在冠状动脉缺血模型中,H2S具有血管生成作用[8]。众所周知,血管生成在伤口愈合的早期至关重要[9],因此,研究H2S对血管的生成、张力的调节及细胞的增殖、迁移成为新热点。
本实验中使用原代培养的大鼠BAs VSMC,其细胞纯度高,活力好,实验所用细胞均为4~5代左右。本实验中采用的NaHS 作为H2S供体[2],主要考虑以下几个方面:① NaHS在溶液中解离成Na+和HS-, HS-和H+结合形成H2S。H2S气和NaHS在溶液中都是以的H2S(1/3)和HS-(2/3)形式存在,呈动态平衡。② 细胞培养液中Na+浓度高达150 mmol/L,而实验中给与NaHS后Na+浓度增加μmol/L级别,这在细胞实验中可以忽略不计。③ 本实验所用NaHS浓度较低,对溶液pH值没有影响,且目前国际上大都采用NaHS作为H2S的供体进行实验。
本研究显示VEGFR2在大鼠脑BAs VSMC中显著表达[10],该研究结果是开展H2S是否通过激动VSMC中VEGFR2促进细胞增殖、迁移的研究的重要理论基础。其次,运用细胞划痕实验检测细胞的迁移能力。虽然开始的细胞划痕比较直,但是24 h后划痕边缘便会变弯曲,因为不同位置的细胞有不一样的迁移能力,之后用Image-J软件测算出迁移前后的距离,计算两者之差即为细胞的迁移距离,这样的数据更能准确反映细胞的迁移能力。
细胞的迁移和增殖的发生发展过程受到多种因子的调控,其中较为重要的因子是VEGF。比如,VEGF可通过激活血管内皮细胞中酪氨酸激酶受体2,促进内皮细胞增殖和迁移[3]。本研究显示10 ng/ml VEGF可提高大鼠BAs VSMC的增殖和迁移,并促进VSMC的舒张,100 μmol/L NaHS(外源H2S供体)可同样促进血管VSMC的迁移、增殖和舒张功能,而10-5mol/L SU5416(VEGFR2抑制剂)可明显降低NaHS对血管VSMC的增殖和迁移能力的影响,并降低VSMC的舒张幅度,以上结果提示H2S促进VSMC的迁移、增殖和细胞舒张作用可能与激动VEGFR2有关。
目前关于H2S促进细胞增殖、迁移作用的一个重要限制是体外还原模型的研究[11]。虽然这些模型确实有实质性的有效性,但它们显然不能模拟体内复杂的细胞增殖、迁移及血管生成现象。这些复杂的现象在空间和时间上受到严格的调控,如细胞外基质的降解等等[12]。此外, H2S的信号传递被认为是通过过硫酸盐化发生的,即半胱氨酸残基翻译后修饰为过硫酸盐。H2S可通过通道蛋白硫化激活KATP通道[13]或增加大脑小动脉VSMC Ca2+火花频率激活BK通道,导致膜超极化和血管舒张[14]。综上所述,进一步思考H2S对VSMC产生的增殖、迁移及舒张作用是通过作用于VEGFR2中S-S键,引起下游通路的变化;或是导致VEGFR2发生硫化。这需要做更多的工作来描述H2S在这些过程中的确切作用。
