盐度对羊栖菜(Sargassum fusiforme)幼体光合特性的影响
2020-10-13宋新丹陈斌斌马增岭徐丽丽林立东吴明江
宋新丹,陈斌斌,马增岭,徐丽丽,林立东,吴明江,*
(1.温州大学 生命与环境科学学院,浙江 温州325035; 2.温州大学 羊栖菜研究所/浙江省水环境与海洋生物资源保护重点实验室,浙江 温州 325035; 3.温州市洞头区水产科学技术研究所博士后工作站,浙江 温州 325700)
羊栖菜(Sargassumfusiforme)是我国重要的经济海藻,主要分布在浙江、福建沿海一带[1]。羊栖菜含有丰富的微量元素与膳食纤维,可以有效预防高血压、高血脂、心脑疾病、癌症的发生,同时还具有抗衰老、减肥、促肠胃的功效,经济价值较高[2-3]。近年来,随着经济的快速发展,市场对羊栖菜的需求量日益提升,羊栖菜的海水养殖和产量提高成为生产热点[4-6]。
盐度是羊栖菜生长的重要条件。羊栖菜等大型海藻生活在潮间带等盐度变化较大的区域[7]。频繁的降雨和高温变化会导致海水盐度发生变化,海水盐度的改变会对羊栖菜的光合作用与生长产生影响[8],长期处于盐胁迫环境会使羊栖菜生产力衰退[9]。在自然生长条件下,羊栖菜受到周期性潮水涨落与天气变化因素影响,受到高盐或低盐胁迫,但在涨潮复水后可以迅速恢复,说明羊栖菜在长期进化过程中形成了独特的耐盐机制[10-11]。研究表明,环境中盐度发生变化时,藻体细胞可能因盐度变化过大导致渗透压失调,影响藻体细胞对光能的捕获与利用效率[12-13]。此外,盐度胁迫还导致藻体细胞过多地产生活性氧(reactive oxygen species,ROS),引起细胞膜结构的损坏,藻体会因此出现软化、白化或腐烂等现象,进而抑制藻类生长[14-15]。在低盐度条件下,盐生杜氏藻细胞显著膨胀,细胞内产生大量的活性氧,抑制PSⅡ的有效光化学速率和藻体的光合速率[16]。PSⅡ在植物盐胁迫响应中发挥重要作用,对盐度变化敏感[17],同时,盐胁迫对不同海藻PSⅡ的影响不同[18-19]。
目前盐胁迫对海藻生长、光合作用的影响研究主要集中在龙须菜(Gracilarialemaneiformis)与坛紫菜(Porphyrahaitanensis),以及重要生态常见类型海藻石莼(Ulvalactuca)等[20-22],而针对经济海藻羊栖菜特别是羊栖菜幼体对盐度变化的生理响应特性的研究较少。随着市场需求的增加,羊栖菜等大型海藻养殖逐渐引起人们的关注[23],不同藻类盐度适应范围与响应特性不同[24]。本实验以羊栖菜幼体为材料,通过模拟自然环境盐度变化,采用快速无损且灵敏的叶绿素荧光参数指标探讨海洋植物羊栖菜对不同盐度的光合响应机制,有助于从光合层面理解洋栖菜的生理特征,为实际生产提供参考。
1 材料与方法
1.1 材料
实验所用的羊栖菜藻体于2019年9月采自浙江省温州市洞头区附近海域。选择10~25 cm的羊栖菜幼体,挑选健康的藻体并经过简单清洗后,放在低温保温箱中带回实验室,去除附生杂藻,用灭菌的过滤海水进行反复清洗,在智能光照培养箱(MGC-250P)中预培养,培养光照度1 200 lx,培养温度为20 ℃,光暗周期为12 h∶12 h。经过3 d暂养适应后进行相应培养,培养基质采用过滤灭菌的天然海水,利用超纯水和NaCl调节培养液至不同盐度(15‰、20‰、29‰、45‰)。所有实验处理设置3个平行,分别在1、4、8、12、24、72、240 h测定叶绿素荧光参数。培养液每2 d更换1次。
1.2 叶绿素荧光参数的测定
将培养室羊栖菜幼体暗适应15 min,使用Phyto-PAM浮游植物分析仪(Heinz Walz GmbH,Effeltrich,德国)进行叶绿素荧光测定,以低强度光(600 Hz,665 nm,0.3 μmol·m-2s-1)照射羊栖菜幼体测定初始荧光(Fo)。随后暗适应40 min,饱和脉冲(5 600 μmol·m-2·s-1)照射羊栖菜幼体确定最大荧光(Fm),并计算最大光化学效率(Fv/Fm),计算公式Fv/Fm=(Fm-Fo)/Fm。将光合有效辐射(PAR)设为0、25、45、65、90、125、190、285、420、625、820 μmol·m-2·s-1,每个梯度持续30 s。相对电子传递速率(rETR)随PAR的变化关系使用Origin 9.0软件,参照文献[25]的方法进行拟合,并计算最大相对电子传递速率(rETRmax)。
1.3 最大净光合作用速率与暗呼吸速率
用不同盐度海水处理羊栖菜幼体,分别在1、4、8、12、24、72、240 h,采用液相氧电极(Hansatech Oxygraph+,英国)测定羊栖菜幼体的最大净光合速率(Pnmax)与暗呼吸速率(Rd)。测定温度控制为20 ℃,光照度使用光量子计(GLZ-A,浙江托普)测定。氧电极在测定之前采用2点法进行校准,在光照度4 900 lx条件下测定其Pnmax,每隔30 s记录1次,共记录7次,重复3组。然后关闭光源,用黑布遮盖反应槽,暗适应15 min,测得黑暗条件下藻类的Rd。Pnmax与Rd以每g鲜重每h增加或消耗的微摩尔氧气数(μmol·g-1·h-1)表示通过改变光源与叶室的距离来调节光照度,从而得到光合速率-光强响应曲线(P-I curves)。P-I曲线拟合参照Henley[26]的方法。
1.4 光合色素含量测定
藻体的叶绿素a(Chl a)、叶绿素c(Chl c)、类胡萝卜素(Car)含量测定分别参考张建伟等[27]和Hellebust等[28]的方法。称取0.2 g羊栖菜气囊研磨,80%丙酮溶液定容至10 mL并避光提取色素24 h,3 500×g离心15 min,取上清,分别测定480、510、630、639、647、664 nm处吸光值,按照相应的公式换算各色素含量。
1.5 光合作用-无机碳响应曲线测定
藻体光合固碳速率采用氧电极法测定,用光合放氧速率(μmol·h-1·g-1)表示。将羊栖菜气囊剪碎置于原条件恢复培养1 h,称取0.2 g置于盛有20 mL无碳海水反应杯中,紧密插入氧电极,避免气泡产生。反应杯温度18 ℃,光照度6 100 lx,反应20 min,以消耗藻体自身与海水中溶解性无机碳(dissolved inorganic carbon, DIC)。当反应杯内放氧速率为零时,加入一定浓度NaHCO3使终浓度分别为0、0.25、0.50、1.10、2.20 mmol·L-1,待放氧速率稳定,进行光合放氧速率测定,得到光合作用-无机碳响应曲线(P-C曲线)。利用Origin 9.0进行米氏方程[29]非线性曲线拟合:v=vmax×S/(K0.5+S)。其中,v为光合固碳速率,vmax为最大光合固碳速率,S为反应介质中总无机碳浓度,K0.5为达到最大光合固碳速率一半时的无机碳浓度,1/K0.5表示藻体对外源无机碳的亲和力。
1.6 数据分析
运用Excel 2010和SigmaStat 3.5软件进行数据整理和双因素方差分析(two-way ANOVA),差异显著性水平为P<0.05。采用Origin 9.0(Origin,美国)作图。数据均用平均值±标准差(n≥3)表示。
2 结果与分析
2.1 盐度对羊栖菜幼体叶绿素荧光的影响
各盐度条件下羊栖菜幼体的Fo与Fm变化趋势基本保持一致,随时间变化呈现先降低后升高趋势(图1)。各盐度羊栖菜幼体的Fo、Fm在1~8 h处于较高水平,且高于12~72 h。盐度20‰、29‰处理的Fo、Fm在1~8、12~72 h两个时间段较为稳定,各处理间差异不显著(P>0.05)。处理1~8 h,45‰处理的Fo、Fm随处理时间延长逐渐升高。处理240 h,盐度15‰、20‰、45‰处理的Fo、Fm均低于盐度29‰处理。
处理1~72 h,各盐度羊栖菜幼体的Fv/Fm均未随时间延长出现显著变化。处理240 h,羊栖菜幼体受到盐胁迫,Fv/Fm均降低,盐度15‰、20‰、45‰与盐度29‰处理相比分别降低了11.37%、6.87%、9.36%,此时,盐度15‰、20‰、29‰、45‰处理的Fv/Fm与处理1 h相比分别降低14.27%、14.81%、11.21%、22.18%,盐度29‰降幅最小,盐度45‰降幅最大;除盐度45‰处理外,其他盐度处理的Fv/Fm与处理1 h相比无显著差异(P>0.05)。

**表示组间存在极显著差异(P<0.01), *表示组间存在显著差异(P<0.05)。** indicated significant difference between groups (P<0.01), * indicated significant difference between groups (P <0.05).图1 不同盐度处理对羊栖菜光能转换效率的影响Fig.1 Effects of different salinity treatments on the light energy conversion efficiency of Sargassum fusiforme
2.2 盐度对羊栖菜幼体最大相对电子传递速率的影响
由表1可知,处理1~72 h,盐度15‰、20‰和45‰处理的羊栖菜幼体的rETRmax呈现下降—升高—下降趋势,盐度29‰处理的羊栖菜的rETRmax呈现升高—下降—升高—下降趋势;处理240 h,除盐度20‰处理的rETRmax有回升趋势,其他盐度处理的rETRmax均呈现下降趋势。

表1 海水盐度对羊栖菜最大电子传递速率的影响Table 1 Effects of seawater salinity on rETRmax of Sargassum fusiforme μmol·m-2·s-1
从表2可以看出,处理1~72 h,盐度15‰处理的光能利用效率(α)呈现升高—降低—升高—下降趋势,盐度20‰处理的α呈现降低—升高—下降—升高—下降趋势,盐度29‰处理的α呈现升高—降低—升高趋势,盐度45‰处理的α呈现升高—下降—再升高—再下降。处理时间超过72 h后,各盐度羊栖菜幼体受逆境环境影响,α均为下降趋势。

表2 海水盐度对羊栖菜光能利用效率(α)的影响Table 2 Effects of seawater salinity on light energy conversion efficiency (α) of Sargassum fusiforme
处理24 h,盐度15‰、20‰处理的rETRmax比盐度29‰处理分别显著(P<0.05)提高28.67%、58.59%,α同时显著(P<0.05)提高;盐度45‰与盐度29‰处理的rETRmax差异未达显著水平(P>0.05),α显著(P<0.05)降低。处理240 h,与盐度29‰处理相比,盐度15‰、45‰处理的rETRmax分别降低26.12%、34.38%,α分别降低18.18%、9.09%,差异达显著水平(P<0.05)。盐度20‰处理与盐度29‰处理的rETRmax无显著差异(P>0.05),但盐度20‰处理的α显著(P<0.05)低于盐度29‰处理,降低了18.18%(图2)。
2.3 盐度对羊栖菜幼体色素含量的影响
处理1~72 h,羊栖菜幼体的色素(Chl a、Chl c、Car)含量变化趋势相同,总体呈现降低-升高-降低趋势。处理240 h,盐度20‰、29‰、45‰处理的羊栖菜幼体色素含量呈回升趋势,盐度15‰处理的色素含量继续下降(表3—5)。经过240 h的处理,盐度15‰处理的色素(Chl a、Chl c、Car)含量均显著(P<0.05)低于盐度29‰处理,分别降低64.14%、46.21%、46.21%;盐度20‰处理仅Chl a含量显著(P<0.05)低于盐度29‰处理,Chl c、Car含量与盐度29‰处理无显著差异(P>0.05);盐度45‰处理的色素(Chl a、Chl c、Car)含量与盐度29‰无显著差异(P>0.05)。

表3 海水盐度对羊栖菜叶绿素a含量的影响Table 3 Effects of seawater salinity on chlorophyll a content of Sargassum fusiformemg·g-1
2.4 盐度对羊栖菜幼体最大净光合速率与暗呼吸速率的影响
由表6和7可知,处理1~12 h,盐度15‰、20‰处理的Pnmax呈现先降低后升高趋势,盐度29‰、45‰处理的Pnmax呈现持续升高趋势,各盐度处理的暗呼吸速率(Rd)变化较大,变化趋势不一致。处理24 h,盐度15‰、20‰、45‰的Pnmax均显著(P<0.05)高于盐度29‰处理,此时,各盐度处理的Rd无显著差异(P>0.05)。处理240 h,与盐度29‰相比,盐度15‰、45‰的Pnmax分别降低39.39%、35.60%,Rd分别提高125%、129%,差异均达显著水平(P>0.05);盐度20‰处理的Pnmax、Rd与盐度29‰均无显著差异(P>0.05)。
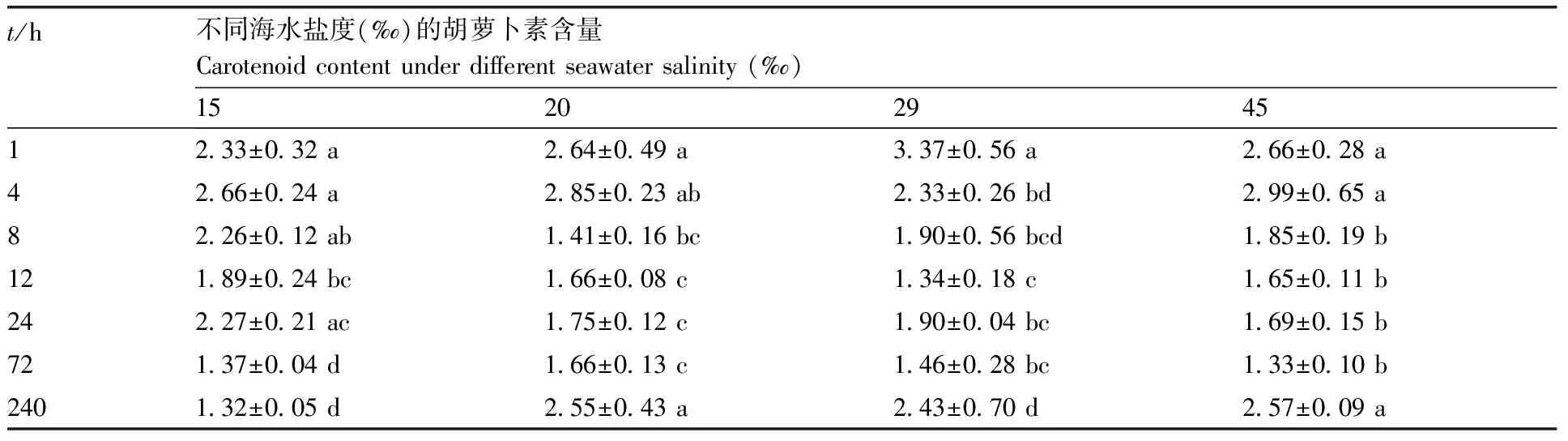
表4 海水盐度对羊栖菜类胡萝卜素含量的影响Table 4 Effects of seawater salinity on carotenoid content of Sargassum fusiformemg·g-1

表5 海水盐度对羊栖菜叶绿素c含量的影响Table 5 Effects of seawater salinity on chlorophyll c content of Sargassum fusiformemg·g-1

表6 海水盐度对羊栖菜最大净光合速率的影响Table 6 Effects of seawater salinity on maximum net photosynthesis rate of Sargassum fusiformeμmol·g-1·h-1

柱上无相同小写字母表示相同处理时间不同处理间差异显著(P<0.05)。Data on the bars at the same treatment time marked without the same lowercase letter indicated significant difference at P<0.05.图2 处理时间对不同海水盐度羊栖菜rETRmax和α的影响Fig.2 Effect of treatment time on rETRmax and α of Sargassum fusiforme under different seawater salinity treatments
2.5 羊栖菜幼体对无机碳的利用
海水盐度15‰~29‰条件下,羊栖菜幼体的光合固碳速率随无机碳浓度的升高而逐渐增大(图3)。处理240 h,盐度15‰、20‰、45‰处理的最大光合固碳速率vmax均显著(P<0.05)低于盐度29‰,降低幅度分别为29.90%、28.87%、59.79%。各盐度处理的K0.5均无显著差异(P>0.05),盐度45‰处理的K0.5显著(P<0.05)低于盐度15‰处理(表8)。

表7 海水盐度对羊栖菜暗呼吸速率的影响Table 7 Effects of seawater salinity on dark respiration rate of Sargassum fusiformeμmol·g-1·h-1

图3 不同盐度胁迫下羊栖菜光合固碳速率对无机碳浓度的响应Fig.3 Responses of photosynthetic carbon fixation rate of Sargassum fusiforme to inorganic carbon concentration under different salinity treatments

表8 不同盐度条件下羊栖菜的最大光合固碳速率(vmax)和半饱和浓度(K0.5)Table 8 The maximum photosynthetic carbon fixation rate (vmax) and semi-saturated constant (K0.5) of Sargassum fusiforme under different salinity treatments
3 结论与讨论
大型海藻的光合作用过程在不同环境条件下的变化均可通过叶绿素荧光特性反映出来。色素是类囊体膜的重要组成部分,色素含量变化可有效反映出藻类光合作用能力变化[30],Fo、Fm分别反映了PSⅡ开放时的荧光产量和电子传递情况,Fv/Fm则反映了PSⅡ反应中心的最大光量子产量,这些指标通常作为判断是否发生光抑制作用的标准[31-32]。本研究中,短时间(1~12 h)低盐度处理,羊栖菜幼体的色素含量(Chl a、Chl c、Car)、Fo和Fm均明显降低,这可能是低盐胁迫对羊栖菜幼体的叶绿体膜结构造成一定损伤,导致色素含量随着叶绿体膜结构解体而降低,从而抑制Fo和Fm,导致光能转化效率降低[33]。研究表明,环境胁迫时,藻体光合色素降低可在一定程度上避免过多光能对藻体产生损害[34],环境胁迫会损伤PSⅡ的反应中心,降低电子传递速率,本实验结果与此基本相符[35]。随着培养时间的延长,羊栖菜幼体的色素含量(Chl a、Chl c、Car)、Pnmax、Rd、rETRmax均略有回升趋势,但各项指标均低于盐度29‰条件下生长的藻体,表明低盐度条件主要抑制了羊栖菜幼体的光合作用,增加了藻体的能量消耗,从而对光合机构形成一定的保护,该实验现象与洪立洲等[36]对马齿苋的研究结果相同。盐度20‰处理对羊栖菜幼体光合作用的抑制作用不显著,且抑制程度低于盐度15‰,则说明羊栖菜幼体对盐度具有一定的适应调节能力[37]。Fv/Fm常被用来判断和推测藻类对胁迫环境的抗性[38]。经过长时间培养(240 h),低盐度(15‰、20‰)胁迫后Fv/Fm不同程度下降,表明羊栖菜幼体的PSⅡ反应中心受到不同程度的损害。适当的盐度(20‰)处理能够提高羊栖菜幼体的rETRmax,但过低的盐度(15‰)则会降低羊栖菜幼体的Fv/Fm和光能利用效率(α),这与其他大型海藻的研究结果一致[39-40]。盐度越低,羊栖菜幼体的色素含量受影响程度越大,表现了盐度的正刺激效应,这说明在一定范围内,羊栖菜幼体光合能力可能随盐度提高而增强,是一种抗盐的生理表现[41]。羊栖菜幼体的vmax随盐度降低而降低[42],表明盐度降低对羊栖菜幼体光合作用的胁迫增大,这主要是由于过低的盐度阻碍了藻体光合电子的传递,对PSⅡ产生了抑制[43]。
本研究中,受到高盐度(45‰)影响,短时间(1~12 h)羊栖菜幼体的最大相对电子传递速率(rETRmax)、光能利用效率(α)均降至最低点,随后羊栖菜短暂回升后持续降低;其中,1~8 h时,盐度45‰处理的羊栖菜幼体Fo持续上升,随后持续维持在较低水平,表明盐度45‰处理的羊栖菜幼体PSⅡ反应中心可能受到损伤[44],叶绿体膜遭到了一定程度破坏[45],影响了PSⅡ的蛋白合成,推测羊栖菜幼体发生了如Synechococcussp.在0.5 mol·L-1氯化钠处理中相似的过程,即钠离子进入细胞内,引起外周蛋白的降解[46]。长期胁迫条件下盐度45‰处理的rETRmax、光能利用效率(α)均显著低于盐度29‰处理,说明高盐胁迫下羊栖菜幼体利用光能能力降低,与色素含量(Chl a、Chl c、Car)持续降低的结果相一致,其Rd显著增加,表明过多的能量被用于热耗散以抵御高盐胁迫[47-48]。长期高盐度(45‰)胁迫下,羊栖菜幼体的vmax显著低于盐度29‰处理,可能是因为盐胁迫能通过限制CO2的吸收[49]或者降低卡尔文循环关键酶Rubisco的活性[50]来降低光合作用速率,使羊栖菜幼体的光合固碳能力下降[51]。
短时间的高盐或低盐胁迫对羊栖菜幼苗没有太大影响,可能是由于长期生活在潮间带,受到潮汐和淡水河流的影响,经常遭受到高盐和低盐的胁迫,经过长期的适应,羊栖菜可以抵御短时间的高盐和低盐胁迫[52]。短时间(1~12 h)内,羊栖菜幼体的色素含量(Chl a、Chl c、Car)、Fo、Fm、Fv/Fm呈现相同变化趋势。但低盐(15‰、20‰)处理的羊栖菜幼体的rETRmax、光能利用效率(α)均逐渐降低,高盐(45‰)处理则无降低趋势,再次表明盐度降低阻碍了海藻光合电子的传递,对PSⅡ产生了抑制,影响了羊栖菜幼体的光合作用。经过长时间培养(240 h),盐度45‰的vmax、K0.5、rETRmax均显著低于盐度15‰处理,藻体细胞达到最大光合固碳速率所需外源无机碳浓度变小[53],说明长时间盐分胁迫下,高盐(45‰)处理对羊栖菜幼体的损伤可能大于低盐(15‰)处理[54]。
随着气候变暖和近海环境的变化,海水盐度也会随之发生变化,对沿海的羊栖菜产量造成影响。在盐分胁迫的逆境条件下,羊栖菜的光合作用会受到明显影响。盐度低于29‰,羊栖菜光合作用受到影响,盐度为20‰时,羊栖菜幼体的光合作用受到的影响较小,羊栖菜幼体对海水低盐度条件有一定的耐受性。海水盐度过低(15‰),羊栖菜光合作用受到明显抑制。高盐45‰条件下,羊栖菜幼体受到高盐胁迫损伤,羊栖菜幼体光合作用和无机碳利用受到显著抑制。此外,羊栖菜对盐度变化的耐受性会随时间变化,在较短时间盐度变化下,羊栖菜光合作用受到的影响较小;长时间盐度变化条件下,盐度过低会抑制羊栖菜幼体的光合作用,而盐度过高则通过阻碍羊栖菜幼体光合色素合成等胁迫其光合作用:因此,实际生产中,当产生过高或过低盐度变化时,应当及时做好羊栖菜的防低盐或高盐胁迫处理,防止长时间的盐度变化影响羊栖菜特别是其幼体的生长。
