基于FoxO信号通路探讨HP相关性胃炎脾胃湿热证胃黏膜细胞凋亡的机制
2020-10-09周义方喻斌徐寅曾蓉陈末
周义方,喻斌,徐寅,曾蓉,陈末
(1.湖南中医药大学,湖南 长沙 410208;2.湖南中医药大学第一附属医院,湖南 长沙 410208)
自幽门螺旋杆菌(Helicobacter pylori,HP)被发现以来,其生理结构、致病特点以及相关病理机制一直是研究的热点,目前已被众多学者研究证实其是一种慢性且具有传染性的致病菌,据统计全球范围内有50%以上人类感染了HP,导致胃黏膜慢性炎症的发生[1-2]。HP相关性胃炎(HAG)就是HP感染后引起胃及十二指肠发生炎性变化。一些胃肠疾病的发生(如胃炎、胃溃疡、十二指肠溃疡等)与HP有着密切的关系,其也被证明可以大大增加胃癌的发生率[3-4]。基于以上的危害因素,根除HP对于治疗胃肠疾病显得非常重要。通常西医以四联疗法根除HP为主,由于西医四联根除HP疗法导致的高耐药性、肠道菌群紊乱、高复发率等问题,以及中医药在HAG的防治方面有着显著的疗效,所以我们从中医药防治HAG角度出发开展研究。目前研究得出的结果有:在对HAG患者的中医证型进行统计及分析的基础上,发现脾胃湿热证型者最多;脾胃湿热证与HP感染这两者之间有着密切的关联性;对HAG脾胃湿热证予以具有清热祛湿方药进行干预治疗可取得显著疗效[5-10]。前期研究明确了HAG的发病机制,从而为中医药防治HAG提供更多理论依据。
研究[11-12]发现HP可以通过多种不同的机制来诱导胃黏膜细胞发生凋亡;同时研究[13-15]发现脾胃湿热证模型胃黏膜细胞的促凋亡蛋白呈过度表达。然而在HAG患者中又以脾胃湿热证型为多,所以认为HAG脾胃湿热证与胃黏膜细胞凋亡有着密切的联系。Fox转录因子的O亚家族(subfamily O of forkhead transcription factors, FoxO)在细胞周期的调控和程序化细胞死亡中起重要作用,但它在HAG脾胃湿热证中的意义尚不清楚[16]。因此,基于HAG脾胃湿热证的病机和FoxO的生物学功能,我们认为胃黏膜上皮细胞凋亡是HAG脾胃湿热证的重要病理机制,其机制与FoxO信号通路的调控作用相关。
在本课题组前期研究基础上[6-10],本实验采取复合病因的造模方法来建立HAG脾胃湿热证小鼠模型,以FoxO信号通路参与细胞凋亡调控为基础,以HAG脾胃湿热证小鼠模型为研究对象,检测并分析FoxO信号通路相关物质(PTEN、FoxO3a、PI3K、Akt)的表达情况,以此来分析和阐明HAG脾胃湿热证小鼠模型胃黏膜发生的细胞损伤与FoxO信号通路调控细胞凋亡的关系。
1 材料、试剂与仪器设备
1.1 实验材料
实验动物:60只SPF级BALB/c小鼠(雌雄各半,约8周龄,体质量20~30 g)。实验饲料:普通饲料和高脂饲料;高脂饲料(自制):普通饲料按等比例加入蜂蜜和猪油。HP菌株:含有细胞毒素相关基因(cag A)和空泡细胞毒素(vac A)且浓度为1×109cFU/mL的悉尼菌株。
1.2 主要实验仪器
显微镜,Motic;台式高速冷冻离心机,湘仪;全自动酶标洗板机,汇松;多功能酶标分析仪,汇松;恒温培养箱,光明;Tunel试剂盒(KGA704),凯基生物;内源性亲和素—生物素封闭试剂盒,北京雷根生物;电泳仪,美国Bio-rad;电泳槽,中国北京六一;转膜仪,中国北京六一;旋涡混合器,中国江苏其林贝尔;荧光定量RCP仪,Thermo;荧光PCR板,Thermo;恒温水浴箱,河南金博;人工湿热箱,自制。
1.3 主要实验试剂
中性树胶,Sigma;苏木素,Wellbio;PBS(7.2-7.6),Wellbio;枸橼酸盐缓冲液,Wellbio;二步法试剂盒,中杉金桥;DAB试剂盒,中杉金桥;伊红,Wellbio;HRP goat anti-mouse IgG,美国Proteintech;RIPA裂解液,中国长沙维世尔生物;蛋白酶抑制剂,德国Merck;蛋白磷酸酶抑制剂,瑞士Roche;HRP goat anti-rabbit IgG,美国Proteintech;SuperECL Plus 超敏发光液,美国Thermo pierce;显影液 定影液,中国WellBiology;快速尿素酶检测试剂盒,上海国药生物;PTEN(抗体货号 60300-1-Ig),美国proteintech;PI3K(抗体货号 60225-1-Ig),美国proteintech;P-AKT(抗体货号4060s),美国CST;FOXO3a(抗体货号10849-1-AP),美国proteintech。
2 实验方法
2.1 动物分组
将60只SPF级BALB/c小鼠随机分成5组,每组各12只。室温条件(20~25 ℃)下适应性饲养3 d。正常对照组:正常饮食+自然环境+同步饲养。内湿HP组:自然环境+HP菌液(致病因子)+肥甘饮食(内湿)。外湿HP组:正常饮食+HP菌液(致病因子)+湿热环境(外湿)。单纯HP组:正常饮食+自然环境+HP菌液(致病因子)。复合病因造模组:肥甘食物(内湿)+湿热环境(外湿)+HP菌液(致病因子)。
2.2 造模方法
复合病因组造模方法:开始造模的第1天即开始予以高脂饲料(即普通饲料按等比例加入蜂蜜和猪油),饲养至第13天后开始进行外部湿热条件的干预,将其放入自制的湿热箱中温度(32±2)℃,湿度95%每天6 h,至第18天的时候开始进行HP的接种,隔日感染1次,总共感染3次,接种后定植2周,种植HP及定植期间其余条件均不变。第37天取出小鼠检测指标。接种HP方法如下:所有BALB/c小鼠在给予HP菌液灌胃前,先禁食不禁水24 h,模型组小鼠灌注1×109cFU/mL浓度的CagA+VacA+菌株HP 菌液0.3 mL/只,灌胃后4 h给予食物和水。模型复制过程中,观察各模型小鼠的症状、饮水量、饮食量、体质量、肛温[17-19]。
2.3 模型成功标准
①一般状况观察:小鼠精神不振,嗜睡懒惰,反应迟钝,饮食量和饮水量减少,体质量减轻,肛温升高,小便黄,大便稀溏[19-21]。②胃黏膜组织快速尿素酶试验阳性。③HE染色法观察胃黏膜组织呈炎性改变。
2.4 标本采集
脱颈处死后即迅速取胃组织,首先将小鼠以仰卧的体位固定在鼠板上,然后快速用相关实验器械将全胃组织取出。摘下全胃,贮存于-80 ℃冰箱中。
2.5 各模型组建立的HAG脾胃湿热证小鼠模型相关指标检测
2.5.1 胃黏膜组织病理形态及炎症程度
第一步将制好的切片放置在60 ℃的条件下烘烤12 h;第二步切片脱蜡至水;第三步苏木素染1 min,蒸馏水冲洗,PBS返蓝后,再用伊红染1 min,蒸馏水冲洗;最后脱水后取出置于二甲苯中2次,每次放置10 min,然后用中性树胶封片后在显微镜下观察。
2.5.2 胃黏膜细胞凋亡情况:TUNEL法检测胃黏膜细胞凋亡率
60 ℃条件下烘片60 min,脱蜡至水;浸入3%H2O2溶液中,室温条件下(15~25 ℃)12 min后用PBS漂洗3次;热修复抗原处理;每个样本加50 μL内源性亲和素封闭A液,孵育20 min,然后弃液用PBS漂洗3次,依上方法再加入内源性亲和素封闭B液;各样本加入50 μL预先配置好的TdT酶反应液,放置在37 ℃避光的条件下60 min,反应后PBS漂洗3次,漂洗过程中需要避光处理,漂洗完后各样本上加入50 μL标记工作液,放置在37 ℃避光的条件下30 min,反应后漂洗3次漂洗过程中注意避光;最后DAB显色,各样本上加入50 μLDAB工作液,反应30 s~5 min;显色后的样本片用PBS漂洗3次,然后苏木素复染,复染完成后冲洗干净并进行分化,分化后立即冲洗干净并脱水后用显微镜观察。
2.5.3 Western-blot检测PTEN、PI3K、p-Akt、Akt、FoxO3a
Western-blot检测法:制备样品,将经预处理后的0.025 g组织,放置至200 μL RIPA裂解液中并进行反复研磨处理,冰上,蛋白裂解10 min,然后离心15 min,经上处理后即检测蛋白浓度。电泳,向10%分离胶中添加 TEMED后摇匀并灌胶,然后使其充分凝固;依照以上方法再处理4.8%的浓缩胶;得出蛋白定量的结果后即开始电泳。转膜,分别切胶Foxo3a(72-97KD),P-AKT(60KD),PI3K(85KD),PTEN(55KD),β-actin(42KD);准备好符合条件的滤纸和NC膜;滤纸,膜,胶按要求顺序放好后,盖上仪器,接通电源,转膜300 mA,PTEN、P-AKT约75 min,PI3K、Foxo3a约100 min, β-actin 约1 h;上述步骤完成后,先用1×TBST中清洗1次,然后用丽春红染膜后,再用1×TBST将丽春红洗净。将膜放入用1×TBST制好的5%脱脂奶粉中,放置在室温下1.5 h。孵育一抗,1×TBST稀释一抗至一定比例,然后孵育膜与一抗,在4 ℃放置一夜。孵育结束,1×TBST洗3次,每次15 min。孵育二抗,用1×TBST稀释二抗(Proteintech),鼠抗(M)稀释比例1∶5 000,兔抗(R)比例1∶6 000,孵育二抗与膜90 min;孵育结束,1×TBST洗3次,每次15 min。抗体孵育完成后最后借助相关仪液和设备进行显色和曝光。
2.5.4 RT-PCR法检测PTEN、PI3K、p-Akt、Akt、FoxO3a
RT-PCR检测法:RNA的提取,依据相关试剂操作步骤及实验仪器提取组织的RNA。RNA反转录,以mRNA为模板,逆转录cDNA;轻轻晃动充分摇混均匀,然后用离心机离心并取最下层的溶液;42 ℃孵育30~50 min,85 ℃孵育5 min。孵育过程完成后即短时间离心机离心,离心后用冰进行冷却;其处理形成的产物可直接进行PCR反应,或保存在-20 ℃条件下。进行PCR反应,选用SYBR法,反应结束后,短暂离心,置于冰上冷却,β-actin作为内参,在NCB上搜索目的基因的序列,qRT-PCR各样本各指标3个孔,总共30 μL体系,每孔10 μL,定量PCR扩增程序:依次95 ℃ 10 min, 95 ℃ 5 s,60 ℃ 50 s,共40个循环。以相对定量比较actin基因与目标基因的Ct值,得出所测目标基因相对表达量。相对mRNA表达=2-△Ct×100%,△Ct值=靶基因Ct值-actin Ct值。通过PCR仪配套软件计算结果。
2.6 统计学处理
所有数据均输入计算机,用SPSS 22.0 Windows软件进行处理。各检测指标统计数据以均数±标准差表示,检测符合正态分布后选用方差分析法进行比较,方差齐时选择LSD法,方差不齐时则选择Tamhane法,设置P<0.05为有统计学意义。
3 实验结果
3.1 各实验组胃黏膜组织病理形态及炎症程度情况
各模型表现为不同程度的倦怠、纳呆、便溏、饮食水量减少,肛温不同程度升高等表现,然后每组随机取2只小鼠(1雌1雄)综合评价是否造模成功。取胃黏膜组织进行快速尿素酶实验(试剂由黄变红为阳性),正常对照组结果为阴性,各模型组均为阳性。HE染色法显微镜下观察到模型组胃黏膜组织存在炎性改变。结合模型组症状表现,胃黏膜组织快速尿素酶试验阳性以及HE染色观察结果,与脾胃湿热证模型相符,说明造模成功。
显微镜下,正常对照组胃黏膜上皮细胞排列整齐,呈单柱状,固有层内有密集排列的腺体,极少部位可见少量淋巴细胞。模型组胃黏膜炎症程度重,其中以复合病因组最为明显,其次分别为内湿HP组、外湿HP组、单纯HP组。胃黏膜炎症程度越重,胃黏膜上皮细胞排列越紊乱,固有层内淋巴细胞,嗜酸性粒细胞和中性粒细胞等炎性细胞浸润越多,甚至炎症细胞可侵及黏膜下层。见图1。
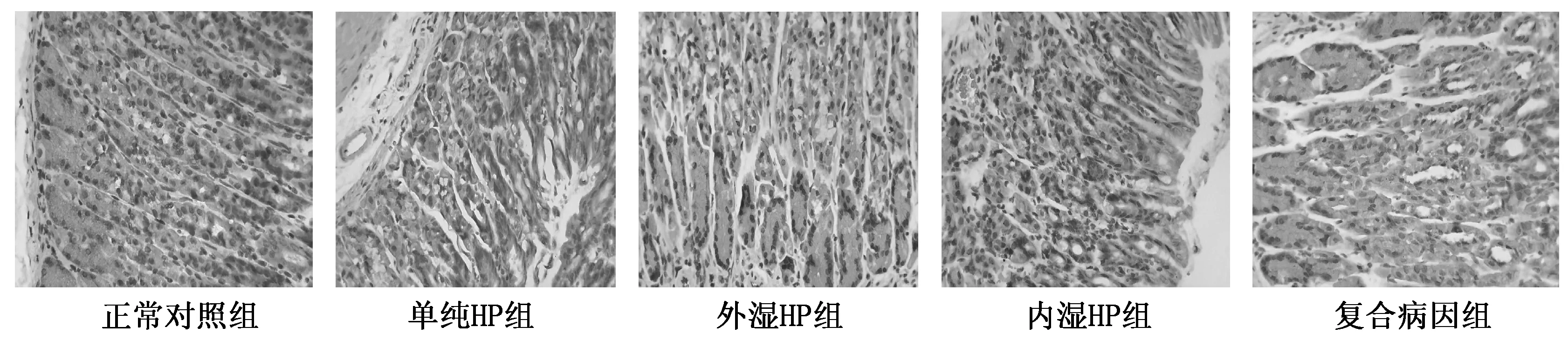
图1 各实验组胃黏膜组织病理形态及炎症 HE染色(×400)
3.2 胃黏膜细胞凋亡情况及FoxO信号通路相关物质蛋白表达与基因含量情况
3.2.1 各实验组胃黏膜细胞凋亡情况
显微镜下阳性染色为核染成棕(黄)色或褐色染色,正常组图片示阳性率较低,提示细胞凋亡率较低;模型组图片示阳性率较高,其中以复合病因组阳性率最高,其次分别为内湿HP组、外湿HP组,且均高于单纯HP组。由此可得出HAG脾胃湿热模型细胞凋亡增多,且以复合病因组细胞凋亡率最高。结果见图2。
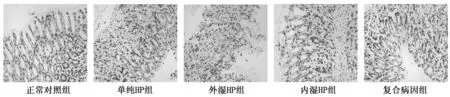
图2 各实验组胃黏膜细胞凋亡(×400)
3.2.2 各实验组 FoxO信号通路相关物质蛋白表达结果
PTEN、FoxO3a表达情况:单纯HP组与正常对照组对比,PTEN、FoxO3a表达水平无显著差异,无统计学意义(P>0.05);余模型组与正常对照组对比,PTEN、FoxO3a表达水平升高,且统计有显著差异(P<0.01),其中以复合病因组升高更为显著。复合病因组分别与单纯HP组、内湿HP组、外湿HP组对比,PTEN表达水平升高最多,且比较均有显著性差异(P<0.01)。复合病因组与单纯HP组,FoxO3a表达水平升高,比较有显著差异(P<0.01),而与内湿HP组、外湿HP组对比,FoxO3a表达水平无显著差异(P>0.05)。结果见表1,图3。
表1 western blot法检测胃黏膜组织PTEN、FoxO3a蛋白表达情况
PI3K、p-Akt表达情况:与正常对照组对比,各模型组PI3K、p-Akt表达水平均下降,比较有显著性差异(P<0.01),以复合病因组下降最为显著。复合病因组分别于内湿HP组、外湿HP组、单纯HP组比较,PI3K、p-Akt表达水平降低最多,其中与内湿组比较有差异(P<0.05),与外湿HP组、单纯HP组比较有显著差异(P<0.01)。结果见表2,图3。
表2 western blot法检测胃黏膜组织PI3K、p-Akt蛋白表达情况
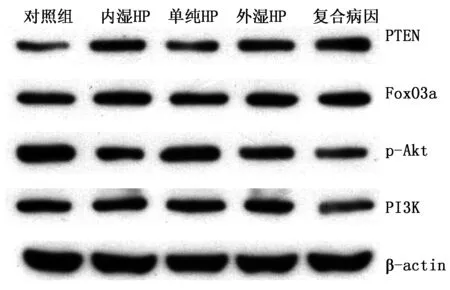
图3 western blot法检测胃黏膜组织PI3K、p-Akt蛋白表达情况
3.2.3 FoxO信号通路相关物质基因含量比较结果
PTEN、FoxO3a含量:各模型组与正常对照组对比,PTEN、FoxO3a含量升高,比较有显著差异,有统计学意义(P<0.01),其中以复合病因组升高更为显著。复合病因组分别与单纯HP组、内湿HP组、外湿HP组对比,复合病因组PTEN、FoxO3a含量升高最多,且比较均有显著差异(P<0.01)。结果见表3。
PI3K、Akt含量:与正常对照组对比,各模型组PI3K、Akt含量降低,且差异有显著统计学意义(P<0.01),其中以复合病因组降低更为显著。复合病因组分别与单纯HP组、内湿HP组、外湿HP组对比,复合病因组PI3K、Akt含量降低最多,且比较均有显著差异(P<0.01)。结果见表4。
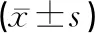
表3 RT-PCR法检测胃黏膜组织PTEN、FoxO3a表达情况

表4 RT-PCR法检测胃黏膜组织PI3K、Akt表达情况
4 讨论
4.1 脾胃湿热、HP感染与胃黏膜细胞凋亡之间的关联性
HP感染在脾胃湿热证形成、发展过程中发挥很大作用,脾胃湿热证与HP感染存在很大关联性。脾胃湿热与HP两者相互影响,湿热环境为HP的生长繁殖提供有利条件,而HP持续感染可进一步导致脾胃湿热证症状的加重。HP可以通过多种不同的机制来诱导胃黏膜细胞凋亡。HP产生的各种细菌毒性因子,如脂多糖、空泡化细胞毒素(Vac A)、γ谷氨酰胺转肽酶等可以直接诱导胃黏膜细胞凋亡。除了HP产生的细菌毒性因子诱导胃黏膜细胞凋亡,还可以通过HP相关的宿主炎性反应来诱导胃黏膜细胞凋亡[22-23]。
在临床观察和实验研究基础上[13-14],发现在各种中医证型中,脾胃湿热证胃黏膜细胞凋亡最为明显(胃黏膜炎症程度重,促细胞凋亡的相关蛋白水平呈过度表达)。实验研究发现脾胃湿热证模型组胃黏膜炎症程度、凋亡蛋白Fas、p53表达水平、胃黏膜细胞凋亡指数明显高于正常对照组。并且用具有清热祛湿法功效的中药方剂干预后,脾胃湿热证动物模型的炎症程度,Fas、p53的表达水平以及凋亡细胞指数均明显降低。
本实验检测各模型组胃黏膜细胞凋亡率呈不同程度升高,胃黏膜炎症程度呈不同程度变化,凋亡率高低变化与炎症程度变化相一致,其结果与前期研究结果相符,证明了HAG脾胃湿热证小鼠模型存在胃黏膜细胞凋亡增多。
4.2 PTEN/PI3K/Akt/FoxO信号通路对细胞凋亡的调控
细胞凋亡中Fox转录因子的O亚家族(subfamily O of fork head transcription factors,FoxO)发挥着很重要的作用。FoxO的合成场所是细胞质,在细胞质中合成后的FoxO可直接激活其NLS模体与importin(IMP)结合,从而进入细胞核中,DBD(DNA结合模体)与DNA结合诱导细胞的死亡;如果FoxO被其他物质磷酸化就无法进入细胞核中,从而失去对细胞凋亡的调控,细胞存活[24]。在人体许许多多复杂的信号通路中,PTEN/PI3K/Akt/FoxO信号通路对细胞的凋亡有着重要的调控作用[25]。
脂激酶家族磷酸肌醇-3-激酶(phosphoinositide 3-kinase,PI3K)的作用是将磷脂酰肌醇磷酸化。PI3K在细胞膜内被激活后,将磷脂酰肌醇-2-磷酸(PIP2)转变为磷脂酰肌醇-3-磷酸(PIP3),而PIP3的作用是与Akt的N端PH结构域结合,PIP3与Akt相结合后,Akt就可以从细胞质中转移到细胞膜上,转移到细胞膜上的Akt将与3-磷酸肌醇依赖性蛋白(3-phosphoinositid-dependent protein kinase-1, PDK1)相结合,从而进一步使下游的许多底物活化并磷酸化,从而发挥相应作用[26]。
第10号染色体缺失的磷酸酶和张力蛋白同源物(phosphatase and tensin homologue deleted on chromosome 10, PTEN)的主要作用是抑制细胞生长、促进细胞凋亡、参与细胞周期调控[27]。研究表明PTEN具有拮抗PI3K的作用,PI3K被拮抗后导致PIP3量减少,从而促进细胞凋亡,所以PTEN是通过抑制PI3K表达,下调PIP3的水平来发挥对细胞凋亡起调控作用的[28]。叉头转录因子O亚家族FoxOs是PTEN/PI3K/Akt/FoxO信号通路中重要的转录调控因子[29],在细胞凋亡过程中起着重要作用。当PI3K/Akt信号途径在机体内环境各种因子的刺激下被激活时将FoxO3a磷酸化。被磷酸化的FoxO3a失去了转录活性,然后将从细胞核内排出,最终在细胞质中被降解,从而无法调控细胞凋亡。
5 结论
综上所述,各模型组胃黏膜炎症程度重,细胞凋亡率高,其中复合病因模型组胃黏膜炎症程度以及细胞凋亡率最高,其与本课题组前期研究相符。在各模型组中,复合病因模型组其PTEN、FoxO3a蛋白表达检测和基因含量检测值最大,PI3K、Akt蛋白表达检测和基因含量检测值最小,结合各实验组综合比较,从而发现炎症程度及细胞凋亡率与PTEN、FoxO3a呈正相关变化,与PI3K、Akt呈负相关变化。依据PTEN/PI3K/Akt/FoxO信号通路调控细胞凋亡的机制,其细胞凋亡程度情况与其信号通路各因子变化情况相符,由此我们得知HP相关性胃炎脾胃湿热证胃黏膜细胞凋亡的机制与PTEN/PI3K/Akt/FoxO信号通路有关,可能是激活其通路来对细胞凋亡进行调控,从而为中医辨证选方用药及中医药防治HP相关性胃炎提供更多理论依据。
