硫化镉制备及光催化分解水制氢综合实验设计
2020-09-29崔佳宝刘小康尹志红
崔佳宝,刘小康,王 慧,尹志红,常 毅
(河南师范大学 化学化工学院,河南 新乡 453007)
物理化学实验是一门理论性、实践性、综合性、研究性很强的课程,是需要综合运用物理和化学的原理、方法及数学运算工具等多方面知识的课程[1]。传统的实验教学以巩固理论知识、掌握实验方法为目的。随着社会的快速发展以及国家提出建设创新型国家的目标要求,培养大学生创新能力成为高校实验改革的重点[2-3]。因此,迫切需要把一些物理化学前沿课题展现给本科生,而不只局限于传统实验教学。本文引入前沿课题光催化分解水制氢,有助于提高学生综合实验能力,培养学生创新能力及科学素养。
1 实验设计背景
光催化分解水制氢作为物理化学最前沿课题之一,涉及光化学、催化化学、化学反应动力学、仪器分析、半导体物理等多个学科领域,因其能直接将太阳能转化为氢能,被认为是未来最有希望解决能源问题的方法之一,从20 世纪70 年代至今被广泛研究[4]。主要是由于当今社会对能源的需求日趋迫切,传统的能源如煤、石油等化石燃料将在未来一到两百年内消耗殆尽,以及其对环境有一定危害,难以满足社会可持续发展的需求。在未来,人类面临的一个巨大挑战就是将能源供应从化石燃料转移到可再生能源上来[5-6]。太阳能是最重要的清洁、无污染而且能量巨大的可再生能源之一,如果采用合适的方法将太阳能转化为一种可储存的清洁能源,便能使其得到有效的利用[7-8]。氢气作为一种高燃值的清洁能源载体,其燃烧产物是无污染的水,所以氢气被认为是未来最有希望解决能源问题的出路之一。怎样将太阳能转化为氢能呢?目前主要途径有:通过太阳能发电即电解水制氢、利用太阳光使植物产生氢气即生物制氢以及用半导体直接分解水制氢。在以上途径中,半导体光催化制氢是一种成本低廉、集光转换与能量储存于一体的方法,在科学界备受关注[8-10]。
金属硫化物通常被认为是有效的可见光响应的半导体,其价带多由S 的3p 轨道构成,使得其相对于氧化物半导体来说具有更小的禁带宽度。CdS 作为金属硫化物的典型代表之一,是一种高效、典型、价格低廉的光催化剂,带隙宽度2.4 eV 左右,有较好的可见光响应,早在20 世纪80 年代就作为光催化产氢材料被人们广泛研究[11-14]。
影响材料光催化产氢性能的因素有很多,比如材料的化学组成、晶相结构、形貌结构、能带结构、表面缺陷等。晶体的结晶度越高,缺陷就越少,缺陷会作为电子空穴的复合中心从而使光催化活性降低。如果颗粒尺寸减小,光生电子和空穴的转移路径会变短,在转移途中复合几率降低,从而提升光催化效果。在催化剂合成过程中颗粒析出后可能会发生团聚,以及在合成过程中表面可能吸附基团,均会对材料光催化活性造成影响[15-17]。
本综合实验即从材料的化学组成、形貌结构和表面吸附基团与其光催化性能之间的构效关系进行研究,分别采用水和乙醇为溶剂合成CdS,采用XRD、SEM、UV-Vis DRS 等对其结构、形貌以及光学性能进行表征,并通过光催化分解水制氢研究其光催化性能。通过本实验,不仅可使同学们了解和掌握材料的基本制备、表征和光催化产氢性能研究的方法,还能熟悉相关的概念和理论知识,增强学习、分析和解决问题的能力,提高学生的科研兴趣和创新能力。
2 实验部分
2.1 实验原理
半导体的能带结构通常由填满电子的低能价带(VB)和空的导带(CB)组成,价带和导带之间为禁带。当能量等于或大于禁带宽度(Eg)的光照射半导体表面时,半导体价带上的电子被激发跃迁至导带,相应地在价带上形成空穴。要实现太阳能光催化分解水产生氢气和氧气,光生电子必须能还原H2O 产生H2,而光生空穴必须能氧化H2O 产生O2,即光催化半导体的导带底(CB)要比H+/H2电位(E=0 V vs.NHE,pH=0)更负,电位越负,还原能力越强,而价带顶(VB)要比O2/OH-电位(E=1.23 V vs.NHE, pH=0)更正,电位越正,氧化能力越强。
2.2 试剂或材料
半水合氯化镉(CdCl2·2.5H2O,AR,99%(ω/ω),国药集团化学试剂有限公司)、九水合硫化钠(Na2S·9H2O,AR,98%(ω/ω),天津市大茂化学试剂厂)、氢氧化钠(NaOH,AR,95%(ω/ω),上海麦克林生化科技有限公司)、无水亚硫酸钠(Na2SO3,AR,97%(ω/ω),天津市塘沽新华化工厂)、无水乙醇(C2H5OH,AR,99.7%(ω/ω),国药集团化学试剂有限公司)、蒸馏水。
2.3 仪器和表征方法
采用日本电子 JSM-63901 型扫描电子显微镜(SEM)观察光催化剂的表面形貌、颗粒大小及其分布状态等微观结构,工作电压为 5.0 kV。德国Brukeraxs D8 ADVANCE X 射线粉末衍射仪测定样品的晶型结构,使用Cu Kα 射线(λ=0.15 nm)为射线源,配有石墨单色镜,管压为40 kV,管流为40 MA,扫描速度为2°·min-1,扫描角度为5°~80°。珀金埃尔默仪器有限公司Lambd 950 型紫外-可见漫反射光谱仪(UV-Vis)测试样品的光学吸收性能,测试中以BaSO4做基线校正,测试范围在200~800 nm。赛默飞世尔科技公司X 射线电子能谱仪(XPS, ESCALAB250Xi)检测样品所含元素的化合态,其电子能量分析器分析半径为0.02~8mm 连续可调,工作模式为固定分析器能量(CAE)和固定减速比(CRR),理论能量分辨为0.02~8 eV(CAE)、0.02%~2.0%(CRR)。
2.4 实验步骤
2.4.1 制备方法
水为溶剂:将0.228 4 g CdCl2·2.5H2O 溶解于20 mL去离子水中,0.4 g NaOH 溶解于100 mL 去离子水中,再将上述2 种溶液混合,搅拌5 min。之后把10 mL溶解有1.2 g Na2S·9H2O 的水溶液逐滴加入上述混合溶液,并不断搅拌1 h,抽滤,在70 ℃下烘干,得到固体物质为CdS-H2O。
乙醇为溶剂:将0.228 4 g CdCl2·2.5H2O 溶解于60 mL乙醇溶液中,0.4 g NaOH 溶解于60 mL 乙醇溶液中,再将上述2 种溶液混合,搅拌5 min。之后把10 mL溶解有1.2 g Na2S·9H2O 的乙醇溶液逐滴加入上述混合溶液,并不断搅拌1 h,抽滤,在70 ℃下烘干,得到固体物质为CdS-C2H5OH。
2.4.2 光催化性能测试
光解水制氢实验是在一个封闭的循环系统(Labsolar-Ⅲ AG 系统)连接的真空反应器中进行的。20 mg 的光催化剂分散在40 mL 蒸馏水中,并加入0.764 8 g Na2S·9H2O 和0.403 4 g Na2SO3作为牺牲剂。光照之前,将系统抽真空30 min 形成真空环境后开始光解水制氢实验。光源为300 W 氙灯,固定在距溶液10 cm 处;高纯氩气作为载气,流量为0.5 mL·s-1;输出压力为0.4~0.5 MPa,工作电压和工作电流约为20 mV和50 mA。在反应过程中,循环冷却水将反应器的温度保持在25 ℃左右。通过使用在线气相色谱分析氢气产生量,在一定照射时间下收集气体;反应进行3 h。柱为0.5 nm 分子筛柱,检测器为热导检测器(TCD)。基于不同反应时间的峰面积,计算氢气的产量,并通过3 h 的总氢气产量测量光催化剂的催化活性。
3 实验结果与讨论
3.1 XRD 分析
为了研究Na2S·9H2O 用量对所合成样品的影响,前期工作中对加入与 CdCl2·2.5H2O 相同浓度的Na2S·9H2O 所制备的CdS 进行了X 射线衍射分析,通过与衍射峰标卡对比发现,采用不同溶剂合成的CdS中均含有Cd(OH)2(JCPDS No.73-0969),分别标记为Cd(OH)2/CdS-H2O 和Cd(OH)2/CdS-C2H5OH。这是由于Na2S·9H2O 极易吸水,会有称样误差,使其实际浓度小于CdCl2·2.5H2O 的浓度,因此不能将第一步生成的Cd(OH)2完全反应生成CdS,从而有一定量Cd(OH)2存在。当Na2S·9H2O 过量后,由图1 可知,分别采用水和乙醇为溶剂所合成的 CdS 在 26.5°、43.8°和51.9°附近出现较为明显的3 个衍射信号,对比衍射峰标准卡可以发现,所制备样品与立方相闪锌矿型CdS特征衍射峰图谱(JCPDS No.89-0440)一致,分别对应CdS 的(111)、(220)和(311)晶面,表明所制备样品为立方相闪锌矿型的CdS,同时也说明2 种不同溶剂对合成CdS 的晶型结构没有明显影响。综上分析,在实际综合实验设计中,本文加入过量的Na2S·9H2O来制备CdS。

图1 CdS-H2O、CdS-C2H5OH、Cd(OH)2/CdS-H2O、Cd(OH)2/CdS-C2H5OH 的XRD 谱图
3.2 UV-Vis DRS 分析
为了研究样品的光吸收性质,进行了紫外-可见漫反射测试。图2 给出了CdS-H2O、CdS-C2H5OH 的UV-Vis DRS 光谱图,通过谱图可以看到,两者在小于600 nm 区域均有较强的带吸收。并由公式Eg=1240/λ(λ 指图中带边切线与横坐标轴交点的波长值)求其禁带宽度,采用不同溶剂合成的CdS 的禁带宽度几近相同,约为2.21 eV。
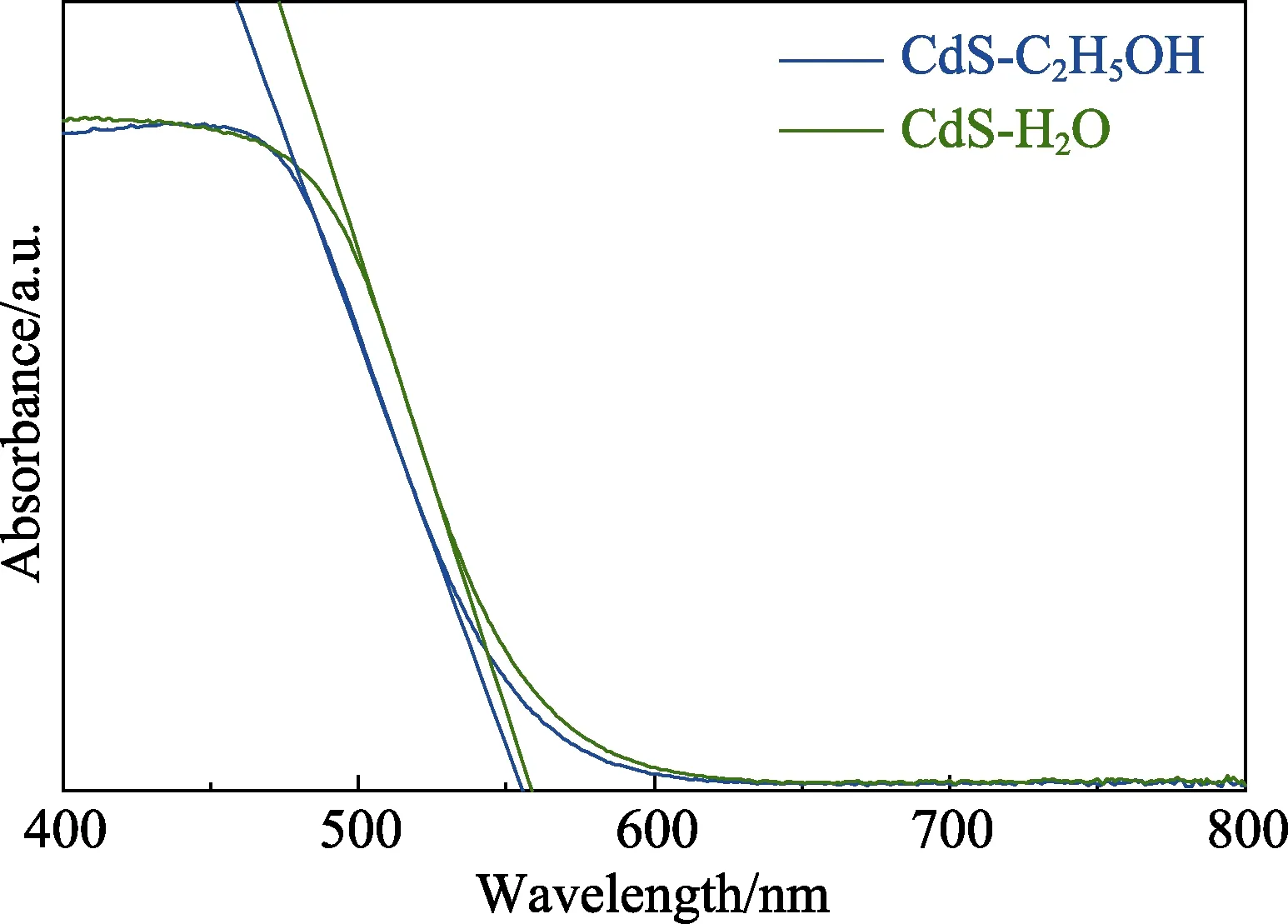
图2 CdS-H2O 和CdS-C2H5OH 的UV-Vis DRS 吸收光谱图
3.3 SEM 分析
为了考察所合成样品的形貌和结构,进行了SEM测试,结果如图3 所示。采用不同溶剂合成的CdS 均为颗粒状,但以水为溶剂合成的CdS 颗粒较以乙醇为溶剂合成的CdS 颗粒稍小。不难看出分别采用水和乙醇为溶剂合成的CdS 均有不同程度的团聚现象,但以水为溶剂合成的CdS 团聚现象更为严重,这可能与CdS 表面结构有关,因为纳米粒子具有特殊的表面结构,其表面缺少临近配位原子,具有很高的活性,因而很容易发生团聚[18]。
3.4 XPS 分析
为了研究所制备样品的表面元素的化学形态,进行了XPS 测试。图4 是2 种样品O 1s 的高分辨率XPS能谱,其在532.6 和531.2 eV 处存在电子结合能峰,分别为C==O 和C—OH 峰。从图中可以得到以乙醇为溶剂制备的CdS 在531.2 eV 处的峰高度更强、面积更大,因此可以判断其表面具有较多的羟基基团。
3.5 光催化性能结果分析

图3 合成样品的SEM 图

图4 制备样品的XPS 谱图

图5 光催化分解水制氢性能图
为了测定所合成的CdS-H2O、CdS-C2H5OH 的光解水制氢能力,以及Na2S·9H2O 的用量对所合成样品的影响,进行了光解水制氢实验,结果如图5 所示。由图5(a)可知,所有样品产氢量均随着时间的增加而增加,但以乙醇为溶剂合成的样品的产氢活性均明显高于以水为溶剂合成的样品。其中CdS-C2H5OH 产氢效率最高(356.05 μmol·g-1·h-1),为CdS-H2O 的10.97倍,为Cd(OH)2/CdS-H2O 的19.49 倍,表明以乙醇为溶剂制备的CdS 具有更优异的产氢性能。这可能是由于:(1)在以乙醇为溶剂合成CdS 的过程中颗粒团簇的程度小,具有更大的比表面积;(2)CdS-C2H5OH表面有较多的羟基基团,因为羟基具有亲水性,可能更有利于材料表面的电荷传输到水中,减少电子空穴的复合,提高光解水制氢效率;(3)Cd(OH)2/CdS-H2O和Cd(OH)2/CdS-C2H5OH 含有一定量Cd(OH)2,但并未有报道 Cd(OH)2具有光催化产氢活性,其次Cd(OH)2的存在可能会影响CdS 表面光生电荷的传输,导致其光催化产氢性能低于纯CdS。
4 实验教学模式与内容拓展
(1)本综合实验将物理化学前沿课题光催化分解水制氢呈现给本科生,有效地使本科教学实验与学科前沿相结合。通过该实验,充分发挥了X 射线衍射仪、扫描电子显微镜、紫外-可见漫反射仪、气相色谱仪等大型精密仪器在本科教学实验中的应用,所涉及的仪器在普通高等院校中基本都已配备,经过简单培训后学生便可上手操作,提高学生利用大型仪器分析解决问题的能力。
(2)按照实验内容与教学安排,本综合实验以团队的形式进行。教师在实验过程中要充分尊重学生的主体地位,充当学生的引导者。学生在实验前查阅相关文献资料并提交预习报告,教师根据学生的预习情况对本实验进行讲解,学生方可独立进行实验。本实验计划10 个学时,每学时45 min,学生以团队的形式分工进行实验,实验结束后对实验结果进行分析总结并以科技论文形式提交实验报告。
(3)本实验可开设为综合开放式实验。教师可以根据学生的能力和实验水平积极引导学生对本实验进行拓展研究,比如改变合成过程中NaOH 用量,探究其对CdS 光催化产氢性能的影响;改变溶剂或加入带有羟基的表面活性剂调整材料表面羟基基团的量,分析羟基基团对CdS 光催化性能的影响;探究改变合成中S 源,比如使用硫代乙酰胺等作为S 源对合成CdS形貌和性能的影响等。拓展内容为选做实验,可以单独作为课堂教学内容,也可根据学生兴趣进行自主探究以及作为本科毕业设计等。
5 结论
光催化分解水制氢是物理化学前沿课题,是光化学反应与催化化学反应的有机结合,涉及多个学科理论,是当代科研热点。通过以典型的光催化剂CdS 为例,把光催化分解水制氢技术呈现给本科生,拓展本科生学科视野以及提高其创新能力和科研素养。采用化学沉淀法合成不同的CdS 光催化剂,此方法简单、温和,通过光催化分解水制氢实验得出CdS-C2H5OH 具有更高的产氢活性,证明分别采用水和乙醇2 种不同溶剂对合成CdS 有重要影响。
