冻融周期不同囊胚移植策略的临床结局比较
2020-09-25王慧刘帅杨丽马才启武慧姣
王慧 刘帅 杨丽 马才启 武慧姣
广州市妇女儿童医疗中心(广州510623)
冻融胚胎移植(freezing embryo transfer,FET)作为一种衍生的辅助生殖技术(assisted reproductive technology,ART),因其可增加累计妊娠率、降低ART的并发症,并可获得与新鲜胚胎移植相近的临床结局,已被广泛接受和应用[1-2]。囊胚是胚胎发育的重要阶段,囊胚培养可以淘汰掉一些发育潜能差和染色体异常的胚胎,因此囊胚移植较卵裂期胚胎移植有更好的妊娠结局[3-6]。在冻融周期进行囊胚移植已成为许多中心的常规移植策略。目前有部分患者选择直接冻融囊胚移植,另有部分患者是将卵裂期胚胎冻融后再培养至囊胚进行移植,这两种策略哪种更优目前还没有定论。毛佳婷等[7-8]认为直接冻融囊胚有更高的种植率和妊娠率,但王大琳等[9]表明冻融卵裂期胚胎再培养至囊胚移植的妊娠结局会更好。此外,在将卵裂期胚胎冻融后再行囊胚培养时,有部分患者会出现冻融周期没有可利用囊胚形成但有低质量囊胚形成的情况。医学上是否可以为患者移植低质量囊胚有待探讨。本研究对本院生殖中心2015年7月至2019年7月完成的791个囊胚移植周期进行回顾性分析,比较直接冻融可利用囊胚与冻融卵裂期胚胎再培养至可利用囊胚移植在临床妊娠结局方面的差异,同时也比较冻融卵裂期胚胎培养至可利用囊胚和低质量囊胚移植的差异,旨在为患者提供更为合适的囊胚移植策略。
1 资料与方法
1.1 一般资料选择2015年7月至2019年7月在广州市妇女儿童医疗中心生殖医学中心进行冻融周期囊胚移植的791个周期,其中直接冻融可利用囊胚移植组(A组)372个周期,冻融卵裂期胚胎再培养至可利用囊胚移植组(B组)261个周期,冻融卵裂期胚胎培养至低质量囊胚移植组(C组)158个周期。所有患者均签署囊胚培养知情同意书。
1.2 方法
1.2.1 促排卵及囊胚培养所有研究对象采用的促排卵方案均按本中心常规进行,获卵后根据患者情况采用常规IVF 授精或行单精子卵胞浆注射,本研究不包括行胚胎植入前诊断的患者。在受精后第3天进行胚胎评分。除了移植胚胎外,剩余胚胎经患者知情同意后有些行全部卵裂期胚胎冷冻;有些行全部囊胚培养;还有些患者挑选部分胚胎冷冻,剩余胚胎行囊胚培养,第5-6天将发育成可利用囊胚的胚胎进行冷冻保存。
1.2.2 囊胚评分系统本中心采用Gardner 评分标准进行囊胚评估[10]:根据囊腔扩张程度分为6个时期。Ⅰ期:早期囊腔不超过囊胚总体积的1/2;Ⅱ期:囊腔体积超过囊胚总体积的1/2;Ⅲ期:囊腔全占据整个囊胚;Ⅳ期:囊腔继续扩张,透明带变薄;Ⅴ期:部分囊胚从透明带中孵出;Ⅵ期:囊胚完全孵出。处于Ⅲ-Ⅵ期的囊胚根据内细胞团和滋养层细胞质量进行分级。(1)内细胞团分级:A级细胞排列紧密且数量多,B级细胞排列松散且数量较少,C级细胞数量很少。(2)滋养层细胞分级:A级上皮细胞层结构致密且有较多细胞,B级上皮细胞层结构松散且细胞不多,C级上皮细胞层由稀疏细胞组成。冷冻囊胚的标准:将D5评分>ⅢCC、D6评分>ⅣCC 定义为可利用囊胚,将未达到以上标准的囊胚定义为低质量囊胚。
1.2.3 胚胎的冷冻与复苏(1)D3卵裂期胚胎及囊胚的玻璃化冷冻。本中心常规使用JY-V(加拿大JY公司)玻璃化冷冻液进行卵裂期胚胎和囊胚的冷冻。JY-V 包括平衡液(V1),玻璃化冷冻液(V2),先放于室温平衡。将可利用囊胚在冷冻前利用激光辅助孵化系统(300 μs)在远离内细胞团一侧透明带进行人工皱缩囊腔,将囊胚液释放,囊腔缩小,随后将皱缩后的囊胚转移至V1液中平衡5~7 min,D3卵裂期胚胎则直接在V1液平衡3~5 min,然后转移至在V2 冷冻液中1 min 即开始装管,每次放1~2个胚胎。将胚胎放在载体的最前端1~2 mm 处,套上外套管,将载体完全浸入液氮中,将冷冻载杆装入冷冻套管液氮储存。从装管开始至放入液氮中需要在2 min 操作完成。(2)D3卵裂期胚胎及囊胚的玻璃化解冻。本中心常规使用JY-T 玻璃化解冻液进行卵裂期胚胎和囊胚的解冻。JY-T 包括解冻液T1,稀释液T2,稀释液T3,冲洗液T4,先放于室温平衡。从液氮中取出冷冻载杆后迅速浸入T1液中,显微镜下见胚胎后将载杆(medicult 管)移出,胚胎停留1 min后,先后移入T2液3 min、T3液3 min、T4液3 min,最后将胚胎移入囊胚培养液(G2 vitrolife公司),放入37℃,6%CO2培养箱中。囊胚复苏成功2 h后可用于移植,D3卵裂期胚胎复苏后需培养至D5或D6 形成囊胚后可用于移植。
1.2.4 囊胚移植将复苏后存活的囊胚或复苏D3胚胎行囊胚培养后形成的囊胚进行移植,囊胚移植28 d后,腹部B 超下见妊娠囊及原始心管搏动确定临床妊娠。
1.3 统计学方法应用SPSS 19.0 统计学软件进行分析,率的比较采用χ2检验,符合正态分布的定量资料均以均数±标准差表示,比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 患者基本情况冻融可利用囊胚组(A组)和冻融卵裂期胚胎再培养至可利用囊胚组(B组)患者的平均年龄、体质量指数(BMI)、基础FSH、不孕年限及内膜厚度比较,差异无统计学意义;但B组平均移植胚胎数比A组多,差异有统计学意义(P<0.05)。A组平均移植囊胚数为1.68个,B组平均移植囊胚数为1.82个。
冻融卵裂期胚胎培养至可利用囊胚组(B组)和冻融卵裂期胚胎培养至低质量囊胚(C组)患者的BMI、基础FSH、不孕年限、内膜厚度及移植胚胎数比较,组间差异无统计学意义;但C组的平均年龄比B组大,差异有统计学意义(P<0.05),见表1。
2.2 患者临床妊娠结局冻融可利用囊胚组(A组)有372个周期获得可利用囊胚,共移植囊胚624枚。冻融卵裂期胚胎再培养至可利用囊胚移植组(B组)有261个周期,共移植囊胚474枚,获得妊娠周期157个,共225枚胚胎成功着床。B组同A组相比,临床妊娠率、种植率、流产率及宫外孕率差异均无统计学意义,但B组多胎率高于A组,差异有统计学意义(P<0.05),见表2。
冻融卵裂期胚胎再培养至低质量囊胚移植(C组)有158个周期,共移植胚胎277枚。获得妊娠周期76个,共89枚胚胎成功着床。C组同B组的临床妊娠率、种植率及多胎率差异有统计学意义(P<0.05),见表2。
表1 各组不孕患者基本情况比较Tab.1 Comparison of demographic characteristics of the patients in different groups ±s
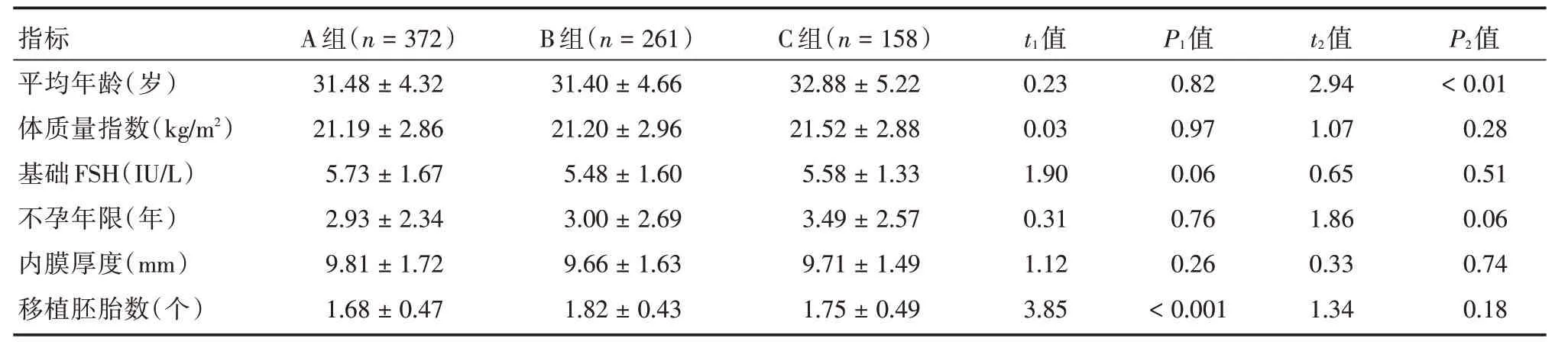
表1 各组不孕患者基本情况比较Tab.1 Comparison of demographic characteristics of the patients in different groups ±s
注:t1、P1代表A组和B组之间的比较;t2、P2代表B组和C组之间的比较
指标平均年龄(岁)体质量指数(kg/m2)基础FSH(IU/L)不孕年限(年)内膜厚度(mm)移植胚胎数(个)A组(n=372)31.48±4.32 21.19±2.86 5.73±1.67 2.93±2.34 9.81±1.72 1.68±0.47 B组(n=261)31.40±4.66 21.20±2.96 5.48±1.60 3.00±2.69 9.66±1.63 1.82±0.43 C组(n=158)32.88±5.22 21.52±2.88 5.58±1.33 3.49±2.57 9.71±1.49 1.75±0.49 t1值0.23 0.03 1.90 0.31 1.12 3.85 P1值0.82 0.97 0.06 0.76 0.26<0.001 t2值2.94 1.07 0.65 1.86 0.33 1.34 P2值<0.01 0.28 0.51 0.06 0.74 0.18

表2 各组患者囊胚移植的临床结局比较Tab.2 Comparison of pregnancy outcomes of the patients in different groups
3 讨论
ART 中,冷冻保存人类胚胎已成为临床实践中的常规程序。在卵巢过度刺激综合征或其他原因不宜进行新鲜胚胎移植的情况下,可以选择冷冻所有可用的胚胎以后再进行解冻移植[11]。在全球范围内,FET的应用在过去几年中一直在不断增加,目前占所有胚胎移植的50%以上[12-13]。受精卵在受精后第3天(D3)进行冷冻保存是从早年到最近的临床实践中最常用的方法。近年来,随着序贯培养体系的不断完善,人类囊胚形成率及质量得到了改善,囊胚培养变得相对成熟。培养至第5天(D5)和第6天(D6)的囊胚在形态上经历了细胞的融合、囊胚腔的形成和囊胚腔扩张的过程,可淘汰一些发育潜能不好及染色体异常的胚胎,提高了临床妊娠率和活产率[14-15],而且囊胚与子宫内膜之间有更好的时间同步性,使其有更高的着床率,移植的胚胎数可能减少,并因此降低了多胎妊娠的风险[16-17]。因此,越来越多的患者愿意接受体外培养至囊胚再行可用囊胚的冻融移植,这可以避免无效的胚胎移植的情况出现。然而,许多患者在之前的ART 周期中在液氮罐中储存的大部分是D3卵裂期的胚胎。在这部分患者希望做囊胚移植时,实验室会将其D3卵裂期胚胎解冻后再培养至囊胚进行移植。
在冻融周期中,直接冻融囊胚移植或将卵裂期胚胎冻融后再培养至囊胚进行移植,哪种方式更为有效,目前还没有定论。有研究[7-8]认为玻璃化冷冻囊胚复苏移植能获得较高的种植率和妊娠率,囊胚可能是玻璃化冷冻胚胎的较好阶段;也有结果[9]表明冻融卵裂期胚胎再培养至囊胚移植组的临床妊娠率以及胚胎种植率要高于直接冻融囊胚移植组,但两组临床妊娠率比较差异无统计学意义。本研究回顾性分析了我院生殖中心2015年7月至2019年7月完成的冻融周期囊胚移植周期,其中冻融可利用囊胚后移植372个周期(A组),冻融卵裂期胚胎再培养至可利用囊胚移植261个周期(B组),笔者将A组和B组的临床结局进行了比较,结果显示两组的临床妊娠率(61.56%vs.60.15%)、移植率(48.40%vs.47.47%)、宫外孕率(2.18%vs.1.91%)及流产率(17.90%vs.12.74%)相比,差异均无统计学意义,但B组的多胎率要高于A组(42.68%vs.31.44%)。这可能是由于B组的平均移植囊胚数(1.82)要高于A组(1.68)。这个结果也暗示在冻融卵裂期胚胎培养至囊胚移植时,可能是通过增加移植囊胚的数目才获得和冻融囊胚移植相似的临床妊娠率。XIONG 等[18]研究表明,与冻融囊胚移植相比,冻融卵裂期胚胎培养至囊胚移植的临床妊娠率和种植率略低,但是,早期流产的发生率也较低,因此两组的持续妊娠率和活产率相似。包括性别比、入院新生儿重症监护病房(NICU)和出生缺陷在内的新生儿结局也相同。这些发现表明,解冻卵裂期胚胎培养至囊胚进行移植,妊娠结局和围产期结局与直接冻融囊胚移植是相似的,这对于患者来说是可以接受的。在将卵裂期胚胎冻融后再行囊胚培养时,有部分患者会出现这个冻融周期没有可利用囊胚形成的情况。有研究[19]也指出D3卵裂期胚胎冻融后培养至囊胚移植可以得到较好的临床结果,但有无囊胚形成或无可利用囊胚形成而取消移植的风险。目前,大部分生殖医学中心评估囊胚采用的是Gardner 囊胚分级系统[10],基于内细胞团、滋养外胚层形态和扩张等级3个参数。只有D5评分>ⅢCC、D6评分>ⅣCC 定义为可利用囊胚。有些患者在冻融周期中,胚胎生长速率较慢,在第5天或第6天虽有囊胚形成,但没达到以上标准,又不能接受无胚胎移植的情况,患者知情同意后移植了一些发育速度较慢或质量较差的囊胚。这些低质量囊胚的临床结局如何尚未明确。本研究回顾性分析了冻融卵裂期胚胎再培养至低质量囊胚移植158个周期(C组),其中153个周期是D5 移植的Ⅰ期、Ⅱ期早期囊胚。同冻融卵裂期胚胎再培养至可利用囊胚移植(B组)相比,临床妊娠率(48.10%vs.60.15%)、种植率(32.13%vs.47.47%)和多胎率(15.79%vs.42.68%)差异有统计学意义,流产率和宫外孕率差异无统计学意义。有研究[20-21]认为在冻融移植周期,D5囊胚的移植率明显高于D6的移植率,HUANG等[22]表明延迟发育的第7天囊胚与第5天、第6天囊胚有相似的围产期结局。不同生长速率的囊胚都具有相似的发育力。本研究发现低质量囊胚对冻融胚胎移植的临床结局有负面影响。由于低质量囊胚的种植率和多胎率低,可以适当增加移植数目来保持一定的临床妊娠率。也有学者将皱缩囊胚与低质量囊胚联合复苏移植也能获得不错的临床结局[23]。
笔者在对冻融卵裂期胚胎再培养至可利用囊胚移植组(B组)和冻融卵裂期胚胎再培养至低质量囊胚移植组(C组)基础资料的比较中发现,C组的平均年龄要比B组高。年龄是影响囊胚形成的因素之一[24],也同妊娠结局有关。本研究的不足在于没能排除年龄的干扰。
综上所述,直接冻融可利用囊胚与冻融卵裂期胚胎再培养至可利用囊胚移植的临床结局差异无统计学意义。RACCA 等[25]通过多元Logistic回归分析允许对相关混杂因素进行调整,结果表明冷冻周期中移植的胚胎数量与活产率不相关。因此,要尽量减少胚胎移植个数,降低多胎率的发生。在冻融周期无可利用囊胚移植的情况下,移植低质量囊胚虽然临床妊娠率稍低,但可减少患者移植周期,避免胚胎的浪费。在临床工作中,应权衡每位患者的胚胎质量以及自身条件,在患者知情同意的情况下,选择最适合的囊胚移植方案。
