氧化铁柱层状铌钼酸和钽钼酸的制备、结构及其光吸收性能研究
2020-09-23徐向前刘淑敏李保军郭宪吉
徐向前,刘淑敏,李保军,郭宪吉*
(1.郑州大学 化学学院,郑州 450001;2.郑州大学 绿色催化研究中心,郑州 450001;3.漯河食品职业学院 食品检测系,河南 漯河 462300)
层状铌钼酸盐和钽钼酸盐,LiMMoO6(M=Nb,Ta)、以及它们的质子交换产物,HMMoO6(M=Nb,Ta),都是具有Trirutile结构的典型层状化合物,其中HMMoO6(M=Nb,Ta)还是强的Brönsted酸[1].然而,它们本身的比表面积很小,仅有几个平方米[2],而且在高温条件下,HMMoO6(M=Nb,Ta)的层状结构极易被破坏,酸性也会丧失.以过渡金属氧化物如Cr2O3、TiO2等为层间柱子,将铌钼酸和钽钼酸等具有Trirutile结构的层状化合物柱撑,可以有效地增大其比表面积并改善耐热性能[3-4].众所周知,氧化铁具有较小的禁带宽度,在可见光光催化领域具有潜在的应用价值.Wu J H等[5-6]采用逐步离子交换技术,以Fe2O3作柱子,对同样具有Trirutile结构的层状铌钨酸(HNbWO6)和钽钨酸(HTaWO6)进行柱撑,获得了Fe2O3柱层状铌钨酸(HNbWO6/Fe2O3)和钽钨酸(HTaWO6/Fe2O3),并在此基础上制得贵金属Pt与Fe2O3的共柱撑产物HNbWO6/(Pt,Fe2O3)和HTaWO6/(Pt,Fe2O3).2001年,Wu J H等[7]采用水热合成技术制得Fe2O3、ZnO等一系列过渡金属氧化物分别与HNbWO6复合的二元材料,之后,Wang L等[8]又采用连续插层反应方式制得Cd0.8Zn0.2S柱层状钽钨酸(HTaWO6/Cd0.8Zn0.2S)以及贵金属Pt与Cd0.8Zn0.2S共柱撑的层柱产物(HTaWO6/(Pt,Cd0.8Zn0.2S)),这些材料在光催化分解水制氢反应或有机染料的催化降解反应中具有实际应用价值.对于由逐步离子交换法或连续插层反应方式合成的插层前躯体,其层间有机物种的去除,采用的是光降解的方法,未涉及产物的热稳定性.最近,课题组报道了氧化铁柱层状钽钨酸(Fe2O3-HTaWO6)的制备、热稳定性和表面形貌以及在罗丹明B光降解反应中的催化性能[9].在本研究中,采用逐步离子交换方式制备氧化铁柱层状铌钼酸(记为Fe2O3-HNbMoO6)和氧化铁柱层状钽钼酸(记为Fe2O3-HTaMoO6),并对它们的结构、热稳定性及其光吸收性能进行表征.
1 试验部分
1.1 试验试剂
所用主要试剂包括:Nb2O5、Li2CO3和MoO3(国药集团化学试剂有限公司),Ta2O5(阿拉丁),HNO3(洛阳市化学试剂厂),CH3COOCOCH3(乙酸酐,天津市科密欧化学试剂开发中心),Fe(NO3)3·9H2O(上海彭镇营房化工厂),等级均为分析纯,CH3CH2CH2NH2(正丙胺,国药集团化学试剂有限公司)的等级为化学纯.
1.2 合成
1.2.1 铌钼酸锂和水合铌钼酸及钽钼酸锂和水合钽钼酸的合成 铌钼酸锂(LiNbMoO6)和钽钼酸锂(LiTaMoO6)的制备均采用高温固相反应机制进行,水合铌钼酸(HNbMoO6·xH2O)和水合钽钼酸(HTaMoO6·yH2O)的制备是将LiNbMoO6和LiTaMoO6粉末分别置于2.0 mol/L的HNO3溶液通过离子交换机制完成.LiTaMoO6和HTaMoO6·yH2O制备的具体试验步骤参见文献[4].具体地,按物质的量比为1∶2∶1,依次称取Li2CO3、MoO3和Ta2O5,分别充分研细后混合均匀,于873 K空气环境中焙烧6 h,待冷至室温并再次研磨后,再在873 K焙烧6 h,如此重复4次,得到的浅绿色的粉末即为钽钼酸锂(LiTaMoO6).取10.0 g LiTaMoO6,加入1 000 mL 2.0 mol/L的HNO3溶液,室温搅拌36 h后更换一次HNO3溶液,继续搅拌36 h.经离心分离和充分洗涤后,于343 K烘干,所得的淡黄色粉末即是水合钽钼酸(HTaMoO6·yH2O).铌钼酸锂(LiNbMoO6)与钽钼酸锂(LiTaMoO6)的制备过程基本相同,所不同的是,LiNbMoO6是先在773 K下焙烧20 h后再于883 K焙烧12 h.水合铌钼酸与水合钽钼酸的制备过程相同,最终所得淡黄色粉为水合铌钼酸(HNbMoO6·xH2O).
1.2.2 正丙胺预支撑的层状铌钼酸和钽钼酸 正丙胺预支撑的层状钽钼酸(简记为C3-HTaMoO6)的制备亦参见文献[4].具体地,将新鲜配制的正丙胺水溶液(0.1 mol/L,60 mL)置于圆底烧瓶中,加入4.0 g HTaMoO6·yH2O粉末,在室温下连续搅拌24 h,经离心分离并充分洗涤后于室温风干,即得C3-HTaMoO6.正丙胺预支撑的层状铌钼酸(简记为C3-HNbMoO6)与C3-HTaMoO6的制备过程类似.
1.2.3 Fe(Ⅲ)多聚体离子溶液的制备 称取40.4 g Fe(NO3)3·9H2O和25 mL无水乙醇混合,室温搅拌至固体完全溶解后,将溶液置于冰水浴中边搅拌边慢慢滴加乙酸酐(70 mL),之后继续在冰水浴条件下搅拌0.5 h,析出的红棕色固体经分离并干燥后,再溶于500 mL去离子水中,即得含Fe(Ⅲ)多聚体离子的柱化液.
1.2.4 氧化铁柱层状铌钼酸和钽钼酸的合成 将1.0 g C3-HNbMoO6和1.0 g C3-HTaMoO6分别置入250 mL含Fe(Ⅲ)多聚体离子的柱化液中,在323 K下持续搅拌72 h.所得产物经离心分离后,用无水乙醇和去离子水充分洗涤,再于室温风干并在673 K的空气环境中焙烧2 h,所得焙烧产品即为氧化铁柱层状铌钼酸(简记为Fe2O3-HNbMoO6)和氧化铁柱层状钽钼酸(简记为Fe2O3-HTaMoO6).
1.3 表征
粉末XRD实验在PANalytical X′Pert PRO型多晶粉末X射线衍射仪上进行,采用Cu靶,CuKa辐射,管电压和电流分别为40 kV和40 mA.波数范围在400~4 000 cm-1的红外光谱在Nicolet 380型傅里叶变换红外光谱仪上测试得到,采用KBr压片技术.BET比表面积测定在NOVA 1 000e型吸附仪上进行,测试前先将样品在573 K原位抽脱活化2 h,以除去样品表面吸附的气体.漫反射紫外-可见(DR UV-Vis)光谱在Cary 5 000系列UV-Vis-NIR光谱仪上测定,测试时以BaSO4做参比,测试范围为800~200 nm.样品的表面形貌观测和SEM电镜照片拍摄在HIACHI TM-1 000型扫描电镜仪上进行,试验时将测试样品锚固在导电胶带上.
2 结果与讨论
2.1 铌钼酸锂和水合铌钼酸及钽钼酸锂和水合钽钼酸的结构
图1展示出LiNbMoO6和HNbMoO6·xH2O的XRD结果,LiNbMoO6的XRD图谱(图1a)与文献[1]的结果一致.根据Bragg衍射方程n=2dsinθ和LiNbMoO6的(001)晶面衍射峰位的2θ(2θ=9.20°)值,可求得层间距d001为0.96 nm.扣除层间Li+离子的直径0.15 nm,可知在层状化合物LiNbMoO6中,其层板NbMoO6-的厚度为0.81 nm.层状LiNbMoO6与HNO3溶液混合后,其层间的Li+与HNO3溶液中的质子发生交换,形成层状铌钼酸,其XRD结果如图1b所示.在进行离子交换的同时,水分子很容易吸附并嵌入到层板之间,因此所获得的交换产物常以水合形式存在.水合层状铌钼酸的化学式可表示为HNbMoO6·xH2O,其基本层间距d002为1.38 nm(2θ=6.40°),比LiNbMoO6的基本层间距d001增大了0.42 nm(d001=1.38~0.96 nm),这显然是由吸附在层间的H2O分子所致.

图1 LiNbMoO6(a)和HNbMoO6·xH2O(b)的XRD图Fig.1 XRD patterns of LiNbMoO6(a)and HNbMoO6·xH2O(b)
LiTaMoO6和HTaMoO6·yH2O的XRD结果在文献[4]中已有报道.LiTaMoO6的(001)面基本层间距d001为0.95 nm,扣除Li+直径0.15 nm后,在层状化合物LiTaMoO6中,其层板厚度为0.80 nm,与LiNbMoO6的层板厚度几乎一致.HTaMoO6·yH2O的(002)面基本层间距d002为1.36 nm,与水合层状铌钼酸HNbMoO6·xH2O的d002相差不大.
2.2 氧化铁柱层状铌钼酸和钽钼酸的合成及结构
层状铌钼酸锂LiNbMoO6和钽钼酸锂LiTaMoO6以及水合层状铌钼酸HNbMoO6·xH2O和钽钼酸HTaMoO6·yH2O都不能够直接与大体积的Fe(Ⅲ)多聚体阳离子发生交换反应,将Fe(Ⅲ)多聚体阳离子嵌入到这些层状化合物的层间.然而,有机烷胺可通过酸碱反应机制进入层状HNbMoO6·xH2O和HTaMoO6·yH2O的层间,形成有机铵离子预支撑的层状铌钼酸盐和钽钼酸盐,这种预支撑显著地扩大了层状化合物的层间距,有利于大体积多聚阳离子在层间的插入和交换.图2展示了正丙胺预支撑的层状铌钼酸盐(C3-HNbMoO6)及其与含Fe(Ⅲ)多聚阳离子的柱化液进行交换反应后所得插层产物(Fe(Ⅲ)-HNbMoO6)以及该插层产物在高温条件下焙烧所得产品的XRD结果.图3展示出对应样品的傅里叶变换红外光谱(FT-IR)结果.从图1和图2可以看出,HNbMoO6·xH2O与正丙胺发生反应后,由于正丙胺的嵌入,代表其层状结构的(002)面特征衍射峰向低的2θ方向位移,同时衍射峰强度增加,表明正丙胺预支撑的层状铌钼酸盐(C3-HNbMoO6)具有有序的插层层状结构.其层间距d002由原来的1.38 nm增大至1.78 nm,扣除层板厚度0.81 nm后,则正丙铵离子在铌钼酸层间充当柱子的高度为0.97 nm(d002=1.78~0.81 nm),由于正丙胺的链长为0.53 nm[10],则C3-HNbMoO6层间应当有两层正丙胺分子支撑.其中,正丙胺分子中亲水性的基头-NH2与H+结合形成-NH3+,而疏水性的碳链则集中在层板中间,形成了类似于双分子膜的结构[4,11],正丙胺链与层板之间的夹角可由sin-1[0.97/(2×0.53)]计算得出,为66.2°.C3-HNbMoO6与含Fe(Ⅲ)多聚阳离子的柱化液发生反应后,(002)面特征衍射峰的强度显著降低,层间距d002由1.78 nm(图2a)减小至1.54 nm(图2b),该插层产物(Fe(Ⅲ)-HNbMoO6)在673 K的空气环境中焙烧后,层间距d002进一步减小至1.20 nm(图2c),衍射峰强度也进一步减弱.在插层产物Fe(Ⅲ)-HNbMoO6的红外光谱图(图3b)上,除主体层板骨架和羟基以及表面吸附的水分子的红外吸收峰外,并未出现明显的代表正丙铵离子的特征吸收峰,说明此时层状铌钼酸层间的正丙铵离子已被完全交换出来,取代正丙铵离子进入铌钼酸层间的物种应当是Fe(Ⅲ)多羟基聚合阳离子[12].Fe(Ⅲ)多聚阳离子插层产物(Fe(Ⅲ)-HNbMoO6)在673 K焙烧后,层间的Fe(Ⅲ)多羟基聚合离子物种热分解脱水和脱羟基形成了Fe2O3粒子,Fe2O3在层间作为柱子支撑着层板,同时,Fe(Ⅲ)多聚阳离子热分解过程中释放出的质子转移到层板骨架的空缺上,以平衡层板的负电荷.因此,焙烧产物为氧化铁柱层状铌钼酸(简记为Fe2O3-HNbMoO6).Fe2O3粒子在层间充当柱子的高度为0.39 nm,Fe2O3-HNbMoO6的BET比表面积为52.1 m2/g.在C3-HNbMoO6的红外光谱(图3a)上,在2 800~3 000 cm-1和1 479 cm-1处出现了代表CH3和CH2的伸缩振动以及N-H(或C-H)弯曲振动模式的红外吸收峰[3,13].

图2 C3-HNbMoO6(a)、 Fe(Ⅲ)-HNbMoO6(b)和焙烧产物(c)的XRD图Fig.2 XRD patterns of C3-HNbMoO6(a),Fe(Ⅲ)-HNbMoO6(b) and its calcined product(c)
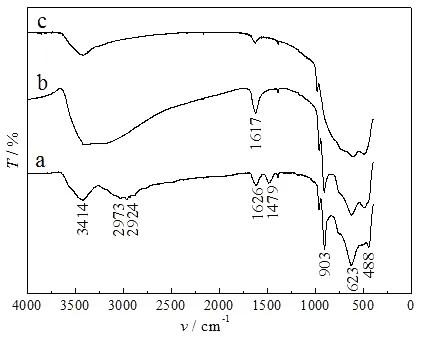
图3 C3-HNbMoO6(a)、Fe(Ⅲ)-HNbMoO6(b)和焙烧产物(c)的红外光谱Fig.3 IR spectra of C3-HNbMoO6(a),Fe(Ⅲ)-HNbMoO6(b) and its calcined product(c)
图4给出了正丙胺预支撑的钽钼酸(C3-HTaMoO6)及其与含Fe(Ⅲ)多聚体阳离子的柱化液进行插层交换反应后所得产物(Fe(Ⅲ)-HTaMoO6)以及该反应产物在673 K焙烧后所得最终产品的XRD结果.与HTaMoO6·yH2O相比,C3-HTaMoO6层间距d002由1.36 nm增大至1.77 nm(图4a),且出现了(004)衍射峰,表明其层柱结构是十分有序的.扣除层板厚度0.80 nm后,C3-HTaMoO6的净层间距为0.97 nm,考虑到正丙胺链长为0.53 nm[10],显然与C3-HNbMoO6类似,在C3-HTaMoO6层间也是两层正丙胺分子起着支撑层板的作用,且正丙胺分子与H+形成的有机铵离子在层间的排列形式亦与在C3-HNbMoO6层间相同,具有类似于双分子膜的结构.C3-HTaMoO6与Fe(Ⅲ)多聚阳离子发生交换反应后,代表其层状结构的(002)面特征衍射峰强度大大降低,层间距d002也发生较为明显的变化,减小至1.56 nm(图4b),在相应的红外光谱图(为避免累赘,未在文中展示)上,除了Ta-O和Mo-O及羟基和表面吸附水分子的吸收峰外,未观察到代表有机铵离子和-OCOO-的特征红外吸收峰,表明进入层间的Fe(Ⅲ)多聚体阳离子中并不包含有机物种.Fe(Ⅲ)-HTaMoO6在673 K的空气环境中焙烧后,其层间距d002减小至1.07 nm(图4c),对应的衍射峰强度也进一步减弱.就如本文前面所述的,经高温焙烧后,Fe(Ⅲ)-HTaMoO6层间的Fe(Ⅲ)多聚阳离子物种经热分解脱水和脱羟基形成Fe2O3,同时释放出的质子填充到主体层板骨架的八面体空缺上,以平衡TaMoO6-层板的负电荷,即形成氧化铁柱层状钽钼酸(记为Fe2O3-HTaMoO6).Fe2O3-HTaMoO6的比表面积为18.2 m2/g,在层间起支撑作用的Fe2O3柱子的高度为0.27 nm.
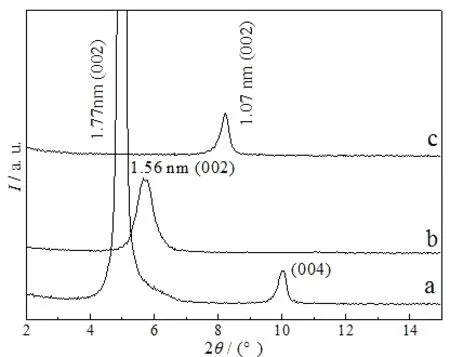
图4 C3-HTaMoO6(a)、Fe(Ⅲ)-HTaMoO6(b)及焙烧产物(c)的XRD图Fig.4 XRD patterns of C3-HTaMoO6(a),Fe(Ⅲ)-HTaMoO6(b) and its calcined product(c)
2.3 氧化铁柱层状铌钼酸和钽钼酸的光吸收性质
图5和图6分别展示出Fe2O3-HNbMoO6和Fe2O3-HTaMoO6的紫外-可见漫反射(DR UV-Vis)光谱以及它们对应的(ahv)0.5与光子能量hv之间的关系曲线.为便于比较,HNbMoO6·xH2O和HTaMoO6·yH2O对应的DR UV-Vis谱图及(ahv)0.5与hv的关系曲线亦分别示于图5和图6中.通过对(ahv)0.5与hv关系曲线的线性部分作切线并延长至与横轴相交,交点处的hv值即为禁带宽度Eg.由图可见,HNbMoO6·xH2O的吸收边对应的波长为494 nm,带隙能Eg为2.51 eV;HTaMoO6·yH2O的吸收边对应的波长为486 nm,带隙能Eg为2.55 eV;而Fe2O3-HNbMoO6的吸收边波长为653 nm,带隙能Eg为1.90 eV,Fe2O3-HTaMoO6的吸收边波长为642 nm,带隙能Eg为1.93 eV.可见,经Fe2O3柱撑后,铌钼酸和钽钼酸的吸收边均向可见光区发生较大幅度的位移,在可见光区显示较强的吸收.相较于HNbMoO6·xH2O和HTaMoO6·yH2O来说,两种Fe2O3柱撑的层状产品的紫外-可见漫反射图谱上吸收边的大幅红移,均可归因于HNbMoO6和HTaMoO6.层状主体与层间起支撑作用的Fe2O3客体之间所具有的较强协同作用,以及主客体间的电子耦合所导致的接触面布里渊区能带变小[4,14].
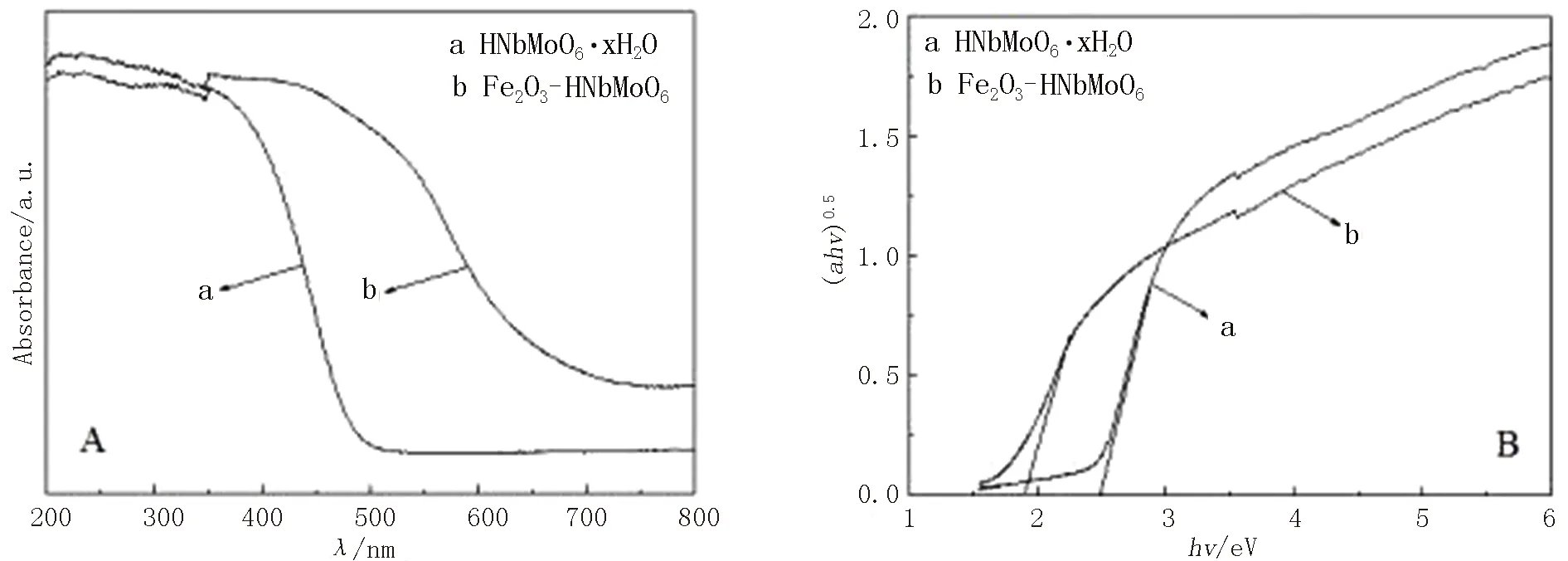
图5 Fe2O3-HNbMoO6的紫外-可见漫反射光谱(A) 及(ahv)0.5与hv关系曲线(B)Fig.5 DR UV-Vis spectra(A) and plots of (ahv)0.5 versus hv (B)
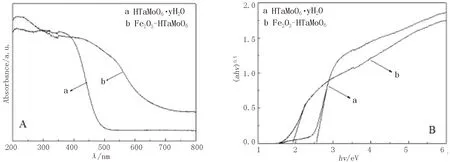
图6 Fe2O3-HTaMoO6的紫外-可见漫反射光谱(A) 及(ahv)0.5与hv关系曲线(B)Fig.6 DR UV-Vis spectra (A) and plots of (ahv)0.5 versus hv (B)
在本研究中,Fe2O3柱层状HNbMoO6(Fe2O3-HNbMoO6)和Fe2O3柱层状HTaMoO6(Fe2O3-HTaMoO6)都是采用逐步离子交换途径制得.两个层柱产品的层板元素有差异,但层间起柱撑作用的过渡金属氧化物相同,均为Fe2O3.由于构成层板的元素不同,导致两个层柱产品在层间距上有一定差异,且在BET比表面积上有较大差异.Fe2O3-HNbMoO6和Fe2O3-HTaMoO6的层间距分别为1.20 nm和1.07 nm,相应的层间柱高为0.39 nm和0.27 nm,二者的BET比表面积为52.1 m2/g和18.2 m2/g.曾用逐步离子交换方式制得TiO2柱层状HTaMoO6(TiO2-HTaMoO6),并表征了其结构及光吸收性质[4].本文中的Fe2O3-HTaMoO6与前文中的TiO2-HTaMoO6相比,两者的层板相同,层间柱子不同.Fe2O3-HTaMoO6和TiO2-HTaMoO6的层间距均较小,分别为1.07 nm和1.12 nm,两者的BET比表面积也都比较小,分别为18.2 m2/g和11.4 m2/g,说明以HTaMoO6为层板制得的层柱产品,其层间形成的过渡金属氧化物(TiO2和Fe2O3)粒子的大小受到抑制,且层柱产品的孔隙较少.再与本文中Fe2O3-HNbMoO6的层间距(1.20 nm)和比表面(52.1 m2/g)比较后,显而易知层柱产品TiO2-HTaMoO6和Fe2O3-HTaMoO6的孔结构和层间柱高主要受控于其层板HTaMoO6.然而,TiO2-HTaMoO6和Fe2O3-HTaMoO6在光吸收性质上的差异则主要由层间柱子不同所致.TiO2是一种具有较高带隙能的半导体,其吸收带主要位于紫外光区,吸收边波长大约为506 nm[15],而TiO2-HTaMoO6的吸收边波长为515 nm[4],两者比较接近,但与HTaMoO6·yH2O的吸收边波长(486 nm)有一定差异;当在层状HTaMoO6的层间引入Fe2O3进行柱撑形成Fe2O3-HTaMoO6后,其吸收边发生大幅红移,达到642 nm,且与Fe2O3柱撑的HNbMoO6产品的吸收边波长653 nm接近.这些结果同时也表明,当层间柱子均为Fe2O3而层板分别为HNbMoO6和HTaMoO6时,其光吸收性质未发生显著改变.Fe2O3-HNbMoO6与Fe2O3-HTaMoO6在光吸收性质方面的差异,主要源于两者在层间柱子高度及BET比表面积上差异.在层间距和层间柱子高度方面,Fe2O3-HNbMoO6比Fe2O3-HTaMoO6有优势,Fe2O3-HNbMoO6的比表面积也比Fe2O3-HTaMoO6大,导致Fe2O3-HNbMoO6层间的Fe2O3柱子与层状主体之间的协同作用比Fe2O3-HTaMoO6更强,因而Fe2O3-HNbMoO6的吸收边红移幅度大于Fe2O3-HTaMoO6,相应地Fe2O3-HNbMoO6的带隙能Eg(1.90 eV)也低于Fe2O3-HTaMoO6(1.93 eV).可以预见,Fe2O3-HNbMoO6在可见光下的催化性能优于Fe2O3-HTaMoO6.
2.4 氧化铁柱层状铌钼酸和钽钼酸的表面形貌
图7展示出Fe(Ⅲ)多聚阳离子插层的层状铌钼酸和层状钽钼酸(Fe(Ⅲ)-HNbMoO6和Fe(Ⅲ)-HTaMoO6)以及它们在673 K焙烧后所得的氧化铁柱层状铌钼酸和钽钼酸(Fe2O3-HNbMoO6和Fe2O3-HTaMoO6)的扫描电镜(SEM)照片.由图可见,无论是Fe(Ⅲ)多聚阳离子插层产物还是对应的焙烧产品,其粒子均呈现典型的板状特征,而且焙烧前和焙烧后样品的表面形貌及粒子大小并没有显著差异.

(a)Fe(Ⅲ)-HNbMoO6 (b) Fe(Ⅲ)-HTaMoO6 (c) Fe2O3-HNbMoO6 (d) Fe2O3-HTaMoO6图7层状样品的SEM图Fig.7 SEM morphologies of layered samples
3 结语
采用逐步离子交换方式,成功制得氧化铁柱层状铌钼酸和钽钼酸(Fe2O3-HNbMoO6和Fe2O3-HTaMoO6).与未经柱撑的铌钼酸和钽钼酸相比,氧化铁柱层状产品具有良好的热稳定性,较大的比表面积和较小的带隙能,其漫反射紫外-可见光谱的吸收边在可见光区发生大幅红移.Fe2O3-HNbMoO6与Fe2O3-HTaMoO6相比较,在层间距和层间柱高方面,前者比后者有优势,前者的比表面积也显著大于后者,从而导致Fe2O3-HNbMoO6层间的Fe2O3柱子与层状主体之间的协同作用比Fe2O3-HTaMoO6更强.Fe2O3-HNbMoO6和Fe2O3-HTaMoO6有望在可见光催化领域获得较好的应用.
