混合性肝细胞肝癌和神经内分泌癌5例临床病理分析
2020-09-19汪星星侯英勇
汪星星,于 娟,袁 伟,徐 晨,侯 君,纪 元,侯英勇
肝脏是肝外神经内分泌肿瘤最易发生转移的部位,原发性肝脏神经内分泌肿瘤少见。神经内分泌瘤占肝脏原发肿瘤的0.4%,神经内分泌癌(neuroendocrine carcinoma, NEC)或者混合性神经内分泌肿瘤占肝脏原发肿瘤的0.5%[1]。混合性肝细胞肝癌和神经内分泌癌(mixed hepatocellular carcinoma and neuroendocrine carcinoma, mHNEC)形态学上包括肝细胞肝癌(hepatocellular carcinoma, HCC)和NEC两种成分,两种成分的任何一种至少占30%。这两种成分可以碰撞,也可以混合穿插生长[2]。本文回顾性分析5例原发性mHNEC的临床病理学及免疫表型特征、诊断及鉴别诊断等,并复习相关文献,旨在提高这种罕见恶性肿瘤的认识水平。
1 材料与方法
1.1 材料收集2011~2019年复旦大学附属中山医院诊治的5例mHNEC,均有完整的临床病理资料,包括患者性别、年龄、临床症状、病史、术前血清AFP水平、治疗方案;肿瘤发生部位、病灶数目、肿瘤大小、镜下形态特征、免疫组化结果、淋巴结转移状态及转移成分、周围肝组织有无硬化等。查阅病历系统及电话随访患者生存状态及生存时间。
1.2 方法手术切除标本均经10%中性福尔马林充分固定,常规脱水,石蜡包埋,4 μm厚切片,HE染色。免疫组化检测采用EnVision两步法。一抗Syn、CgA、CK7均购自DAKO公司,CD56购自Leica公司,Arginase-1(Arg-1)购自Abcam公司,Hep Par1、CK19购自长岛生物公司,Glypican-3(GPC3)购自基因科技公司。二抗购自北京中杉金桥公司,PBS代替一抗作为阴性对照。
2 结果
2.1 临床特征5例患者均为男性,年龄范围25~78岁,平均年龄和中位年龄分别为59岁和65岁。3例因饱胀不适、食欲下降、腹痛腹胀就诊,2例无明显症状仅于体检发现。4例有乙肝病史,3例血清AFP升高,其中2例升高显著(>200 ng/mL,正常值<20 ng/mL)。5例均无其他部位神经内分泌肿瘤病史,术前MRI诊断为肝脏恶性肿瘤,均行部分肝(特殊肝段)切除术。4例术后予以辅助治疗:1例辅以TACE、铂类为基础的化疗,1例采用局部放疗,1例采用TACE、铂类为基础的化疗及免疫治疗,1例仅采用免疫治疗。4例获得完整随访资料,随访时间1~49个月,2例存活,2例死亡(其中1例为术后未予辅助治疗者)(表1)。
2.2 病理检查眼观:肿瘤多位于肝右叶(图1),3例单灶,2例呈两灶发生。肿瘤最大径2~18 cm,平均7.1 cm。HCC成分切面灰黄色、质软;NEC成分切面灰白色、质中,可伴坏死或出血,界限清楚。镜检:5例均由HCC和NEC两种成分组成。1例两种成分呈碰撞生长,其间有纤维分隔(图2);4例呈混合穿插生长(图3),其中1例可见HCC和NEC相互连续移行(图4)。HCC分化中等,呈细梁及粗梁状生长,细胞胞质丰富,核圆形,核仁明显。神经内分泌肿瘤成分均为NEC,可见坏死,细胞显著异型,核圆形或卵圆形,核质比高,核分裂象易见。1例为小细胞NEC(图5),4例为大细胞NEC(图6)。3例周围肝组织可见肝硬化(表2)。免疫表型:mHNEC中HCC成分4例Hep Par1阳性(图7)、Arg-1阳性,2例GPC3阳性,CD56、Syn、CgA均阴性;NEC成分5例CD56、Syn强阳性,4例CgA阳性(图8),Hep Par1、Arg-1和GPC3均阴性。Ki-67增殖指数在NEC成分中显著高于HCC成分,NEC成分Ki-67增殖指数约70%,HCC成分Ki-67增殖指数10%~20%。
2.3 病理诊断5例均为mHNEC。
3 讨论
消化道是神经内分泌肿瘤的好发部位,肝脏是神经内分泌肿瘤最常见的转移部位。肝脏原发神经内分泌肿瘤少见,mHNEC更为少见[1],且多为个案报道。

表1 5例mHNEC的临床资料
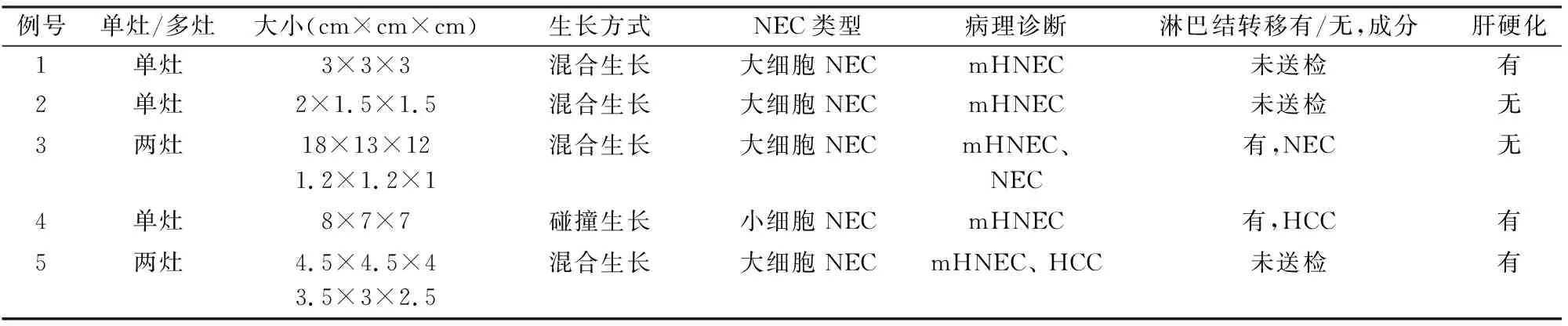
表2 5例mHNEC的病理资料

①②③④⑤⑥⑦⑧图1 HCC(红箭头)切面灰黄色,质软,NEC(黑箭头)切面灰白色,质中 图2 HCC(红箭头)和NEC(黑箭头)两种成分碰撞生长 图3 HCC(红箭头)和NEC(黑箭头)两种成分混合交叉生长 图4 HCC(红箭头)和NEC(黑箭头)两种成分连续移行生长 图5 小细胞NEC成分图6 大细胞NEC成分 图7 HCC成分Hep Par1阳性,EnVision两步法 图8 NEC成分CgA阳性,EnVision两步法
MRI检测是肝脏HCC有价值的诊断方法。T1WI为低信号为主,T2WI为略高信号为主,动态增强扫描动脉期见明显不均匀强化,门脉期进一步强化,延迟期强化程度降低,呈相对低信号,后期可见环形包膜强化。本组5例mHNEC的MRI表现与HCC未见明显差异,影像学诊断为肝脏恶性肿瘤。因此,确诊有赖于病理特征及免疫组化检测。
原发性mHNEC是指排除其他部位神经内分泌肿瘤转移、原发于肝脏的同时具有HCC和NEC两种组织学形态的恶性肿瘤,通常包括两种概念:(1)两种成分相互混杂,难以明确划分两者界限;(2)两者相互碰撞,同时发生且独立共存于同一肿瘤中。实际工作中,明确鉴别两者有时较为困难[2],因此广义上可包含上述两种情况。自1984年Barsky等[3]首次报道以来,迄今共有24篇文献报道28例mHNEC[2-11],其中26例男性和2例女性(男 ∶女=13 ∶1),年龄范围43~77岁,中位年龄为68岁。19例记载了临床病史资料,其中9例(9/19,47.4%)出现了间歇性上腹部或右上腹疼痛,其中伴有黄疸、背痛、寒战及体重减轻各1例。9例(9/19,47.4%)患有乙肝病史,13例患有丙型肝炎。22例患者术前检测血清AFP水平,17例(17/22,约77%)明显升高,4例检测血清NSE水平,均显示升高。22例(22/28,约79%)为单灶发生,6例(6/28,约21%)有2处病灶。肿瘤直径1.8~25 cm,平均5.2 cm。25例(25/28,约89%)患者行手术切除,部分病例辅以铂类为基础的化疗。共22例患者获得随访资料,随访时间0.5~28个月,其中13例(13/22,59%)死亡,1年和2年生存率分别为42%和25%[2]。本组5例均为男性,年龄范围26~78岁,中位年龄65岁。3例(3/5,60%)因出现腹部胀痛、消化系统等症状就诊,2例于体检发现。4例(4/5,80%)有乙肝病史,其中1例系母婴垂直传播。4例(4/5,80%)血清AFP升高。3例为单灶发生,2例可见两灶发生。肿瘤直径2~18 cm(平均7.1 cm)。所有病例均行手术切除术,4例术后辅以综合治疗。4例随访时间1~49个月,其中2例(2/4,50%)死亡。这些结果与文献报道大致相仿。
组织形态学上,本组5例mHNEC,HCC成分分化中等,呈典型的细梁或粗梁状排列,神经内分泌肿瘤成分均为NEC,可见坏死,细胞核质比增高,核分裂象易见,这与文献报道的神经内分泌肿瘤成分多为高级别NEC的结果较一致[11]。免疫表型上,4例HCC成分表达Hep Par1、Arg-1;1例不表达Hep Par1和Arg-1,但表达GPC3;均不表达CD56、Syn和CgA。NEC成分均强表达Syn、CD56,4例表达CgA;上皮表达少,仅有2例上皮标记CK19灶性区阳性。原发肝脏混合性肿瘤中最常见的是混合性肝细胞肝癌-胆管细胞癌,采用神经内分泌标记及CK7、CK19可资鉴别。mHNEC的两种肿瘤成分均可发生转移,本组5例mHNEC中2例淋巴结转移,1例转移成分是HCC,1例转移成分是NEC。
当仅以NEC成分为转移灶,且病理形态、免疫表型及分子遗传学检测与其他圆形细胞肿瘤存在交叉时,则诊断较为困难。文献报道1例以NEC成分为转移灶的mHNEC,原发灶mHNEC的两种肿瘤成分与转移灶的NEC均存在EWSR1基因易位[12],该患者有乙肝病史,因突发下肢无力麻木1天、腹部疼痛3天就诊。脊柱MRI示胸8椎体转移性肿瘤,后续腹部CT检测示肝脏Ⅷ段有一巨大肿块。该患者先行椎体肿瘤穿刺,镜下显示中等大小的圆形肿瘤细胞呈巢片状排列,染色质颗粒状,核仁不易见,免疫组化标记Syn、CgA弥漫强阳性,上皮标记CKpan、CAM5.2和CK7均阴性,CD99呈核旁点状阳性。为排除原始神经外胚层肿瘤可能性,椎体肿瘤穿刺标本行EWSR1基因FISH检测,结果显示EWSR1基因异位。肝脏肿瘤穿刺活检标本基于形态学及免疫组化检测诊断为mHNEC。鉴于椎体穿刺标本发现有EWSR1基因异位,对肝脏的HCC和NEC成分均进行了EWSR1基因FISH检测。结果同样显示两种成分均存在EWSR1基因异位,且是mHNEC中的NEC成分发生了转移。因此,临床病理诊断仍需要充分结合临床及影像学检查、病理形态学及分子检测。
肝脏原发性神经内分泌肿瘤的组织学起源尚不清楚,有很多假说。可能来源于肝内异位胰腺或者肾上腺;或者来源于肝内胆管上皮,因为在胚胎发育过程中胆管上皮间有散在的神经内分泌细胞[13];或者当在炎症或结石的刺激下可发生肠上皮或胃上皮化生,从而产生神经内分泌细胞。这些理论也可以解释肝内只有神经内分泌肿瘤或者是混合性腺神经内分泌肿瘤的组织学来源。但是关于mHNEC的起源比较公认的有两种假说[4]:一种认为HCC和NEC起源于同一种细胞系,即HCC中的前体干细胞,有研究显示形态学上HCC成分,电镜示细胞内含神经内分泌颗粒。另一种认为HCC和NEC均来源于内胚层多潜能干细胞,在肿瘤发生、发展过程中分别向HCC和NEC方向分化。子宫颈混合性腺NEC也有类似的组织学发生来源学说[14]。笔者认为存在HCC中的前体干细胞分化为NEC,因为观察到部分病例HCC和NEC间存在连续移行过渡。
目前,肝脏mHNEC的分子遗传学改变的研究较少,有研究将1例石蜡包埋组织mHNEC中HCC成分和NEC成分分别行二代测序,结果显示两种成分都有CTNNB1(3号外显子S33F位点)、PD-1、PGP和SMO基因突变,而NEC成分还单独显示PD-L1和TOP2a基因突变,HCC成分还显示CTNNB1(3号外显子T411位点)和EGFR突变,这些突变位点临床意义还不明确[6]。
肝脏mHNEC预后差,但尚未明确是HCC成分还是NEC成分决定患者的预后,有学者认为mHNEC中,NEC的Ki-67增殖指数显著高于HCC,而且淋巴结或者远处转移也通常是NEC,所以认为mHNEC的预后与NEC成分呈正相关,NEC成分越多,生存期更短,更易复发。针对mHNEC的治疗目前还是手术为主,辅以TACE和铂类为主的化疗。本组有1例在术后采用PD-1抑制剂联合小分子抗血管生成药物2个周期后,疾病进展,再次采用铂类为基础的化疗6个周期维持治疗,显示肿瘤对铂类为基础的化疗药物更加敏感。当然鉴于病例数少,还需要更多病例的积累促进诊治。另外,有研究者认为有必要采取术前新辅助化疗。但是鉴于术前穿刺肝组织诊断有时候受穿刺组织的影响,未必准确。
综上所述,mHNEC属于罕见但高度恶性的肿瘤,其临床表现、MRI表现和HCC无显著差异,确诊有赖于病理形态观察及免疫组化检测。形态上显示HCC及NEC两种组织学分化特征,一组免疫组化标记如Hep Par1、Arg-1、GPC3、AFP、Syn、CgA、CD56等联合检测有助于该肿瘤的最终确诊。目前分子遗传学方面的研究仍然较少。手术切除是最常用的治疗方式,并对辅以铂类为基础的化疗似乎更敏感。预后均较单纯的HCC及NEC差,中位总生存期为17.8个月,中位复发时间为6个月。因此,术后仍需定期随访,包括影像学检查、血清NSE和AFP水平监测[2]。
