黄芩中黄芩新素提取制备工艺优化的研究
2020-09-19黄雪雪林珠灿余丽双
黄雪雪,陈 莉,林珠灿,余丽双
黄芩中黄芩新素提取制备工艺优化的研究
黄雪雪,陈 莉,林珠灿,*余丽双
(福建中医药大学药学院,福建,福州 350122)
为建立制备大量高纯度黄芩新素的方法。比较了超声法和回流提取法提取黄芩中黄芩新素,及不同萃取溶剂对黄芩中黄芩新素得率的影响,通过HPLC色谱法测定黄芩新素的含量,并用LC-8A高压制备色谱仪制备黄芩新素。采用回流提取法及使用乙醚作为萃取溶剂时,黄芩新素得率最高,制备的黄芩新素纯度可达到97.96%。本实验建立的方法操作简便,重现性好,制备的黄芩新素纯度符合对照品纯度的要求。
黄芩;黄芩新素;HPLC
黄芩为唇形科 (Labiatae) 植物黄芩属 (Scutellaria) 多年生草本植物,以干燥根入药[1]。作为传统的药用植物,黄芩在我国已有数千年的药用历史,具有抗菌抗病毒、抗过敏、抗肿瘤、保护心血管、清热燥湿、泻火解毒等功效[2~5]。黄芩的成分众多,其主要活性成分是黄酮类,包括黄芩苷、黄芩素、汉黄芩素、汉黄芩苷等。此外,黄芩还含有萜类、氨基酸、甾醇、挥发油、多糖、微量元素等其他成分[6]。目前对黄芩有效成分的研究多集中在黄芩苷、黄芩素、汉黄芩苷、汉黄芩素等含量较高的黄酮类成分,国内外对于黄芩新素的研究较少,但是近年来有研究发现黄芩新素也有较强的药理作用。
黄芩新素(Neobaicalein或Scutellaria baicalensis flavone II)是黄芩中的重要生物活性成分之一,具有抑制细胞增殖及抗炎活性。黄芩新素在前列腺癌和白血病细胞中表现出较强的抑制活性,实验表明其在黄芩提取物中是促使白血病细胞HL-60和K562凋亡的主要活性成分[7]。黄芩新素通过下调miR-21表达,上调PP2A表达然后使PI3K / AKT / mTOR信号通路失活来对肺癌细胞发挥抗癌作用[8]。实验表明,口服黄芩的大鼠含药血清中,黄芩新素是具有HepG2结合与抑制作用的活性成分之一[9]。黄芩新素活性虽不如黄芩苷及黄芩素强,但是有研究发现黄芩新素能特异性结合在肿瘤生长和免疫抑制中起重要作用的STAT3靶蛋白[10],这为治疗癌症提供了新思路。黄芩新素具有抗炎、抗肿瘤活性,但是由于其在黄芩中含量非常少,目前对黄芩新素的提取制备没有明确系统的方法。近年来研究黄芩新素药理作用的学者越来越多,可见从黄芩中提取制备高纯度黄芩新素的工作特别重要。为制备大量高纯度黄芩新素以供后续实验使用,本研究实验通过对比提取方法及萃取溶剂,以求找到提取制备黄芩新素的最佳实验条件,通过高压制备色谱仪能简单、快速制备出大量高纯度的黄芩新素。
1 仪器与材料
1.1 实验材料
甲醇、乙醚、乙酸乙酯、石油醚、二氯甲烷(分析纯,西陇化工股份有限公司);甲醇(色谱纯,国药集团化学试剂有限公司),黄芩新素(上海源叶生物科技有限公司)黄芩药材(购自闽侯县上街致诚医药商店)。
1.2 实验仪器
戴安Ultimate 3000型高效液相色谱仪,LC-8A高压制备色谱仪(Shimadzu),KQ-500DE型超声波清洗器(昆山市超声仪器有限公司)。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent 5 HC-C18(250 mm×4.6 mm),流动相:甲醇-水(60:40),流速:1.0 mL/min,柱温:30 ℃;进样量:对照品10 μL,供试品1 μL;检测波长:270 nm[11]。
2.2 提取物的制备
2.2.1 标准品的制备
精密称取黄芩新素对照品1 mg,用甲醇配置成1 mg/mL的母液,之后再用甲醇稀释至所需浓度使用,按照“2.1”项下色谱条件进行分析。
2.2.2 药材的预处理
称取干燥的黄芩药材适量,粉碎至细粉,过40目筛后分装样品袋中,备用。
2.2.3提取方法的比较
超声法:称取黄芩粉末200.82 g,用95%的乙醇按料液比1:8 (m/v) 于圆底烧瓶中浸泡过夜。30 ℃条件下超声提取3次,提取功率400 W,每次超声30 min。纱布过滤后,将三次滤液混合后减压浓缩至浸膏状,用100 mL超纯水分散黄芩浸膏,用100 mL乙醚进行萃取,重复3次。将三次萃取溶液减压浓缩后用50 mL甲醇复溶,溶液过0.22 μm滤膜后按照“2.1”项下色谱条件进行分析。
回流提取法:称取黄芩粉末202.04 g,用95%的乙醇按料液比1:8 (m/v) 于圆底烧瓶中浸泡过夜,加热回流1 h后滤渣继续用95%的乙醇按料液比1:8 (m/v) 加热回流1 h,重复2次。纱布过滤后,合并3次提取液,减压浓缩至浸膏状。浸膏用100 mL超纯水分散黄芩浸膏,用100 mL乙醚萃取3次,合并乙醚层溶液,减压浓缩后用50 mL甲醇复溶,溶液过0.22 μm滤膜后按照“2.1”项下色谱条件进行分析。通过HPLC色谱分析黄芩新素得率[12]。
两种方法所得结果如表1所示,结果表明回流提取法的得率高于超声法,故采用回流提取法提取黄芩新素。

表1 不同提取工艺下黄芩新素得率
2.2.4 萃取溶剂的选择
将“2.2.3”项下回流提取法得到的黄芩浸膏用100 mL超纯水分散之后,分别用乙醚、乙酸乙酯、石油醚和二氯甲烷各100 mL进行萃取,重复操作3次,合并3次萃取液减压浓缩后加入50 mL甲醇复溶,溶液过0.22 μm滤膜后按照“2.1”项下色谱条件进行分析。各萃取剂对黄芩新素分离提取情况如表2及图1所示。表2中,当用二氯甲烷萃取黄芩浸膏时,黄芩新素因为未与前一个峰分离开来,故未能计算其含量。结合图1及表2可以看出,当用乙醚萃取黄芩浸膏时,HPLC测得的黄芩新素的含量最高,且分离度达到2.99,符合完全分离的要求,故选择乙醚作为制备黄芩新素的萃取溶剂。

A.黄芩新素对照品 B.二氯甲烷提取物 C.石油醚提取物 D.乙醚提取物 E.乙酸乙酯1.黄芩新素

表2 不同溶剂提取分离黄芩新素结果
2.2.5 黄芩新素的分离制备
将回流提取法得到的提取液经乙醚萃取后,再经甲醇复溶的溶液在LC-8A高压制备色谱仪上进行制备,流动相为甲醇-水(60:40),流速为5 mL/min,柱温30 ℃,检测波长为270 nm,进样量为1.2 mL。其分离制备图谱如图2所示,可以看出黄芩新素在13.5 min左右出峰,持续时间1 min左右,与黄芩新素对照品HPLC谱图基本一致,表明该制备方法可行。将收集的流分浓缩干燥后得黄色粉末状固体,即为制备后的黄芩新素。精密称定一定量的制备黄芩新素,用甲醇溶解稀释成83.3 μg/mL的溶液,按照“2.1”项下的进样条件进行HPLC分析。制备黄芩新素HPLC色谱图如图3所示。经HPLC分析其纯度为97.96%。
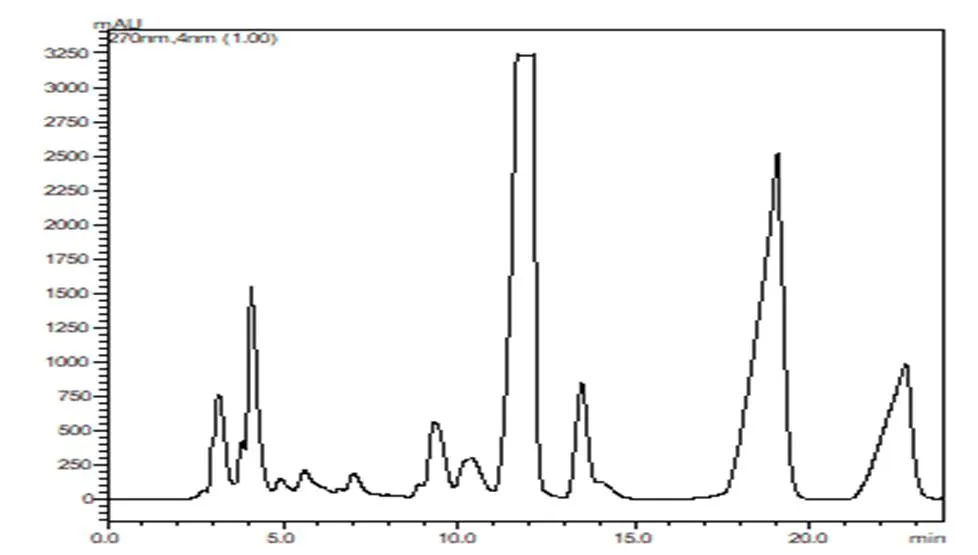
图2 制备分离黄芩新素色谱图

图3 制备后的黄芩新素HPLC色谱图
2.3 黄芩中提取分离黄芩新素工艺路线图

图4 工艺路线图
3 讨论
本实验以中药黄芩中的黄芩新素为研究对象,胡碧煌等[13]从滇黄芩中分离出一种结构式为(2S)-2´,5,6´-三羟基-7-甲氧基双氢黄酮的新型化合物,命名为黄芩新素Ⅰ,之后又分离鉴定出黄芩新素Ⅱ,为后续研究黄芩新素药理作用提供试药。本实验前期优化了黄芩新素提取方法,比较了超声波法和回流提取法对黄芩新素得率的影响。超声波提取法利用超声波辅助溶剂进行提取,破坏植物药材的细胞,使溶剂渗透到药材细胞中,从而缩短提取时间,提高提取率;回流提取法是用乙醇等易挥发的有机溶剂提取原料成分,使挥发性溶剂不断地馏出后又被冷却,重复流回浸出容器中浸提原料,直至有效成分回流提取完全的方法。两者各有其优缺点。从实验结果可以看出超声法操作简单,但回流提取法的得率更高,表明相较于超声法,回流提取法能更有效地提取黄芩新素。
鉴于黄芩新素在黄芩中含量较低,本实验采取LC-8A高压制备色谱仪进行大量提取制备。从中药复杂成分中分离出某一单一成分,传统方法多采用超离心、沉淀、萃取、超滤等分离技术[14],这些方法往往耗时且达不到所需纯度。高压制备色谱技术应用于中药复杂成分分离、提取和纯化,所得纯度基本能达到对照品要求。与传统方法相比,其效率高、馏分损失少、样品回收率高,是目前中药复杂成分分离、提取、纯化的重要手段。本实验所提取制备的黄芩新素纯度达到97.96%,符合纯度的要求。实验结果表明本法操作简便,重现性好,所得纯度高。
本实验比较了不同的提取方法、萃取溶剂对黄芩中黄芩新素提取率及分离度的影响,最后发现采用回流提取法,用乙醚作为萃取溶剂,采用甲醇-水(60:40)为流动相时黄芩新素的含量及分离度最佳。
[1] 李娟,张龙,刘继,等.黄芩黄酮的研究进展[J].畜牧与饲料科学,2018,39(05):71-73.
[2] 李津津.中药黄芩药理作用的研究进展[J].内蒙古中医药,2018,37(10):117-118.
[3] 刘彦晶,张雅洁,纪雪,等.中药黄芩对NDM-1乙酸钙不动杆菌的抑菌及质粒消除的研究[J].中国药学杂志,2017,52(12):1018-1022.
[4] 肖意川,张许,柯培雄,等.黄芩苷在心血管疾病中的药理作用研究新进展[J].广东医学,2018,39(24): 3587-3590.
[5] 曹惠敏,谌贝贝,邓钰双,等.黄芩苷增强N2a/APPswe细胞的抗氧化能力并促进核因子E2相关因子2(Nrf2)的核转位[J].细胞与分子免疫学杂志,2015, 31(12):1597-1601.
[6] 韩航.黄芩主要有效成分医药用途的专利分析[J].中国科技信息,2019(10):32-34+36.
[7] Boozari M, et al. Growth inhibition and apoptosis induction by Scutellaria pinnatifida A. Ham. on HL-60 and K562 leukemic cell lines[J]. Environ Toxicol Pharmacol, 2015, 39(1):307-12.
[8] Yang Y, An R, Feng T, et al.Skullcapflavone I suppresses proliferation of human lung cancer cells via down-regulating microRNA-21.[J].Exp Mol Pathol.2019,110:104285.
[9] Jia D, et al. On-line comprehensive two-dimensional HepG2 cell membrane chromatographic analysis system for charactering anti-hepatoma components from rat serum after oral administration of Radix scutellariae: A strategy for rapid screening active compounds in vivo[J].Pharm Biomed Anal, 2016, 118:27-33.
[10] Chen L, et al. Biosensor-based active ingredients recognition system for screening stat3 ligands from medical herbs[J]., 2018, 90(15): 8936-8945.
[11] 徐玫,袁琦,赵辉,等.HPLC等度洗脱法同时测定银黄薄膜衣片中绿原酸和黄芩苷的含量[J].中国中药杂志,2013,38(05): 691-693.
[12] 郑丽娟,刘兵,彭姣阳,等.半枝莲抗菌活性及其有效部位研究[J].井冈山大学学报:自然科学版,2018,39(04): 76-80.
[13] 胡碧煌,刘永漋,章天,等.滇黄芩中滇黄芩新素的结构研究[J].药学学报,1990(04):302-306.
[14] 刘布鸣,马彦,冯可荣,等.制备高效液相色谱分离纯化系统的研制与开发[J].广西科学院学报,2010(3): 354-356.
OPTIMIZATION OF EXTRACTION AND PREPARATION PROCESS OF NEOBAICALEIN IN
HUANG Xue-xue, CHEN Li, LIN Zhu-can,*YU Li-shuang
(College of pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou, Fujian 350122, China)
To establish a method for preparing a large amount ofhigh-purity neobaicalein.The extraction of neobaicalein fromby ultrasonic method and reflux extraction method were compared, and the effect of different extraction solvents on the yield of neobaicalein fromwas investigated. The content of neobaicalein was determined by HPLC, and neobaicalein was prepared by LC-8A high-pressure preparative chromatograph.When reflux extraction was adopted and ether were used as extraction solvent, the yield of neobaicalein was the highest , and the purity of neobaicalein was 97.96%.The method established in this experiment is easy to operate and has good reproducibility. And the purity of the prepared neobaicalein mets the requirements of the reference substance.
; neobaicalein; HPLC
R284.2
A
10.3969/j.issn.1674-8085.2020.04.017
1674-8085(2020)04-0091-04
2020-03-06;
2020-04-27
国家自然科学基金项目(81903855);福建省科技厅计划项目(2017Y0050,2018J01871)
黄雪雪(1995-),女,河南信阳人,硕士生,主要从事中药分析方法学研究(E-mail:1533628588@qq.com);
陈 莉(1980-),女,福建福州人,副教授,主要从事中药质量控制研究(E-mail:Shirley_chli@163.com);
林珠灿(1980-),男,福建莆田人,副教授,主要从事中药化学研究(E-mail:569324051@qq.com);
*余丽双(1982-),女,福建莆田人,副研究员,博士,硕士生导师,主要从事中药质量控制研究(E-mail: sly2018@126.com).
