多重TaqMan荧光定量PCR检测仔猪先天性震颤相关病毒方法的建立与应用
2020-09-10杨晓宇陈世界
杨晓宇, 陈世界, 林 华, 张 婧, 安 微, 朱 玲,3
(1.四川农业大学动物医学院,四川 成都 611130; 2.成都海关检验检疫技术中心,四川 成都 610041; 3.四川农业大学动物疫病与人类健康四川省重点实验室,四川 成都 611130)
近年来,随着中国生猪产业的快速发展,猪常见传染性疾病由过去的单一感染逐渐转变为混合感染,导致猪病的发病率和死亡率居高不下,给临床检测和防控带来了困扰,严重影响了生猪产业的健康发展。仔猪先天性震颤(Congenital tremor,CT)俗称“仔猪抖抖病”[1],目前尚无有效治疗措施,已经给养猪生产造成了巨大经济损失。其病因可能包括营养因素、遗传因素及病毒性感染因素等。目前,国内研究者已经多次报道,猪非典型瘟病毒(Atypical pestivirus,APPV)、猪瘟病毒(Classical swine fever virus,CSFV)、猪圆环病毒3型(Porcine circoviruses type 3,PCV-3)和猪捷申病毒1型(Porcine teschovirus 1,PTV-1)是引起仔猪先天性震颤的主要病原[2-5],这些病毒所致疾病在临床上均表现出猪的头部、四肢和尾部发生持续性震颤,有些患病仔猪呈“八”字腿,不能站立行走,对外界刺激较为敏感等。患病仔猪具有运动障碍、吮乳障碍等,最终因饥饿而很快衰竭致死。
目前尚无有效措施防控仔猪先天性震颤,及时确诊是哪种病毒并加以辅助治疗成为防治该病的关键。实验室现有的大多数抗原检测方法都是对某种病毒的单独检测,操作复杂,无法对引起仔猪先天性震颤的多种病毒进行同时检测。本研究拟建立针对APPV、CSFV、PCV-3、PTV-1的多重TaqMan荧光定量PCR检测方法,旨在高效、灵敏、特异性地对仔猪先天性震颤相关病毒进行区分鉴别,对于猪场防控仔猪先天性震颤相关病毒以及提高出生仔猪的成活率尤为重要,同时可为临床样本的快速筛检及规模化猪场开展仔猪先天性震颤相关病毒流行病学调查提供快速、可靠的检测方法,并可为仔猪先天性震颤相关病毒性流行病的科学防控提供技术支持。
1 材料与方法
1.1 病毒与病料
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪瘟病毒、猪非典型瘟病毒、猪圆环病毒3型、猪捷申病毒1型(PTV-1)、猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)、伪狂犬病毒(Pseudorabies virus,PRV)、猪乙型脑炎病毒(Japanese encephalitis virus,JEV)、猪轮状病毒(Rotavirus,RV)均由四川农业大学动物生物技术中心提供并保存;血清采集于四川省各市的规模化养猪场。
1.2 主要试剂
50 bp DNA Ladder购自天根生化科技(北京)有限公司,PremixExTaq(Probe qPCR)、逆转录试剂盒、DNA凝胶回收试剂盒、pMD19-T载体、质粒抽提试剂盒等均购自宝生物工程(大连)有限公司。
1.3 引物的设计及合成
根据GenBank中已经登录的病毒基因组信息,选取APPVNS3基因、CSFVE2基因、PCV-3ORF2基因和PTV-1VP1基因,用Prime Express 5.0软件对上述基因的保守序列进行分析,再设计相应的特异性引物和探针。在APPV探针5′端标记FAM荧光基团,在3′端标记MGB基团;在CSFV探针5′端标记HEX荧光基团,在3′端标记BHQ1基团;在PCV-3探针5′端标记ROX荧光基团,在3′端标记BHQ2基团;在PTV-1探针5′端标记CY5荧光基团,在3′端标记BHQ2基团。APPV/CSFV/PCV-3/PTV-1引物探针均由生工生物工程(上海)股份有限公司合成,详见表1。

表1 APPV/CSFV/PCV-3/PTV-1引物、探针序列
1.4 重组质粒标准品的制备
使用本试验设计的引物,分别以APPV、CSFV、PCV-3、PTV-1的核酸序列为模板,50 μl反应体系包括25.0 μl 2×TaqPCR Master Mix、各2.5 μl上下游引物、5.0 μl模板、ddH2O。PCR反应程序如下:95 ℃ 4 min;95 ℃ 30 s,APPV 55 ℃ 30 s、PCV-3 55 ℃ 30 s、PTV-1 58 ℃ 30 s、CSFV 60 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 7 min。使用胶回收试剂盒对得到的阳性PCR产物进行纯化、连接、转化后,提取阳性质粒。将阳性克隆菌送至生工生物工程(上海)股份有限公司测序,并对测序结果进行比对。结果表明,4种阳性重组质粒与试验预期相符。将阳性标准品于-20 ℃保存,作为后续试验的阳性模板。
1.5 多重TaqMan荧光定量PCR检测方法的建立
1.5.1 反应条件的优化 采用宝生物工程(大连)有限公司的PremixExTaq(Probe qPCR)试剂进行多重TaqMan荧光定量PCR检测,分别以方法1.4中构建的APPV质粒、CSFV质粒、PCV-3质粒和PTV-1质粒为模板,在四者单独优化的基础上,使用矩阵法对40 μl反应体系的混合引物用量、探针用量及退火延伸温度进行进一步优化,以筛选最适的反应体系和反应条件。
1.5.2 标准曲线的制作 取pMD-APPV、pMD-CSFV、pMD-PCV-3和pMD-PTV-1等4种标准质粒,分别进行10倍梯度稀释,同时设空白对照,每组3个平行重复。用优化后的多重TaqMan荧光定量PCR体系及扩增程序进行检测,最后建立标准曲线。
1.5.3 特异性试验 用本试验建立的多重TaqMan荧光定量PCR方法对APPV、CSFV、PTV-1、PCV-3、RV、PRRSV、JEV、PRV进行特异性试验,以评价该方法的特异性。
1.5.4 灵敏性试验 分别将pMD-APPV、pMD-CSFV、pMD-PCV-3和pMD-PTV-1等4种重组质粒按10倍梯度稀释,再分别选取1 μl 105~100拷贝的重组质粒作为模板,用本研究建立的多重TaqMan荧光定量PCR和常规PCR方法进行检测,确定检测下限并对2种方法的灵敏性进行分析、评价。
1.5.5 重复性试验 在相同条件下,使用已建立的多重TaqMan荧光定量PCR方法进行3次独立的组内、组间重复性试验,用变异系数(CV)来评价方法的重复性。
1.6 临床样品检测
采集来自四川省部分地区规模化猪场的全身震颤的疑似患病仔猪样品(组织器官、血清、精液)273份,用本试验建立的多重TaqMan荧光定量PCR方法进行检测,分析相关病毒的共感染情况。
2 结果与分析
2.1 多重TaqMan荧光定量PCR方法的建立
将设计并合成好的4对引物和探针分别稀释至10 μmol/L的工作浓度,使用矩阵法调节引物用量(0.5 μl、1.0 μl、1.5 μl)、探针用量(0.10 μl、0.25 μl、0.50 μl、1.00 μl)和退火温度(52.0 ℃、52.7 ℃、54.0 ℃、55.9 ℃、58.4 ℃、60.3 ℃、61.4 ℃和 62.0 ℃)对四重荧光逆转录(RT) PCR反应条件进行优化。最终确定的40.00 μl四重荧光RT-PCR反应体系如下:20 μl PremixExTaq(Probe qPCR),各1.00 μl 4对上、下游引物,CSFV、PTV-1、PCV-3、APPV探针用量分别为0.50 μl、0.50 μl、0.25 μl、0.25 μl,各1.00 μl 4种标准质粒模板,其余用去离子水补足。得出四重荧光RT-PCR的最佳反应条件:95 ℃ 5 min;95 ℃ 30 s、56 ℃ 30 s,40 个循环,退火阶段收集荧光信号。
2.2 标准曲线的绘制
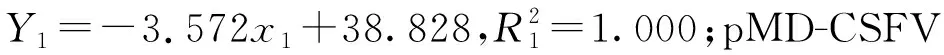
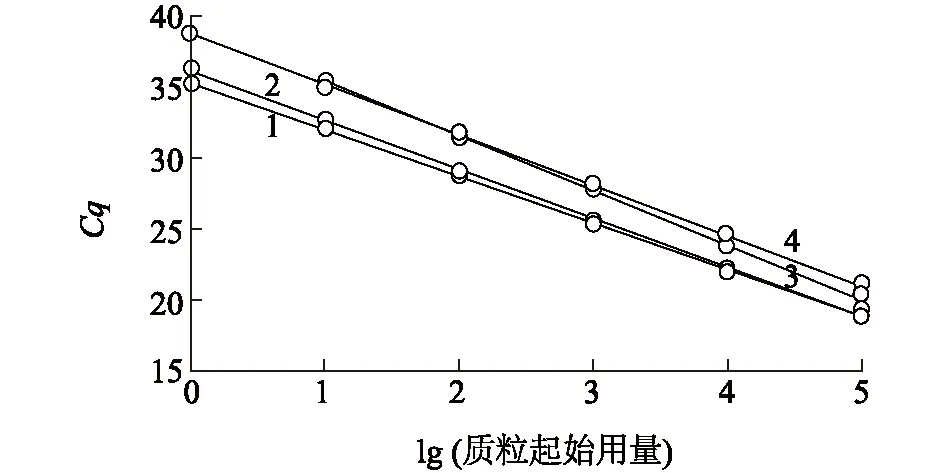
1:pMD-CSFV(猪瘟病毒质粒),2:pMD-PCV-3(猪圆环病毒3型质粒),3:pMD-PTV-1(猪捷申病毒1型质粒),4:pMD-APPV(猪非典型瘟病毒质粒)。Cq表示在PCR扩增过程中,样品扩增荧光信号达到设定阈值时所经历的扩增循环数。图1 多重TaqMan荧光定量PCR标准曲线Fig.1 Standard curve of multiple TaqMan fluorescence quantitative PCR
2.3 特异性
应用本研究建立的多重TaqMan荧光定量PCR方法对 APPV、CSFV、PTV-1、PCV-3、RV、PRRSV、JEV、PRV的基因组进行检测,结果显示,仅APPV、CSFV、PTV-1、PCV-3出现典型的扩增曲线,而其他病毒的基因组均未出现扩增曲线(图2),表明该方法具有良好的特异性。

1:PCV-3(猪圆环病毒3型);2:CSFV(猪瘟病毒);3:APPV(猪非典型瘟病毒);4:PTV-1(猪捷申病毒1型);5:RV(猪轮状病毒);6:PRRSV(猪繁殖与呼吸综合征病毒);7:JEV(猪乙型脑炎病毒);8:PRV(伪狂犬病毒)。图2 特异性试验结果Fig.2 Results of the specificity assay
2.4 灵敏性
采用本研究已经建立的检测方法对质粒含量为1 μl 100~105拷贝的阳性模板进行PCR扩增。如图3、图4所示,多重TaqMan荧光定量PCR方法对CSFV、APPV、PTV-1、PCV-3的最低检测限依次为1 μl 48拷贝、9.2×102拷贝、17拷贝、56拷贝;常规PCR方法对CSFV、APPV、PTV-1、PCV-3的最低检测限依次为1 μl 4.8×103拷贝、9.2×104拷贝、1.7×103拷贝、5.6×104拷贝。对结果进行分析发现,在对APPV、CSFV和PTV-1的检测中,多重TaqMan荧光定量PCR的最低检测限相较于常规PCR提高了100倍,而对PCV-3的最低检测限相较于常规PCR更是提高了1 000倍,表明本研究所建立的多重TaqMan荧光定量PCR检测方法比常规PCR方法更加灵敏。

A:PCV-3(猪圆环病毒3型);B:PTV-1(猪捷申病毒1型);C:CSFV(猪瘟病毒);D:APPV(猪非典型瘟病毒);1~5:1 μl 105~101拷贝标准模板的多重TaqMan荧光定量PCR扩增曲线。图3 多重TaqMan荧光定量PCR灵敏性试验结果Fig.3 Results of sensitivity test by multiple TaqMan fluorescence quantitative PCR

A:PCV-3(猪圆环病毒3型);B:PTV-1(猪捷申病毒1型);C:CSFV(猪瘟病毒);D:APPV(猪非典型瘟病毒);1~6:1 μl 105~100拷贝标准模板的常规PCR扩增结果。图4 常规PCR灵敏性试验结果Fig.4 Results of sensitivity test by common PCR
2.5 重复性
分别选取5个含量的pMD-APPV、pMD-CSFV、pMD-PCV-3和pMD-PTV-1标准质粒为模板,进行组内和组间重复试验。表2结果显示,APPV、CSFV的组内重复试验变异系数均小于1.50%;PCV-3、PTV-1的组内重复试验变异系数均小于2.10%;APPV、CSFV的组间重复试验变异系数均小于1.00%;PCV-3、PTV-1的组间重复试验变异系数均小于1.60%。
2.6 临床样品检测
应用本研究建立的多重TaqMan荧光定量PCR方法对采集的疑似患病仔猪的组织器官、血清、精液等临床样品进行检测。结果显示,APPV的检出率为20.5%(56/273),CSFV的检出率为2.9%(8/273),PCV-3的检出率为10.6%(29/273),PTV-1的检出率为1.5%(4/273)。其中APPV、CSFV二者共同感染的检出率为1.5%(4/273),APPV、PCV-3二者共同感染的检出率为4.4%(12/273),APPV、PTV-1二者共同感染的检出率为1.5%(4/273),APPV、CSFV、PCV-3共同感染的检出率为1.1%(3/273)。临床检测结果显示,APPV和PCV-3的单独感染尤为严重,混合感染类型复杂,给相关疾病的防控带来困难,因此建立高效、灵敏的多重检测方法尤为重要。
3 讨 论
本试验建立的多重TaqMan荧光定量PCR检测方法对CSFV、APPV、PTV-1、PCV-3的最低检测限分别为1 μl 48拷贝、9.2×102拷贝、17拷贝、56拷贝,常规PCR方法检测CSFV、APPV、PTV-1、PCV-3的最低检测限分别为1 μl 4.8×103拷贝、9.2×104拷贝、1.7×103拷贝、5.6×104拷贝,其中APPV、CSFV、PTV-1的最低检测限均比常规PCR方法提高了100倍,PCV-3的最低检测限比常规PCR方法提高了1 000倍。本试验对采集样品进行检测的结果显示,APPV、CSFV、PTV-1、PCV-3的检测阳性率分别为20.5%、2.9%、1.5%、10.6%,其中APPV、CSFV共同感染的检出率为1.5%,APPV、PCV-3共同感染的检出率为4.4%,APPV、PTV-1共同感染的检出率为1.5%,APPV、CSFV、PCV-3共同感染的检出率为1.1%。本研究建立的多重TaqMan荧光定量PCR检测方法具有良好的灵敏性、特异性和重复性。

表2 重复性试验结果
自从1962年赵文远等[6]在中国首次发现仔猪先天性震颤以来,国内外的兽医工作者进行了长时间的研究,但一直无法找到发病的原因。1998年陆文俊等[7]、2005年罗建等[2]分别使用动物接种试验和免疫荧光染色等方法发现仔猪先天性震颤病例的猪场中存在猪瘟病毒。2005年Hause等[3]研究证实,APPV可能是仔猪先天性震颤的病原。 随后,全球多个国家先后在农场中检测并发现猪群中有APPV的流行[8-11]。2016-2017年,Chen等[4]使用荧光定量PCR方法对中国广西、广东2省患仔猪先天性震颤的猪群进行长时间监测,结果发现,仔猪先天性震颤与PCV-3感染可能存在联系,受仔猪先天性震颤影响仔猪的PCV-3组织嗜性分析结果显示,PCV-3主要侵害患病动物的脑、心脏,两者的病毒载量较高。2018年,Possatti等[5]使用巢式PCR方法首次发现APPV与PTV混合感染,共同影响新生仔猪,并且二者起到协同作用。仔猪先天性震颤的发病率为1.8%~35.0%,在没有喝初乳的条件下,患病仔猪的死亡率达到100.0%。由于尚无有效的治疗措施,因而及时确定病原并加以辅助治疗成为防治该病的关键。目前大多数检测方法都为单重检测,操作复杂,无法对仔猪先天性震颤相关病毒进行同时检测。本研究建立的多重TaqMan荧光定量PCR检测方法,可以高效、灵敏、特异地对仔猪先天性震颤相关病毒进行区分、鉴别,对于猪场防控仔猪先天性震颤以及提高出生仔猪的成活率尤为重要。基于该方法对四川地区仔猪先天性震颤相关病毒共感染情况进行流行病学调查,可以为该病的防治提供重要的数据基础。
4 结 论
本研究成功建立了灵敏性高、特异性强、耗时短的检测仔猪先天性震颤相关病毒的多重TaqMan荧光定量PCR方法,实现了对仔猪先天性震颤相关病毒的快速、准确鉴别与诊断。
