光和温度对两种绿潮藻光合途径及抗氧化功能的影响
2020-09-04马茜王玉珏孙西艳刘东艳
马茜,王玉珏,孙西艳,刘东艳*
( 1. 华东师范大学 河口海岸学国家重点实验室,上海 200241;2. 中国科学院牟平海岸带环境综合试验站,山东 烟台264003)
1 引言
绿潮是指潮间带大型绿藻在特定环境条件下大量增殖,形成的高生物量生态灾害[1-2]。该现象多发生在富营养化的潮间带区域,以石莼属(Ulva)物种为主,如:以肠浒苔(Ulva intestinalis)为原因种的绿潮在世界多个海域的潮间带都有过报道[1-5]。个别绿潮物种能够脱离固着基,进入海域漂浮生长,并形成大规模高生物量灾害,给社会经济造成巨大损失,如:我国黄海浒苔(Ulva prolifera)绿潮的暴发[6-7]。绿潮的暴发不仅受到温度、营养盐等多个环境因素的诱导,而且与自身的繁殖能力、生理生化功能密切相关,其中,高效的光合速率与营养盐吸收能力往往是物种在短时间内大量增殖的重要生物学基础[8-9]。
多数藻类植物的光合作用以卡尔文循环(C3)为主[10-11],利用CO2合成有机碳。然而,Hatch-Slack 光合途径(C4)或者类似C4途径参与的藻类光合作用在20 世纪70 年代已有报道,例如,硅藻门中的三角褐指藻(Phaeodactylum tricornutum)和威氏海链藻(Thalassiosira weissflogii),以及褐藻门中的四叠团扇藻(Padina tetrastromatica),均可以利用,将其固定在C4双羧酸中,经过一系列反应转化成CO2进入C3途径,形成固碳效应[12-14]。近年来的研究发现,在有些绿潮物种的光合固碳中,可能也存在C4或者类似C4途径的参与过程,并成为提高其光合效率、快速增殖的重要生理生化机制[15],如:黄海浒苔中就存在与C4途径相关的基因以及光合产物[15-16]。一般来说,C4植物的光合效率能高于C3植物的50%[17],其最大的日生长率是C3植物的2~8 倍[18-20]。因此,有必要对绿潮物种是否存在C4途径以及在固碳中的重要性做进一步探讨,这对于理解其生态灾害暴发的生物学机制具有重要意义。
C3和C4植物对环境的适应能力不同,C3植物最适生长温度一般为20~25℃,其饱和光强为全日照的一半,而C4植物最适生长温度为30~35℃,其净光合作用随着光强的增加而增加,没有饱和光强[21-22]。因此,高光强与温度通常是诱导植物启动C4循环机制的关键环境因子。藻类光合作用过程中产生大量的氧气,在强光下发生光抑制时,碳同化能力的下降会改变细胞内的氧化还原环境,产生对细胞有害的活性氧(Reactive Oxygen Species, ROS)[23]。若此反应过程与清除ROS 的酶系相偶联,如:超氧化物歧化酶(Superoxide Dismutase, SOD)、过氧化物酶(Peroxidase,POD)、过氧化氢酶(Catalase, CAT)和抗坏血酸(Ascorbic Acid)等,则能清除细胞内多余的ROS[23]。这些酶相互之间起到协同作用,其中SOD 是抗氧化系统中最重要的酶类,因其催化超氧自由基形成过氧化氢(H2O2),由此启动下游反应,H2O2又继续被POD 和CAT 清除。因此,C4植物相对于C3植物能更好地应对氧化胁迫,具体表现在抗氧化酶(SOD、CAT 等)活性增加以及非酶抗氧化剂(抗坏血酸)的增加[24]。
基于上述研究基础,本研究选取烟台潮间带的两个绿潮原因物种肠浒苔和Ulva expansa作为研究对象。其中,U. expansa的夏季绿潮在美国加利福尼亚州的蒙特利(Monterey)海湾多次被报道[5,25],在我国烟台牟平海域连续5 年暴发小规模绿潮,对当地海域环境造成一定的影响,具有研究的必要性。本研究利用夏季高温、高光强条件,通过室外培养实验比较了肠浒苔和U. expansa的C3关键酶(二磷酸核酮糖羧化酶,Ribulose Bisphosphate Carboxylase Oxygenase, Rubsico)和C4关键酶(磷酸烯醇式丙酮酸羧化酶,Phosphoenolpyruvate Carboxylase, PEPCase;磷酸烯醇丙酮酸羧激酶,Phosphoenolpyruvate Carboxykinase, PEPCKase)的活性变化特征,分析了它们与光强、温度的响应关系,同时测定了主要的抗氧化酶(SOD、POD)及其 产 物 丙 二 醛( Malondialdehyde, MDA) 的 变 化,MDA 是生物体自由基发生过氧化反应的终产物,可以作为脂膜过氧化程度以及植物的抗逆性的指标,进一步解答两种绿藻的抗氧化能力。实验还分析了藻体对应光合产物δ13C 的变化,探讨了C4途径在两个物种光合固碳中发生作用的可能性。
2 材料与方法
2.1 样品采集与预处理
于2018 年7 月在山东省烟台市牟平区潮间带(37.46°N, 121.71°E)采集肠浒苔和U. expansa样品,装于冰盒带回实验室。挑选出健康藻体,用消毒海水清洗,除去泥沙和其他杂物后,将样品置于40 L 透明塑料箱内,加入经GF/F 膜过滤的自然海水。将培养箱置于室外通风处,每隔1 天换1 次过滤海水,预培养1 周。
2.2 室外培养实验
室外培养实验于2018 年7 月26-29 日期间,在中国科学院烟台海岸带研究所牟平野外台站开展。两种绿藻分别培养,各用3 个培养箱作为平行样,每个培养箱放入40 g(湿重)绿藻样品,加入40 L 过滤海水,再将培养箱放置于室外海水池(60 m×100 m)中(图 1)。培养海水的初始溶解无机氮和磷酸盐浓度分别为34.6 μmol/L 和0.67 μmol/L。培养 时间从8 时开始 到18 时结束,每隔2 h 进行一次取样,每个培养箱每次取样1.2 g(湿重)。样品保存到−80℃超低温冰箱,用于测定酶活和组织δ13C。现场测定日光照强度(TES-1339R, TES)、培养海水温度(PT3003, Anymeter)以及培养海水盐度(S3-Standard kit, Mettler-Toledo)的变化情况。

图 1 室外培养实验场景Fig. 1 The outdoor culture experiment
2.3 酶活的测定
每种酶活测定需0.1 g(湿重)冷冻藻体,称取好的样品在液氮中研磨后进行测定。其中,Rubsico、PEPCase 活性测定分别采用Solarbio 公司的二磷酸核酮糖羧化酶/加氧酶(Rubisco)试剂盒、磷酸烯醇式丙酮酸羧化酶(PEPC)试剂盒;PEPCKase 的活性测定采用南京建成生物工程研究所的磷酸烯醇丙酮酸羧激酶试剂盒。3 种酶的活力单位均定义为在25℃条件下,每克新鲜组织每分钟消耗1 nmol 还原型烟酰胺腺嘌呤二核苷酸(Nicotinamide Adenine Dinucleotide, NADH)所需的酶量(单位:nmol/(min·g))。
SOD、POD 活性和MDA 含量的测定分别采用南京建成超氧化物歧化酶(SOD)测试盒、过氧化物酶(POD)测试盒以及植物丙二醛(MDA)测试盒。SOD的活力单位定义为37℃条件下,在本反应体系中SOD 抑制率达50%时所对应的酶量(单位:U/g);POD 的活力单位定义37℃条件下,每毫克组织蛋白每分钟转化1 μg 底物所需的酶量(单位:U/mg(Protein))。
2.4 藻体组织δ13C 的测定
用0.1 mol/L 盐酸冲洗藻体后,再用Milli-Q 水将酸清洗干净。清洗后的样品冷冻干燥48 h,进行研磨。取0.5~1 mg 研磨样品用4 mm×6 mm 锡箔包样后,以美国南卡罗来纳的石灰岩制品(PDB)的同位素比值为标准,在中国科学院烟台海岸带研究所的稳定同位素质谱仪(MAT 253, Thermo Scientific)上测定藻体δ13C 值。实验室重复测定的分析误差小于0.2‰。
利用端元模型计算了藻体对CO2和的相对利用率[26]。若藻类单独利用CO2,所得的藻体组织δ13C 最大值为−30‰,若藻类单独利用,所得的藻体组织δ13C 最小值为−10‰[27];因此,在公式中纯利用CO2的端元值设定为−30‰,纯利用的端元值设定为−10‰,藻类利用合成光合产物的贡献率( fHCO−3)表达式为
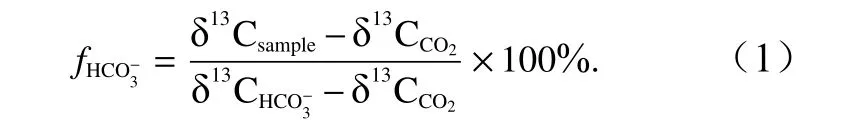
2.5 数据处理与分析
运用SPSS 22 对实验数据进行单因素方差分析(One-way ANOVA)、t检验(t-test)以及Pearson 相关性分析,显著性水平设为p<0.05。数据先采用Shapiro-Wilktest 进行正态性检验,再用Levene 检验进行方差齐性检验;若存在方差不齐的情况,采用Welch 检验。所得数据以平均值±标准偏差表示。

图 2 两种绿藻C3 关键酶(Rubisco)与C4 关键酶(PEPCase、PEPCKase)活性的日变化特征比较Fig. 2 The comparison of diurnal variations of C3 key enzyme(Rubisco) and C4 key enzyme (PEPCase and PEPCKase) activities between U. intestinalis and U. expansa
3 结果
3.1 C3 与C4 关键酶的日变化特征
实验过程中,海水温度变化范围为27.4~32.6℃,光照强度的变化范围为57.5~1 857.6 μmol/(m2·s),最高值均出现在12:00(图 2)。海水盐度的变化范围较小(31.2~32.1),受水分蒸发的影响,最高值出现在实验结束时。
C3关键酶Rubisco 活性的日变化在肠浒苔与U.expansa中存在显著差异(图 2A):肠浒苔的Rubisco 活性在10:00 和16:00 分别出现了高峰值(27.7 nmol/(min·g)和25.4 nmol/(min·g)),活性峰值(10:00)相比初始时间(8:00)增加53.0%,但在中午(12:00-14:00)显著下降(图 2A)。U. expansa的Rubisco 活性高峰值出在12:00(61.5 nmol/(min·g)),高光、高温条件(12:00)并没有抑制U. expansa的Rubisco 活性(图 2A);根据相关性分析,U. expansa的Rubisco 活性与环境因素(温度、光强)呈正相关关系,与温度的相关性极显著(p<0.01),而肠浒苔没有表现出显著相关(表 1)。C4关键酶PEPCase 和PEPCKase 活性在肠浒苔中的显著峰值出现在12:00,分别为68.4 nmol/(min·g)和334.9 nmol/(min·g),比初始时间(8:00)分别增加了82.8%和199.9%,与光强变化一致(图 2B,图 2C);根据相关性分析,PEPCKase 活性与温度、光强呈显著正相关关系(p<0.05)(表 1)。比较而言,C4关键酶PEPCase 和PEPCKase 活性在U. expansa中的变化不显著(图 2B,图 2C),而且PEPCKase 活性与温度、光强呈显著负相关关系(p<0.05)(表 1),说明高光、高温(12:00)没有能够诱导U. expansaC4光合作用途径的高表达。
3.2 两种绿藻光合产物的δ13C 变化特征
已有文献资料表明,C3和C4植物的δ13C 数值范围分别为−35‰~−22‰与−17‰~−11‰之间[28],这是因为Rubisco 同化CO2,而PEPCase 同化,即两种途径优先利用的碳源不同,故导致光合产物δ13C 值存在差异[29-30]。培养期间,肠浒苔的组织δ13C 变化范围为−17.1‰~−15.7‰, fHCO−3的变化范围为64.5%~71.3%(图 3),这表明其同化的比例较高。此外,肠浒苔组织δ13C 在14:00 出现明显偏正的现象,尽管略滞后于C4关键酶PEPCase 和PEPCKase 活性的最高值(图 2B,图 2C),但基本能够指示酶活与产物的对应关系,说明存在C3与C4途径混合的特征。比较而 言,U. expansa的δ13C 范 围 为−23.5‰~−21.9‰,的变化范围为32.4%~40.3%(图 3),表明该物种以C3途径为主,这与酶活测定的结果相对应(图 2B,图 2C)。
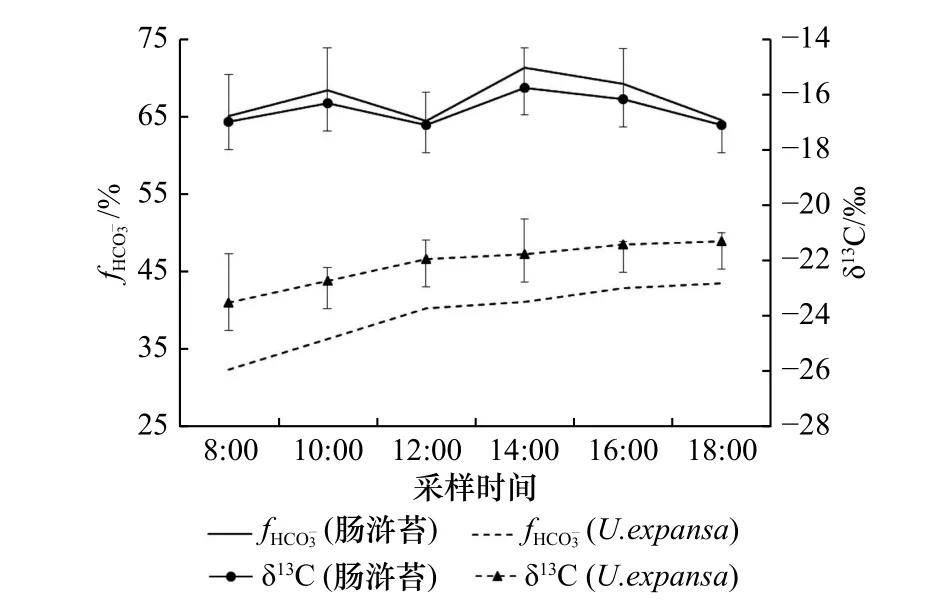
图 3 两种绿藻组织δ13C 和 fHCO−3的日变化特征Fig. 3 The diurnal variations of δ13C and fHCO−3 in the tissue of U. intestinalis and U. expansa
3.3 两种绿藻抗氧化能力的比较
实验过程中,肠浒苔表现出了较强的抗氧化能力,SOD 活性一直保持一个较高的水平,18:00 活性下降(图 4A);POD 活性的峰值出现在早上8:00−10:00(图 4B);MDA 含量的峰值出现在12:00(图 4C)。相关性分析表明,肠浒苔的SOD 活性和MDA 含量与温度、光强呈显著正相关(p<0.05),POD 活性与温度、光强的相关性则不显著(p>0.05)(表 2)。U. expansa的SOD 与POD 活性峰值出现在12:00−14:00;MDA含量的峰值出现在12:00(图 4);相关性分析表明,U.expansa的SOD、POD 活性以及MDA 含量与温度、光强的相关性不显著(p>0.05)(表 2)。
比较而言,肠浒苔SOD 的活性在低光、低温(18:00)条件下比高光、高温(12:00)条件下降了33.3%;而U.expansa的SOD 的活性在低光、低温(18:00)条件下比高光、高温(12:00)条件下降了27.6%。肠浒苔MDA的含量在低光、低温(18:00)条件下比高光、高温(12:00)条件下降了36.9%;而U. expansa的MDA 的含量在低光、低温(18:00)条件下比高光、高温(12:00)条件下降了10.6%。
4 讨论
大多数海洋藻类植物的光合作用途径以C3循环为主,Rubisco 是C3途径中的重要羧化酶,固定CO2并形成碳水化合物[21]。然而,Rubisco 只能利用CO2形式的无机碳,但海水中溶解态CO2浓度较低,不能完全满足其合成需求,因此,藻类植物在进化中形成了二氧化碳浓缩机制(CO2Concentrating Mechanisms,CCMs),促进细胞内CO2浓度的积累。CCMs 能够在Rubisco 周围催化脱羟基释放CO2,完成相应的浓缩反应[31-32]。C4循环则可以直接利用,通过PEPCase、PEPCKase 等酶的催化作用,在细胞内完成对CO2的收集、浓缩和转运等系列过程[14,33-35]。海洋藻类C4循环功能的机制与重要性目前仍存在科学争议,例如,有研究认为C4循环途径在藻类植物的固碳中扮演重要角色[35],但也有研究表明C4循环的主要功能是参与能量代谢,驱散细胞内多余的光能,对固碳作用的贡献不大[36]。本研究中发现肠浒苔与U. expansa的光合途径存在显著差异,前者的光合固碳可能由C3和C4途径共同参与,而后者则主要通过C3途径进行。藻类植物的光合途径变化受到多种环境因子的诱导,如温度、光强、CO2浓度、营养盐、盐度等[12,15,37-38]。多数研究表明,C4循环过程中需要合成相应的酶蛋白,是一个高耗能过程,因此,充足的营养盐浓度、温度与光强是诱发C4途径活跃的重要环境条件[12,39],本研究的藻类培养液中设置了较高的营养盐浓度,充分保证了C4途径的物质合成需求。由于C4途径没有饱和光强限制,故其净光合作用随着光强的增加而增加,在白天最高光强时的光合潜力最大。研究表明,90%的碳同化率的变动是由光强变化导致的[40-42],晴天中午的高光条件往往是激发酶活力变化的主导因素。在本研究中,C4关键酶PEPCase 和PEPCKase 活性在肠浒苔中的峰值出现在中午(图 2B,图 2C),对应了最高光强,且同时形成了偏正的δ13C 值(−17.1‰~−15.7‰)与高的 fHCO−值(64.5%~71.3%),指示了C4循环极可能参与了该物种的光合固碳。相比之下,C3光合作用途径的重要羧化酶Rubisco 的活性容易受到强光照(1 200~1 500 μmol/(m2·s))的抑制作用[43-44],在培养过程中,肠浒苔的Rubisco 活性在中午(12:00−14:00)强光照条件下(大于1 600 μmol/(m2·s))明显受到抑制。因此,推测C4循环参与补充了该物种的光合固碳能力。

图 4 两种绿藻抗氧化物酶(SOD、POD)活性和MDA 含量的日变化特征比较Fig. 4 The comparison of antioxidant enzymes (SOD, POD)actirities and MDA content between U. intestinalis and U. expansa, corresponding to diurnal variations

表 2 两种绿藻的抗氧化酶(SOD,POD)活性以及MDA 含量与温度、光强的相关性Table 2 Correlation between antioxidase activities, MDA content of U. intestinalis and U. expansa vs. temperature and light intensity
比较而言,U. expansa在培养过程中表现出的光合作用特征与肠浒苔存在显著差异。该物种遵循了大多数海洋藻类的光合特征,其δ13C 范围(−23.5‰~−20.9‰)与的比例(32.4%~40.3%)均表明该物种是以C3途径为主要固碳方式(图 3)。C4关键酶PEPCase 和PEPCKase 活性的变化在培养过程中不显著,且Rubisco 活性高峰值出在中午最高光强,没有出现光抑制现象,可能由于上午U. expansa的Rubisco 活性较高,光合能力较强,释放出大量的O2,使得中午的藻体处于高O2分压低CO2的状态,则促进Rubisco的加氧反应,即光呼吸过程[45]。这些特征也表现在两个物种的抗氧化能力上。光合作用的不同导致放氧量不同,细胞内部积累大量的ROS,使得抗氧化和氧化的平衡状态被破坏,而SOD、POD 等多种抗氧化酶不仅能清除多余的ROS 来维持胞内的代谢平衡,还能维持一定的光合电子流,来减缓多余光能对光合系统造成的损害[23,46]。本研究的结果表明,在相同条件下,肠浒苔SOD 的活性明显高于U. expansa,活性变化没有U. expansa剧烈,所以受到的胁迫损伤也相应较小;作为脂膜过氧化程度的指示物,U. expansa的MDA 含量均高于肠浒苔。由此推测,高温、高光强对U. expansa的影响高于肠浒苔,部分原因是抗氧化能力不如肠浒苔。实验后期U. expansa的POD 活性略高于肠浒苔,可能是其本身反应相对滞后或者与其他抗氧化酶起协同作用。有研究表明,C4光合作用酶(特别是PEPCase)的基因高表达能诱导SOD 和POD 的活性增强,并且随着光抑制(强光)的加剧,SOD 和POD 的活性也逐步增强,ROS 产生速率较低,MDA 积累较少,维持较稳定的光合能力,从而表现出较强的耐光抑制能力[47-49]。由此推测,肠浒苔较强的抗氧化能力可能与PEPCase 的高表达有关。
此外,有研究发现较高的温度有助于诱导植物形成类似C4循环的光合途径,处于高温环境下的时间越长,C4途径的PEPCase 的活性越大[50-51]。例如,C3途径在15~30℃范围内,净光合速率与温度正相关;而C4途径在30~40℃范围内的净光合速率与温度正相关,且大于C3途径的净光合速率[52-53]。这些研究结果有助于解释绿潮物种的季节演替现象,例如,1997 年夏季美国加利福尼亚州的纽波特河口暴发的绿潮主要组成物种是肠浒苔和U. expansa,到了秋季,随着温度降低,逐渐演变成U. expansa和Ceramiumsp.[5];烟台牟平海域U. expansa通常是在7 月暴发,7 月底至8 月初,随着海水温度升高而迅速消亡。U.expansa的演替与消亡现象,表明该物种暴发的温度上限低于肠浒苔,与本研究的实验结果相吻合。
5 结论
通过对肠浒苔和U. expansa的光合作用酶及其藻体光合产物的关联性分析,发现肠浒苔与U. expansa的光合途径存在显著种间差异性。在高温、高光条件下,C4关键酶活性在肠浒苔中表达活跃,与光合产物形成对应关系指示了其光合作用可能由C3与C4途径共同参与;而U. expansa的C4关键酶活性表达不活跃,与光合产物形成对应关系指示了其光合作用主要依靠C3途径进行。然而,C4循环在藻类植物中的功能表达存在不确定性,未来还需要探索进一步其他环境因素的诱导作用以及藻类的基因表达特征。
致谢:感谢华东师范大学孙赛赛、周鹏、周豪对样品采集和培养实验的帮助,以及烟台海岸带研究所谭扬对碳同位素测定的帮助。
