基于两阶段L-谷氨酸添加的功能性红曲产酸式Monacolin K的发酵工艺优化
2020-09-03于卓然陈程鹏张耀邱晓曼莫晶田冉洪厚胜
于卓然,陈程鹏,张耀,邱晓曼,莫晶,田冉,洪厚胜,2*
1(南京工业大学 生物与制药工程学院,江苏 南京,211816)2(南京汇科生物工程设备有限公司,江苏 南京,210009)
红曲起源于中国,古称丹曲、神曲,是以蒸熟的大米为原料经红曲菌固态发酵而成,广泛应用于食品着色、腐乳、食醋、酿酒和医药等领域,既是食品,也是具有降血压降血脂功能的传统中药[1-2]。功能性红曲是以降胆固醇活性物质Monacolin K为主要成分的红曲。高血压是最常见的心血管疾病,是引发心脑血管疾病、脑卒中和冠心病的最主要因素,相较于其他降脂药品,以红曲为主要成分的药品和保健品毒性更小,具有更高的安全性,因此红曲发酵产品具有广阔的市场前景[3]。
1979年,日本学者远藤章在对红曲的研究中,从红色红曲菌(Monascusruber)中分离得到了一种能够抑制人体内胆固醇合成的物质,并将其命名为Monacolin K[4]。1980年,美国学者ALBERTS在土曲霉培养液中分离出了与Monacolin K化学结构相似的代谢产物,命名为mevinolin,现称为洛伐他汀(lovastatin),经过后续研究证明,远藤章发现的Monacolin K与洛伐他汀为同一种物质[5]。酸式Monacolin K的结构与人体内胆固醇合成途径中的HMG-CoA的结构相似,能与胆固醇合成过程中的限速酶HMG-CoA形成竞争性抑制,从而抑制胆固醇的合成,而内酯式Monacolin K只是一种前体药物,本身并无活性,需要被人体内的羧基酯酶转化为酸式结构,才能够进一步发挥降胆固醇的作用,酸式Monacolin K的含量是衡量红曲产品的降脂效果的一项重要指标[6]。目前国内外对红曲发酵产Monacolin K的研究多以Monacolin K总量的提升作为目标,以提高酸式Monacolin K含量为目的的研究鲜有报道[7]。Monacolin K的代谢调控是红曲发酵工艺研究的新热点,代谢调控就是从分子水平上控制Monacolin K的合成[8-10]。具体方法为通过基因改造或者添加代谢调控物质使代谢过程中相关基因抑制表达或过表达,从而达到控制Monacolin K合成途径的目的[11-12]。研究表明,谷氨酸能够影响红曲菌Monacolin K生物合成基因簇的表达[13],本实验在此基础上选取L-谷氨酸作为代谢调控物质优化功能性红曲固态发酵工艺。本实验以紫色红曲菌(CGMCC No.18110)为发酵菌种,以酸式Monacolin K产量为评价指标,将L-谷氨酸作为其代谢调控物质,首次采用在发酵不同阶段添加L-谷氨酸的固态发酵技术[14],利用响应面优化发酵条件,通过观察菌体形态在发酵过程中的变化情况并联系现有的研究报道进行分析,为红曲产品的开发生产提供工艺方法和基础实验数据。
1 材料与方法
1.1 材料与试剂
大米,中国黑龙江;实验菌种CGMCC No.18110(紫色红曲菌,Monascuspurpureus),中国微生物菌种保藏管理委员会普通微生物中心。
内酯式Monacolin K标准品(纯度≥98%)、L-谷氨酸,aladdin公司;大豆粉、玉米粉、甘油,上海麦克林生化科技有限公司;麦芽浸粉、蛋白胨,青岛高科工业园海博生物技术有限公司;无水葡萄糖、琼脂、NaNO3、K2HPO4、MgSO4·7H2O、NaOH、无水乙醇、磷酸(均为分析纯),国药集团化学试剂有限公司;乙腈(色谱纯),上海吉至生化科技有限公司。
1.2 仪器与设备
PYX-DHS-BS-Ⅱ 隔水式电热恒温培养箱,上海恒跃医疗器械有限公司;ZQTY-70台式全温振荡培养箱,上海知楚仪器有限公司;GZX-9140MBE电热恒温鼓风干燥箱、YXQ-LS-50S-Ⅱ 立式压力蒸汽灭菌器、SW-CJ-2FD净化工作台,上海博迅实业有限公司医疗设备厂;KQ-100超声波清洗器,昆山市超声仪器有限公司;1260 Infinity高效液相色谱仪,美国安捷伦公司。
1.3 实验方法
1.3.1 培养基配制
1.3.1.1 固态种子培养基
蛋白胨30 g/L,麦芽汁浸粉30 g/L,琼脂15 g/L,无菌水定容至100 mL,0.1 MPa、121 ℃灭菌20 min[15]。
1.3.1.2 液态种子培养基
无水葡萄糖60 g/L,蛋白胨25 g/L,玉米粉10 g/L,NaNO32 g/L,K2HPO41 g/L,MgSO4·7H2O 1 g/L,无菌水定容至100 mL,0.1 MPa、121 ℃灭菌20 min[16]。
1.3.2 固体种子培养
将紫色红曲菌(CGMCC No.18110)接种到平板固体种子培养基中,在30 ℃条件下培养7 d。
1.3.3 液体种子培养
用无菌水将培养基上的孢子洗脱,打散摇匀,制成浓度为106CFU/mL的孢子悬液。将孢子悬液按5%的接种量接种到盛有200 mL液体种子培养基的500 mL三角瓶中,在32 ℃、180 r/min条件下振荡培养48 h,制得紫色红曲菌株活化液[17]。
1.3.4 基于两阶段L-谷氨酸添加的功能性红曲固态发酵工艺
将大米浸泡1~2 h,沥干水分,蒸熟。称取150 g放入500 mL三角瓶中,用透气封口膜封口,121 ℃灭菌20 min,冷却后在无菌条件下向每个三角瓶中的固态发酵基质中接入液体种子,拌匀后封口。
根据前期预试验的结果,固态发酵的发酵条件为接种量15%,发酵周期22 d(前3 d为常温发酵阶段,发酵温度30 ℃,使菌丝快速生长布满发酵基质,后19 d为低温发酵阶段,发酵温度20 ℃,便于次级代谢产物Monacolin K的积累[18-20])。在此基础上,选取甘油为外加碳源,大豆粉为外加氮源,L-谷氨酸为前体物质和代谢调控物质,并在低温发酵5 d后再次添加L-谷氨酸(将L-谷氨酸溶于10 mL无菌水,在超净工作台上打开封口,滴入L-谷氨酸溶液,再重新封口继续发酵)。发酵结束后将发酵物于55 ℃条件下烘干,磨粉后过40目筛,收集红曲粉保存备用。
1.3.5 功能性红曲固态发酵条件优化
1.3.5.1 功能性红曲固态发酵工艺条件的单因素试验
结合报道研究和预试验结果[21-22],基于两阶段L-谷氨酸添加的功能性红曲固态发酵工艺采用大米为发酵底物,大豆粉为外加氮源,甘油为外加碳源,L-谷氨酸为前体物质和代谢调控物质,分别固定装料量150 g,接种量15%,发酵时间22 d,采用变温发酵(常温发酵温度30 ℃,低温发酵温度20 ℃),分别考察大豆粉添加量、甘油添加量、常温发酵阶段L-谷氨酸添加量、低温发酵阶段L-谷氨酸添加量(各因素添加量均为质量分数)等单因素对功能性红曲固态发酵产酸式Monacolin K的影响。根据单因素的试验结果,选择对酸式Monacolin K产量影响显著的因素进行响应面试验设计。
1.3.5.2 功能性红曲固态发酵工艺条件的响应面优化试验
在单因素试验的基础上,根据Box-Behnken试验设计原理,以酸式Monacolin K产量为响应值,大豆粉添加量、常温发酵阶段L-谷氨酸添加量、低温发酵阶段L-谷氨酸添加量为自变量,采用Design-Expert软件设计3因素3水平的响应面优化试验,设计因素和水平如表1所示。

表1 响应面试验因素及水平
1.3.6 酸式Monacolin K含量的检测方法
1.3.6.1 样品处理
将发酵物在55 ℃条件下烘干8~10 h,研磨过40目筛,取0.3 g于50 mL比色管中,用体积分数为70%乙醇溶液定容至30 mL,55 ℃水浴1 h,每20 min摇匀1次,水浴结束后取5 mL萃取液过0.22 μm滤膜过滤[23]。
1.3.6.2 色谱条件
色谱柱为C18色谱柱(150 mm×4.6 mm,5 μm),流动相为V(乙腈)∶V(水溶液)=55∶45,用H3PO4调至pH 2.5,流速1 mL/min,紫外检测波长238 nm,进样量20 μL,柱温28 ℃。
1.3.6.3 酸式Monacolin K标准曲线的绘制
精密称定内酯式Monacolin K标准品20 mg,置于100 mL量瓶中,加入55 ℃的体积分数为70%乙醇溶液90 mL,以质量浓度为200 g/L NaOH溶液调节pH至7.7,再用体积分数为70%乙醇溶液定容至100 mL,55 ℃水浴30 min,制得200 mg/L酸式Monacolin K母液,分别稀释成质量浓度为12.5、25、100、150、200 mg/L标准液,用HPLC检测其峰面积,以酸式Monacolin K标准溶液峰面积y对质量浓度x线性回归,可得回归方程为y=64.198x+23.938,R2=0.999 9,线性关系良好。
1.4 数据处理及分析
本实验所有数据取3次重复实验的平均值,采用Origin 9.1、SPSS Statistics 17.0、Design-Expert 7.0软件进行数据处理与分析。
2 结果与分析
2.1 功能性红曲固态发酵工艺条件的单因素试验结果
2.1.1 发酵时间对酸式Monacolin K产量的影响
由图1可知,酸式Monacolin K的产量随着发酵时间的变化呈先上升至最高值后下降的趋势。在发酵的前14 d,酸式Monacolin K产量快速增高,之后增长速度减缓。发酵22 d后酸式Monacolin K产量呈下降趋势。在发酵过程中,随着发酵时间的增长,次级代谢产物不断累积,而在发酵的后期发酵基质消耗殆尽,菌体生长代谢受到抑制并开始消耗发酵产物,导致酸式Monacolin K产量下降,因此固定发酵周期为22 d,并将此条件下的发酵样品作为空白对照,即对照组酸式Monacolin K含量为0.562 mg/g。

图1 发酵时间对酸式Monacolin K产量的影响
2.1.2 大豆粉添加量对酸式Monacolin K产量的影响
实验发现,外加氮源对菌体的生长速度有一定的影响,适量加入氮源有利于菌体的生长和次级代谢产物的累积,结合实际生产成本,选择大豆粉作为外加氮源[24]。由图2可知,大豆粉添加量低于2%(质量分数)时,酸式Monacolin K产量呈增加的趋势,当添加量大于2%(质量分数)时,酸式Monacolin K产量呈下降趋势。氮源添加量过高会导致菌体生长繁殖过快,营养基质消耗过快,导致次级代谢产物合成量降低。综上所述,最佳大豆粉添加量为2%(质量分数)。

图2 大豆粉添加量对酸式Monacolin K产量的影响
2.1.3 甘油添加量对酸式Monacolin K产量的影响
研究表明甘油作为外加碳源可以提高红曲菌固态发酵中Monacolin K的产量[25],而其对于酸式Monacolin K产量的提升还需要进一步验证。由图3可知,随着甘油添加量的增加,酸式Monacolin K的产量呈先增加后降低的趋势,甘油添加量2.5%(质量分数)时,酸式Monacolin K的产量最高,对比空白对照组,甘油添加量对于酸式Monacolin K产量的影响并不显著,过量添加会抑制酸式Monacolin K的产生。虽然研究表明,甘油作为外加碳源可以促进Monacolin K总产量的提高,但是其对于单一酸式Monacolin K的产量影响不大,因此本试验不选择甘油作为响应面的优化条件。

图3 甘油添加量对酸式Monacolin K产量的影响
2.1.4 常温发酵阶段L-谷氨酸添加量对酸式Monacolin K产量的影响
如图4所示,酸式Monacolin K的产量呈先增加后降低的趋势,在L-谷氨酸添加量(质量分数)为2%时,酸式Monacolin K产量达到最高,添加方式为直接在发酵基质中加入相应质量比的L-谷氨酸。酸式Monacolin K作为一种他汀类物质,其合成途径为聚酮化合物合成途径[26],L-谷氨酸作为前体物质,可以被利用到酸式Monacolin K的生物合成中,适当添加可以有效提高他汀类物质的生物合成量[27]。综上,常温发酵阶段L-谷氨酸的最适添加量为2%(质量分数)。

图4 常温发酵阶段L-谷氨酸添加量对酸式Monacolin K产量的影响
2.1.5 低温发酵阶段L-谷氨酸添加量对酸式Monacolin K产量的影响
在常温发酵阶段菌体增长与代谢速度快,功能性红曲固态发酵周期长达20 d,L-谷氨酸在常温发酵阶段被大量消耗,因此选择在发酵的第8天(低温发酵的第5天)再次添加L-谷氨酸,对红曲发酵酸式Monacolin K进行代谢调控。添加的方式为将相应质量比的L-谷氨酸溶解于10 mL无菌水中,在无菌条件下均匀加入发酵物中。如图5所示,酸式Monacolin K产量随低温阶段L-谷氨酸添加量的增加而增加,当添加量为3.25%(质量分数)时酸式Monacolin K产量最高。因此选择低温发酵阶段L-谷氨酸添加量3.25%(质量分数)为最佳条件。

图5 低温发酵阶段L-谷氨酸添加量对酸式Monacolin K产量的影响
2.2 功能性红曲固态发酵工艺条件的单因素试验结果
以单因素的试验结果为基础,选择对酸式Monacolin K产量影响较大的3个因素:大豆粉添加量、常温发酵阶段L-谷氨酸添加量和低温发酵阶段L-谷氨酸添加量。固定装料量150 g,接种量15%,发酵时间22 d(前3 d为常温发酵,后19 d为低温发酵),常温发酵温度30 ℃,低温发酵温度20 ℃,采用Box-Behnken试验设计试验方案,进一步优化发酵工艺条件,试验设计及结果如表2所示。利用Design-Expert软件对表2中的试验数据进行回归分析,表3为二次回归模型方差分析结果。对表3中数据进行二次多项回归拟合,得到酸式Monacolin K产量(Y)与大豆粉添加量(A)、常温发酵阶段L-谷氨酸添加量(B)、低温发酵阶段L-谷氨酸添加量(C)的二次多项式回归方程为:Y=6.68-0.05A+0.23B+0.24C-0.13AB+0.14AC+0.084BC-0.91A2-0.31B2-0.32C2。
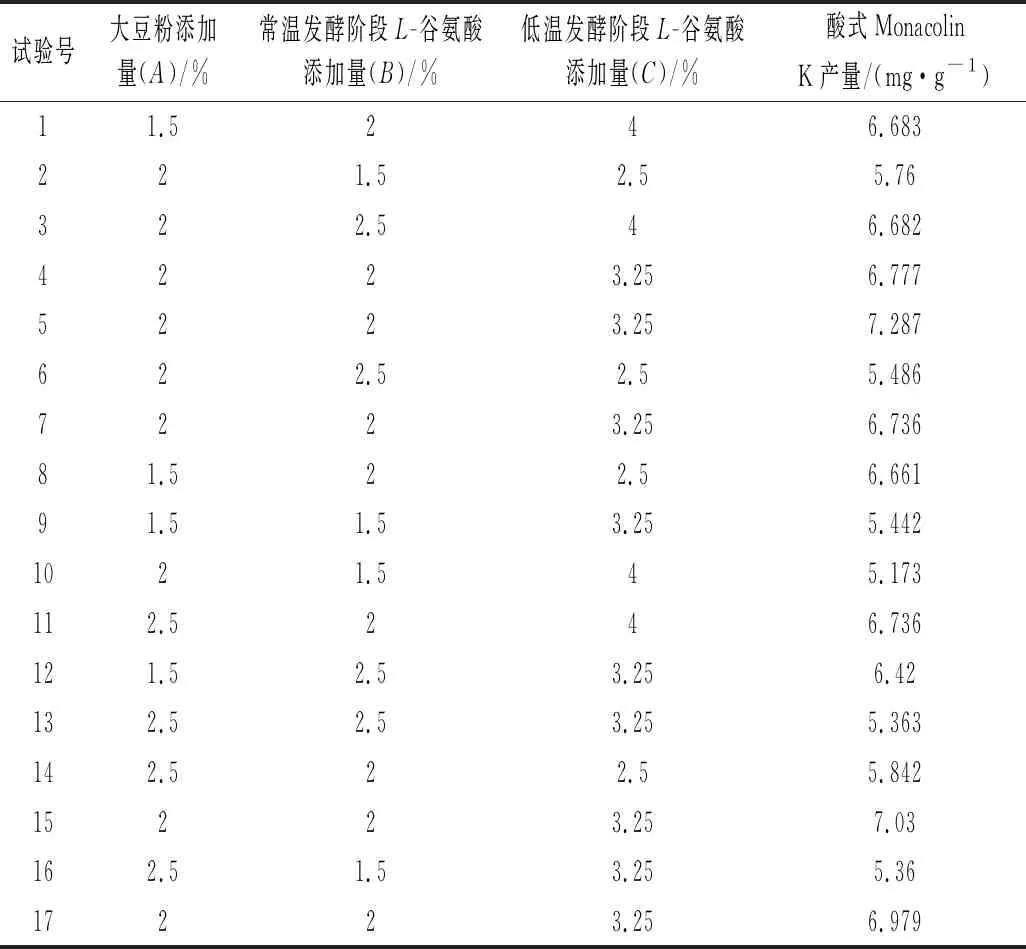
表2 Box-Behnken试验设计与结果
由表3可知,二次项回归方程拟合性良好,该模型对于基于两阶段添加L-谷氨酸的功能性红曲固态发酵酸式Monacolin K工艺优化具有实际应用意义。

表3 回归模型方差分析结果
二次项回归方程分析表明,各因素对酸式Monacolin K产量的影响程度为B>A>C,即常温发酵阶段L-谷氨酸添加量>大豆粉添加量>低温发酵阶段L-谷氨酸添加量;模型的二次项A2影响显著(P<0.05),B2影响极显著(P<0.01),且交互项AB、AC影响显著(P<0.05),BC影响极显著(P<0.01)。
由图6-a可知,大豆粉添加量与常温发酵阶段L-谷氨酸添加量交互作用显著。由图6-b可知,大豆粉添加量和低温发酵阶段L-谷氨酸添加量交互作用显著。由图6-c可知,常温发酵阶段L-谷氨酸添加量与低温发酵阶段L-谷氨酸添加量交互作用显著。

a-大豆粉添加量和常温发酵阶段L-谷氨酸添加量响应面;b-大豆粉添加量和低温发酵阶段L-谷氨酸添加量响应面;c-常温发酵阶段L-谷氨酸添加量和低温发酵阶段L-谷氨酸添加量响应面;d-大豆粉添加量和常温发酵阶段L-谷氨酸添加量等高线;e-大豆粉添加量和低温发酵阶段L-谷氨酸添加量等高线;f-常温发酵阶段L-谷氨酸添加量和低温发酵阶段L-谷氨酸添加量等高线图6 各因素交互作用对酸式Monacolin K产量影响的响应面和等高线
根据响应面软件分析计算得到功能性红曲固态发酵酸式Monacolin K的最佳工艺条件为大豆粉添加量1.89%(质量分数)、常温发酵阶段L-谷氨酸添加量2.18%(质量分数)、低温发酵阶段L-谷氨酸添加量3.88%(质量分数)、装料量150 g、接种量15%、发酵时间22 d。在此条件下,模型预测酸式Monacolin K产量的理论值为7.118 mg/g。
2.3 回归模型的验证实验结果
根据响应面分析所得的最优工艺条件,结合实际操作情况,设置验证实验的条件为大豆粉添加量2%(质量分数)、常温发酵阶段L-谷氨酸添加量2%(质量分数)、低温发酵阶段L-谷氨酸添加量4%(质量分数)、装料量150 g、接种量15%、发酵时间22 d(常温30 ℃发酵3 d,低温20 ℃发酵19 d,并在低温发酵5 d后再次添加L-谷氨酸),在此条件下进行3次重复实验,取平均值。验证试验中酸式Monacolin K产量的平均值为6.848 mg/g,与模型预测值相近,表明优化模型可靠。
2.4 L-谷氨酸对于固态发酵红曲菌代谢调控原理及菌丝体形态的影响
Monacolin K的生物合成途径主要包括九酮主体的合成和二酮侧链的合成,九酮主体与二酮侧链合成的都是以丙二酸和乙酸为起始物质,其中九酮主体的合成是乙酸和丙二酸由九酮合酶(lovastatin nonaketide synthase, LNKS)、酮基还原酶(ketoreduetase,KR)、烯醇还原酶(enoyl reductase,ER)以及甲基转移酶(methyltransferase,MeT)催化,经缩合、还原、脱水形成中间体二酮(diketide),而后重复这一过程形成己烯酮(hexaketide),己烯酮再经过环化作用生成双环萘烷骨架再经过一系列催化形成九酮体壬烯酮,后者经聚酮合酶(polyketidesynthase,PKS)释放再经氧气作用形成3α-羟基-3,5-二氢Monacolin L,后者在进一步脱氢转化为Monacolin L,Monacolin L在有氧条件下经P450单加氧酶转化为Monacolin J,最后Monacolin J再经转酯酶作用与二酮侧链连接形成Monacolin K。研究表明红曲菌中的mokE是上述代谢途径中脱氢酶的编码基因,L-谷氨酸能够正向调节mokE基因的表达,增加中间产物Monacolin J的转化量,从而提高Monacolin K的产量[28]。
由图7-a可知,该红曲菌在未添加L-谷氨酸的固态发酵基质中的形态结构是以无性繁殖为主,菌丝有大量繁杂分枝,菌丝体相互呈网结联合。图7-b为添加L-谷氨酸的发酵基质中红曲菌的菌丝体形态,对比图7-a可以看出,菌丝之间网联结合减少,菌丝更加紧密繁茂。图7-c与图7-d提高放大倍数进行观察,可以看出添加L-谷氨酸的发酵基质中红曲菌的菌丝体更为粗短,能够促进丝状真菌次级代谢产物的产生[29]。表明L-谷氨酸可以使红曲菌的网结联合减少、菌丝更紧密繁茂、菌丝体更粗短,有利于其次级代谢产物酸式Monacolin K产生[30]。根据林琳等[31-32]的进一步研究表明,L-谷氨酸能够使Monacolin K生物合成基因簇中的mokE基因过表达,mokE基因过表达除了能够在代谢途径调节Monacolin K的产量,还会使菌丝体形态更为粗短,并且抑制红曲菌的有性繁殖,有利于次级代谢产物的产生。

a-未添加L-谷氨酸的发酵基质中的红曲菌(×5 000);b-添加L-谷氨酸的发酵基质中的红曲菌(×5 000);c-未添加L-谷氨酸的发酵基质中的红曲菌丝(×10 000);d-添加L-谷氨酸的发酵基质中的红曲菌丝(×10 000)图7 未添加L-谷氨酸与添加L-谷氨酸发酵基质中红曲菌扫描电镜图
3 结论
本研究以酸式Monacolin K产量为评价指标,改进传统功能性红曲固态发酵工艺为基于两阶段L-谷氨酸添加的功能性红曲固态发酵工艺,首次采用在发酵的低温阶段补充加入红曲菌代谢调控物质L-谷氨酸的工艺方法,通过单因素试验考察发酵时间、大豆粉添加量、甘油添加量、常温阶段L-谷氨酸添加量、低温发酵阶段L-谷氨酸添加量对红曲固态发酵酸式Monacolin K产量的影响,利用Box-Behnken试验设计进一步对发酵工艺条件进行响应面优化试验,得出最佳发酵条件为大豆粉添加量2%(质量分数)、常温发酵阶段L-谷氨酸添加量2%(质量分数)、低温发酵阶段L-谷氨酸添加量4%(质量分数)、装料量150 g、接种量15%、发酵时间22 d(常温30 ℃发酵3 d,低温20 ℃发酵19 d,并在低温发酵5 d后再次添加L-谷氨酸)。该条件下模型预测酸式Monacolin K产量的理论值为7.118 mg/g,经验证实验得出酸式Monacolin K产量可以达到6.848 mg/g,与预测值相近,表示响应面法对于功能性红曲固态发酵工艺的优化是可信的。本实验仅以酸式Monacolin K为单一目标产物,产量已符合轻工业行业标准规定的Monacolin K(包括酸式Monacolin K和内酯式Monacolin K)含量不少于4 mg/g,高于大部分研究报导中的酸式Monacolin K产量。本试验两阶段代谢调控物质添加的工艺方法对功能性红曲产品的发酵工艺方法改进具有一定的启发意义。
