有关产率的解题策略
2020-08-31张晓玲
张晓玲


摘要:本文从多个方面阐述了有关产率问题的多种题型和解题策略,对于高考复习提高教学质量和学生的综合能力具有一定的现实意义。
关键词:高考,产率,计算,分析
近几年高考化学试题关于产率的考查比较频繁,既有产率计算的考查,也有以文字叙述形式考查产率的分析。这类试题具有较强的实用性和综合性,能较好地考查学同学们信息获取能力、分析问题能力、语言表达能力和计算能力等。
题型一:产率的计算
生产中实际产量往往会低于理论产量。为体现反应效率,可以用下面的公式来计算
产率:%产率=(实际产量/理论产量)x 100%
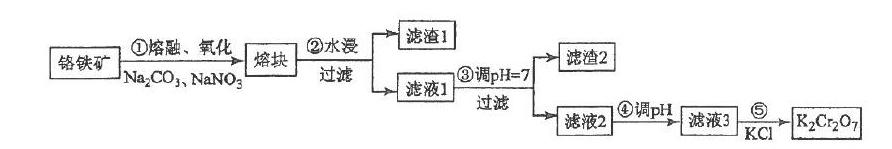
例:重铬酸钾一般由铬铁矿制备,铬鐵矿的主要成分为FeO·Cr2O3。制备流程如图所示:
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
题型二:产率的分析
多以简答题形式要求学生结合题意和图像说明产率变化的原因。不仅考查同学们的逻辑思维能力,分析和解决问题的能力,也考查学生的语言表达能力.平时考试和高考阅卷分析发现,文字表达题是学生主要的失分点之一。
1.化学工艺流程题产率的分析 掌握基本反应原理,提炼信息,全面分析
例:一种利用钢铁厂烟灰(含Mn、Fe、SiO2,少量的Al2O3、CaO及MgO)制备MnCO3的工艺流程如下:
已知25℃时,下列难溶物的溶度积常数:
回答下列问题
步骤Ⅴ沉锰时,在60℃按投料比 =2,溶液的pH对MnCO3产率的影响如图1所示;pH=7,按投料比 =2,反应温度对MnCO3产率的影响如图2所示。
①图1中,在pH<7.0时,pH越小产率(填“越高”或“越低”);在pH>7.0时,pH越大产率越低且纯度也降低,其原因是。
分析 ①读图1可知 ,在pH<7.0时,产率随pH 的增大而增大,pH越小MnCO3产率越小;pH>7.0 时氢氧根离子浓度增大到一定程度, 由表格所给溶度积Ksp可知,pH>7.0 时,溶液碱性增强,MnCO3 部分会转化为溶解度更小的Mn(OH)2,导致产率和纯度降低,②图2中,温度高于60℃时,温度越高产率越低且纯度也越低,主要原因是。
分析 ② 由图2 可知,60℃ 时,MnCO3产率最大,温度高于60℃时, 产率越低。
思维方式,从反应物和生成物两方面分析。温度升高目标产物MnCO3水解程度越大,反应物,(NH4)2CO3和MnCO3也会热分解,导致产率和纯度降低.
2.实验题中的产率分分析 立足于基础知识,多角度动态分析,有序思维。
例 实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示
Ⅰ. 装置C中盛有17.4g FeCO3和200mL 1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置C中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
pH过低或过高均导致产率下降,其原因是 解题过程 ①过程Ⅰ加入柠檬酸促进FeCO3溶解并调节溶液pH,当pH 过低即酸性较强时,甘氨酸会与H+ 反应;当pH 过高即溶液中OH- 较大时,Fe2+ 与OH- 反应生成Fe(OH)2沉淀,故pH 过低或过高均会导致产率下降;
3.化学反应原理产率的分析 准确运用化学反应原理,在复习过程中归纳和总结,不断积累解题方法和技巧。
分析方法 1(平衡产率)只与平衡有关,分析时联系平衡转化率,若平衡向正反应方向移动,平衡产率增大,反之减小。2产率,不一定是平衡产率,产率的变化可能与化学反应速率有关也可能与平衡移动有关。3若产率增大,可能是条件改变使平衡向正反应方向移动;或未到达平衡,正在向正反应方向建立平衡。4如果产率降低,可能是条件改变平衡向逆反应方向移动;或是条件改变导致逆反应速率增大或者正反应速率减小,如温度升高导致催化剂活性降低或者温度升高导致副反应增多;或者是产物在一定条件下发生副反应(分解,被氧化等等)而被消耗。如果存在主反应和副反应的竞争, 尽可能选择有利于主反应的催化剂和温度等其它反应条件使主反应的反应速率尽可能快,反应限度尽可能大。
参考文献:
1 2017年全国卷2
2 2019·河北中原名校联考
